二肽基肽酶-4抑制剂对2型糖尿病患者血液流变学及糖脂代谢的影响
黄慧梅
广东省中山市中医院内科,广东中山 528400
糖尿病的大血管并发症是糖尿病患者的主要死亡原因,微血管病变中的糖尿病视网膜病变、糖尿病肾病严重影响患者的生活质量。DPP-4抑制剂西格列汀可能具有独立于降糖作用以外的血管保护作用,基础研究表明其保护血管的机制可能与抗炎、抗氧化、改善内皮功能等有关[1]。血液流变学是一种易于执行的实验室检查,有证据显示血液流变学参数的改变发生于早期微循环受损,在血管病变出现之前已经发生[2]。本研究从血液流变学的角度探讨DPP-4抑制剂是否具备降糖以外的早期保护血管的作用,有利于在早期对糖尿病血管病变进行干预。
1 资料与方法
1.1 一般资料
选取2018年1月至2020年1月中山市中医院内科收治的165例2型糖尿病门诊患者临床资料进行回顾性分析,按照治疗方法不同分为A(n=82)、B(n=83)两组。纳入标准:符合《中国2型糖尿病防治指南(2017年版)》[3]中2型糖尿病诊断标准;排除标准:①治疗前4周使用胰岛素促泌剂及肠促胰岛素、胰岛素增敏剂患者;②其他重症内科疾病;③家族性糖尿病史患者;④急性感染期或感染性疾病患者;⑤恶性肿瘤;⑥其他药物治疗;⑦依从性差;⑧妊娠期、哺乳期;⑨其他内分泌疾病,如甲状腺功能减退;⑩本研究药物过敏或不耐受;⑪其他糖尿病严重急慢性并发症。两组患者一般资料比较,差异无统计学意义(P>0.05)。具有可比性。见表1。
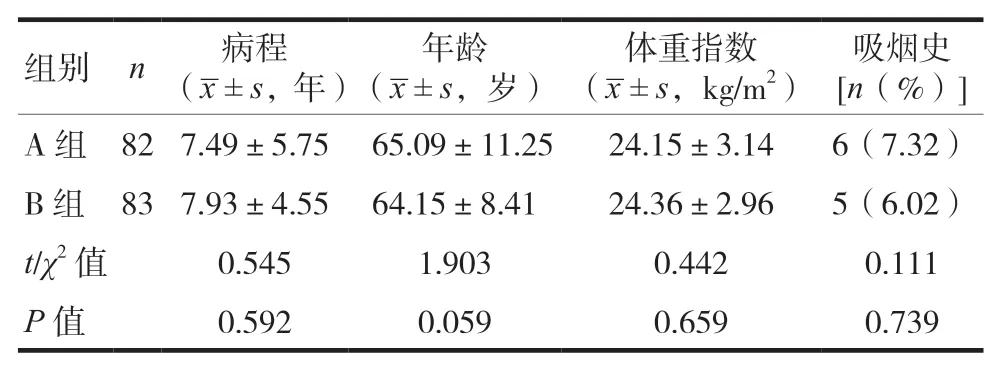
表1 两组患者一般资料比较
1.2 方法
两组患者均给予胰岛素(诺和灵30R)皮下注射治疗,早晚餐前20~30 min,剂量因人而异,由医生根据患者的病情而定。然后A组采用DPP-4抑制剂(杭州默沙东制药有限公司,批准文号:国药准字J20140095;规格:100 mg×7片×2板)治疗,100 mg/次,1 次/d;B组采用二甲双胍(中美上海施贵宝制药有限公司,批准文号:国药准字H20023370;规格:0.5 g×20 片)治疗,初始质量0.25 g/次,3 次/d,1周后调整为0.5 g/次,3 次/d,两组患者均治疗6个月。
1.3 观察指标
观察两组治疗6个月后糖脂代谢及血液流变学变化。禁食12 h,晨起空腹采集静脉检测糖脂代谢相关指标:空腹血糖、肌酐、尿素氮、总胆固醇、高密度脂蛋白、低密度脂蛋白、三酰甘油、尿酸(使用SIEMENS ADVIA 2400全自动血液生化分析仪测定)、糖化血红蛋白(使用Premier Hb9210 糖化血红蛋白检测仪测定)。
使用利普生LBY-NB全自动血流变仪检测血液流变学相关指标:全血黏度低切、全血黏度中切、全血黏度高切、血浆黏度、红细胞压积、血沉、全血还原黏度低切、全血还原黏度中切、全血还原黏度高切、血沉方程K值、红细胞聚集指数、红细胞刚性指数、红细胞变形指数、红细胞电泳指数。
1.4 统计学处理
应用SPSS 18.0软件进行统计分析。计量资料用()表示,采用t检验。计数资料用百分数表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组糖脂代谢指标比较
A组的尿酸水平低于B组,差异有统计学意义(P<0.05)。两组在空腹血糖、肌酐、尿素氮、总胆固醇、高密度脂蛋白、低密度脂蛋白、三酰甘油、糖化血红蛋白比较,差异无统计学意义(P>0.05),见表2。
表2 两组糖脂代谢指标比较(±s)
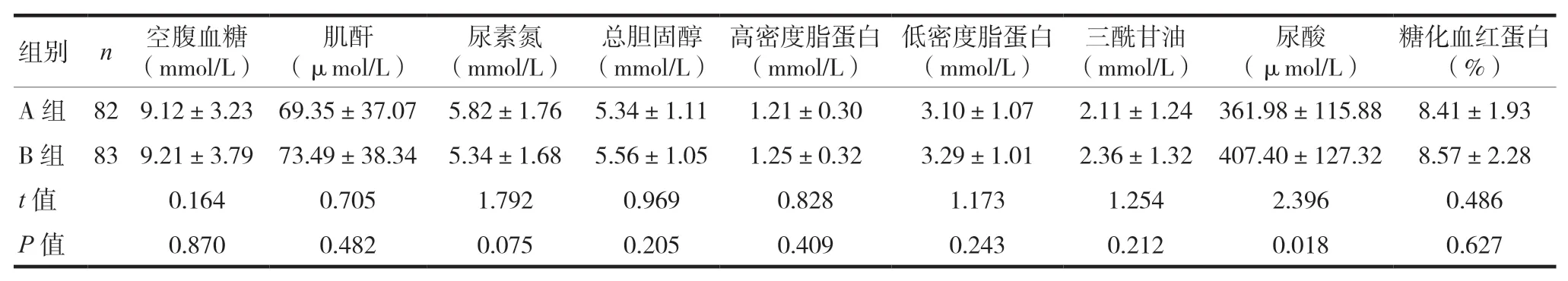
表2 两组糖脂代谢指标比较(±s)
组别n空腹血糖(mmol/L)肌酐(μmol/L)尿素氮(mmol/L)总胆固醇(mmol/L)高密度脂蛋白(mmol/L)低密度脂蛋白(mmol/L)三酰甘油(mmol/L)尿酸(μmol/L)糖化血红蛋白(%)A组82 9.12±3.23 69.35±37.07 5.82±1.76 5.34±1.11 1.21±0.30 3.10±1.07 2.11±1.24 361.98±115.88 8.41±1.93 B组83 9.21±3.79 73.49±38.34 5.34±1.68 5.56±1.05 1.25±0.32 3.29±1.01 2.36±1.32 407.40±127.32 8.57±2.28 t值 0.164 0.705 1.792 0.969 0.828 1.173 1.254 2.396 0.486 P值 0.870 0.482 0.075 0.205 0.409 0.243 0.212 0.018 0.627
2.2 两组血液流变学指标比较
A组全血黏度低切(10s-1)、全血黏度中切(60s-1)、红细胞压积、红细胞聚集指数低于B组,A组红细胞变形指数高于B组,差异有统计学意义(P<0.05)。两组间的全血黏度高切(150s-1)、血浆黏度、血沉、全血还原黏度低切(10s-1)、全血还原黏度中切(60s-1)、全血还原黏度高切(150s-1)、红细胞电泳指数、红细胞刚性指数、血沉方程K值比较,差异无统计学意义(P>0.05),见表3。
表3 两组血液流变学指标的比较(±s)
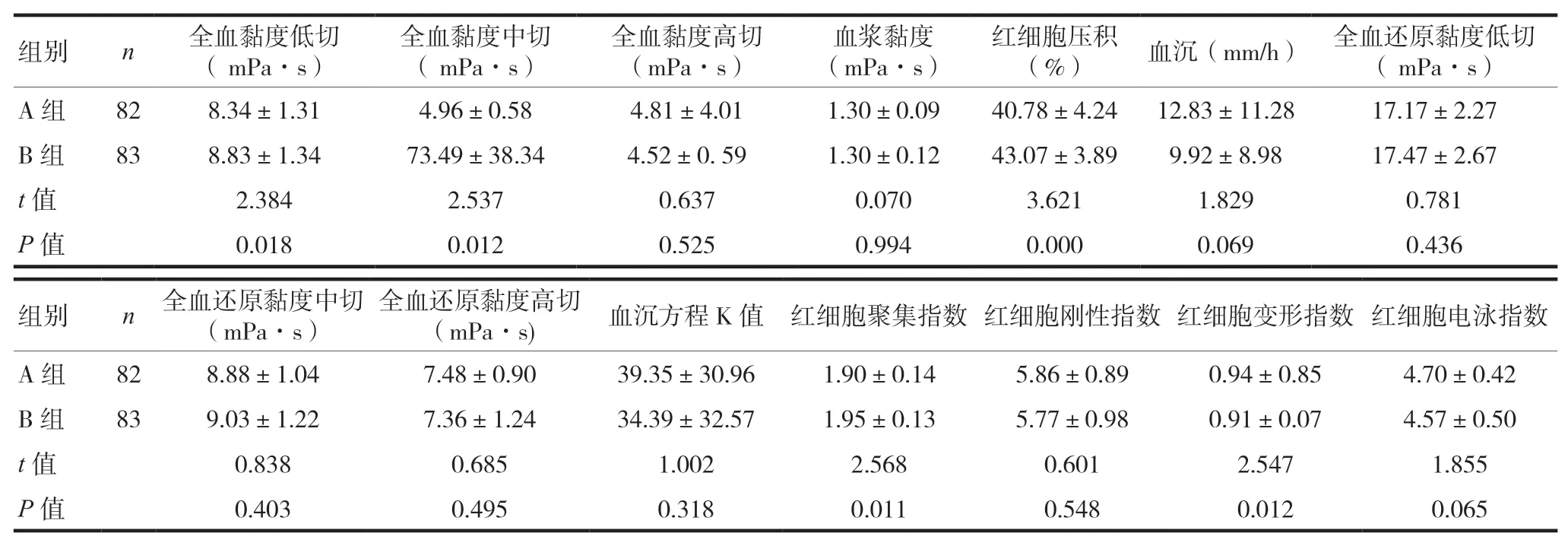
表3 两组血液流变学指标的比较(±s)
组别 n 全血黏度低切( mPa·s)全血黏度中切( mPa·s)全血黏度高切(mPa·s)血浆黏度(mPa·s)红细胞压积(%) 血沉(mm/h) 全血还原黏度低切( mPa·s)A组 82 8.34±1.31 4.96±0.58 4.81±4.01 1.30±0.09 40.78±4.24 12.83±11.28 17.17±2.27 B组 83 8.83±1.34 73.49±38.34 4.52±0. 59 1.30±0.12 43.07±3.89 9.92±8.98 17.47±2.67 t值 2.384 2.537 0.637 0.070 3.621 1.829 0.781 P 值 0.018 0.012 0.525 0.994 0.000 0.069 0.436组别 n全血还原黏度中切(mPa·s)全血还原黏度高切(mPa·s) 血沉方程K值 红细胞聚集指数 红细胞刚性指数 红细胞变形指数 红细胞电泳指数A组 82 8.88±1.04 7.48±0.90 39.35±30.96 1.90±0.14 5.86±0.89 0.94±0.85 4.70±0.42 B组 83 9.03±1.22 7.36±1.24 34.39±32.57 1.95±0.13 5.77±0.98 0.91±0.07 4.57±0.50 t值 0.838 0.685 1.002 2.568 0.601 2.547 1.855 P 值 0.403 0.495 0.318 0.011 0.548 0.012 0.065
3 讨论
糖尿病血管并发症是糖尿病致残、致死的主要原因,严重影响糖尿病患者生存质量及降低其预期寿命。糖尿病的血管并发症是由血液流变学异常的基础上发展而来的,在控制血糖的基础上,动态监测及随访2型糖尿病患者的血液流变改变,采取措施降低血液黏滞度,对预测和干预血管并发症有非常重要的意义。本研究从临床的角度,以与糖尿病血管病变有共同机制的血液流变学为切点,从临床的角度探讨DPP-4抑制剂对2型糖尿病降糖作用以外的血管保护作用。本研究结果显示使用DPP-4抑制剂组的尿酸低于未使用DPP-4抑制剂组,说明DPP-4可以改善患者尿酸水平。既往大量研究证实尿酸与氧化应激、炎症反应、血管内皮损伤等有关,促进加重动脉粥样硬化及肾纤维化[4-6]。尿酸水平下降可能与DPP-4抑制剂可通过广泛裂解炎症、改善氧化应激、改善内皮损伤等机制改善血液流变学特征,从而产生血管保护作用,能早期预防糖尿病进展。有动物实验显示DPP-4抑制剂可降低丙二醛活性、8-羟基脱氧鸟苷等氧化应激标志物水平,减少氧化应激造成的肾损伤,通过调节基质细胞衍生因子-1α、脑钠尿肽等因子的表达抑制炎症反应,延缓糖尿病肾病的进展[7]。
本研究结果显示使用DDP-4抑制剂的患者组全血低切黏度(10s-1)、全血中切黏度(60s-1)、红细胞聚集指数、红细胞压积低于为未服用DPP-4抑制剂组,提示DPP-4抑制剂可能改善红细胞的聚集状态;同时使用DPP-4抑制剂的红细胞变形指数高于未服用DPP-4抑制剂组,提示DPP-4抑制剂可能改善红细胞变形能力。推测DPP-4抑制剂改变2型糖尿病患者血液流变是介导红细胞聚集状态及细胞变形能力,促进红细胞聚集性。与既往研究报道改变红细胞聚集性,可降低微循环内血流速度,导致血管内高凝状态,造成组织缺氧,导致氧化应激、炎症反应及血管内皮功能异常,进一步加剧血液流变血液特征的异常,造成微循障碍恶性循环,对糖尿病血管病变的进程有相关的影响[8-10]。同时也有文献报道红细胞聚集性增加状态下,促炎症细胞因子、生长因子等的表达,引起肾小球硬化及肾小管间质纤维化;促进氧化应激启动,产生氧自由基,使肾小球毛细血管内皮细胞、足细胞凋亡,引起系膜细胞外基质堆积及肾小球基底膜增厚,促进糖尿病肾病进展[11-13]。DPP-4抑制剂阻断糖尿病血管病变的发生,还可作用于GLP-1以外的其他底物,通过广泛裂解炎症、调节氧化应激、改善内皮细胞功能等机制,发挥降糖以外的血管保护作用[14-15]。
综上,DPP-4抑制剂的使用可改善红细胞聚集状态及变形能力,降低血粘滞度,可能存在降糖以外的早期血管保护作用,有利于早期对糖尿病血管并发症进行干预。

