Pentraxin 3蛋白在乳腺癌中的表达及其临床意义
贾圣陶,赵雅雯,王克朕,张慧鲲,谷峰,马勇杰
(天津医科大学肿瘤医院1.肿瘤细胞生物学实验室,2.乳腺病理科,国家肿瘤临床医学研究中心,天津市“肿瘤防治”重点实验室,乳腺癌防治教育部重点实验室,天津市恶性肿瘤临床医学研究中心,天津 300060)
肿瘤的发生与进展是一个复杂的过程,是细胞与细胞微环境中多种成分间相互作用的结果,目前越来越多的研究表明,细胞微环境中炎症因子在肿瘤中发挥重要作用。炎症因子在炎症部位的持续存在引发级联反应诱导细胞增殖、趋化炎症细胞聚集,增加活性氧产物的产生,导致DNA氧化损伤、修复程序紊乱,最终导致细胞癌变[1-2]。五聚蛋白3(PTX3)是一种存在于体液中的以环状多聚体结构为特征的炎症因子,可引起补体活化[3],是一种重要的天然免疫和炎症生物标志物[4],并且在多种肿瘤的发生、血管生成、转移和癌症免疫等方面发挥重要作用。PTX3蛋白是肺癌患者总生存的独立预后因素,其高表达患者生存期较短[5]。此外,PTX3的高表达可以促进宫颈癌的肺转移以及胃癌骨转移[6-7]。PTX3还能够促进肾细胞癌、结直肠癌、黑色素瘤等多种肿瘤细胞的迁移、侵袭[8-10]。
乳腺癌是目前中国乃至世界范围内影响女性生命健康的主要恶性肿瘤之一[11],现阶段乳腺癌的治疗已取得一定效果,但仍需要探索参与乳腺癌恶性进展过程的关键分子,从而实现乳腺癌患者的精准治疗。炎症因子PTX3在多种肿瘤中发挥重要作用,但其在乳腺癌中的作用研究仍处于初始阶段。Choi等[12]发现PTX3在乳腺癌骨转移组织中高表达,其可促进破骨细胞的分化促进骨转移。PTX3高表达可以促进乳腺癌细胞干性及EMT过程[13-14]。同时,Thomas等[15]分析数据库资料发现,PTX3高表达的患者预后差。Scimeca等[16]通过免疫组化染色发现PTX3表达水平与乳腺癌肿瘤恶性程度正相关,其在低分化侵袭性乳腺癌中高表达,且PTX3高表达的患者预后较差。关于PTX3的研究主要集中在细胞水平,需要更多临床研究的相关证据,因此笔者开展本项研究。鉴于乳腺浸润性导管癌是乳腺癌最常见的类型(约占患者的80%),为了保证患者的一致性[17],本研究选取309例乳腺浸润性导管癌患者的石蜡标本,首次通过免疫组化染色检测较大量乳腺癌临床样本中PTX3蛋白的表达情况并探究其对乳腺癌患者预后的影响。
1 资料与方法
1.1 研究资料 随机选择309例2004—2012年天津医科大学肿瘤医院收治的乳腺浸润性导管癌(IDC)患者,平均年龄为51.8岁,纳入标准:(1)均经病理学确诊。(2)患者均为女性。(3)术前未接受放化疗等抗肿瘤治疗。同时从309例患者中随机选择了33例乳腺癌患者的癌旁组织作为对照,利用石蜡标本进行PTX3的免疫组织化学染色。
1.2 免疫组化染色 将挑选出的石蜡标本切片,厚度为4 μm左右,并进行以下步骤:(1)通过二甲苯及不同浓度乙醇对组织进行脱蜡复水。(2)柠檬酸盐高压修复2 min 30 s。(3)3%H2O2封闭组织切片上的过氧化物酶,室温静置25 min。(4)山羊血清室温封闭25 min。(5)滴加使用一抗稀释液稀释的PTX3抗体(1:75,Santa,SC-373951),4℃过夜孵育。(6)次日复温50 min后,滴加生物素标记的二抗,室温孵育20 min。(7)滴加链霉素-过氧化物酶溶液,37℃孵育20 min。(8)用现配制的DAB溶液显色,在显微镜下实时控制显色状态,所有切片显色时长均为3 min 30 s,于清水中终止显色。(9)苏木精复染5 min,盐酸酒精分化1 s,于1%氨水中返蓝约3 s,晾干后使用中性树胶封片,莱卡万能正置显微镜观察评分。
免疫组化的评分结果由两位专业的病理医师独立评分得出,采用H得分评分标准,综合考虑肿瘤细胞着色强度和面积来计算染色总分数。将肿瘤细胞染色强度分为4个等级:0(-)阴性、1(+)弱阳性、2(++)中阳性,3(+++)强阳性;肿瘤细胞面积百分比为0~100,根据H得分(强度乘以百分比)计算染色总分值,理论分数范围为0~300分。根据PTX3得分中位值(140分)将309例IDC患者分为高、低表达组,评分小于等于140分为低表达组,大于140分为高表达组。
1.3 统计学处理 使用SPSS 22.0统计软件进行统计学分析,计数资料比较使用χ2检验,相关性分析采用Spearman’s Rank相关性检验,Kaplan-Meier分析患者的预后情况,Cox比例风险回归模型进行单因素与多因素分析,P<0.05为差异具有统计学意义。
2 结果
2.1 PTX3蛋白在乳腺癌和癌旁组织中的表达 图1为PTX3在乳腺癌及癌旁组织中的不同表达强度的代表性图片,分别为:(-)阴性、(+)弱阳性、(++)中阳性、(+++)强阳性。PTX3蛋白的表达水平在癌组织中显著高于癌旁组织(χ2=35.3,P<0.001),如表1、图2所示。
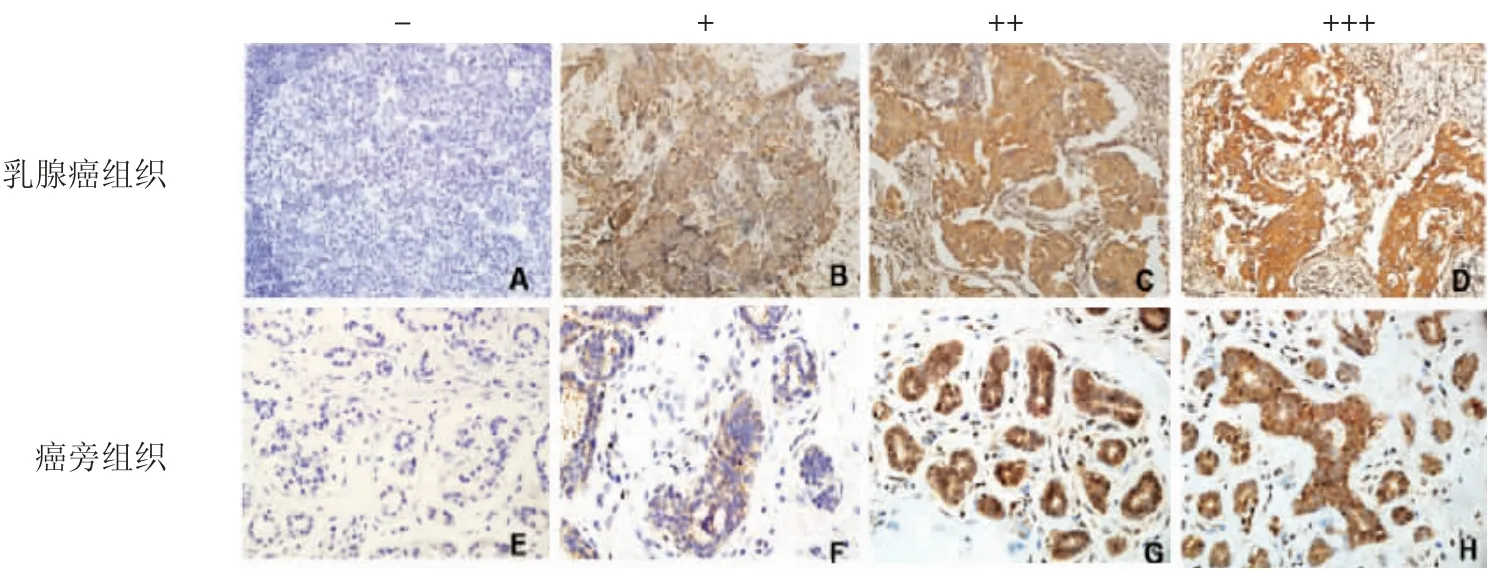
图1 PTX3免疫组化染色结果Fig 1 Immunohistochemical staining results of PTX3
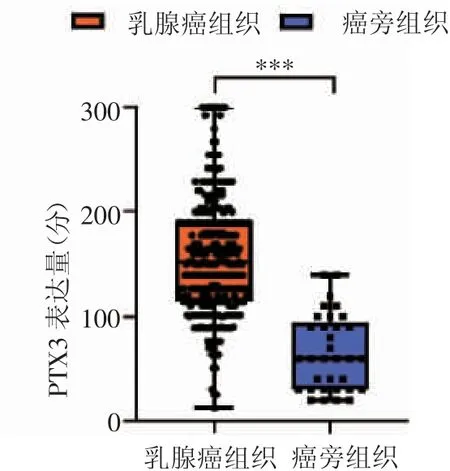
图2 PTX3在乳腺癌与癌旁组织中的表达情况Fig 2 Expression of PTX3 in breast cancer and adjacent tissues
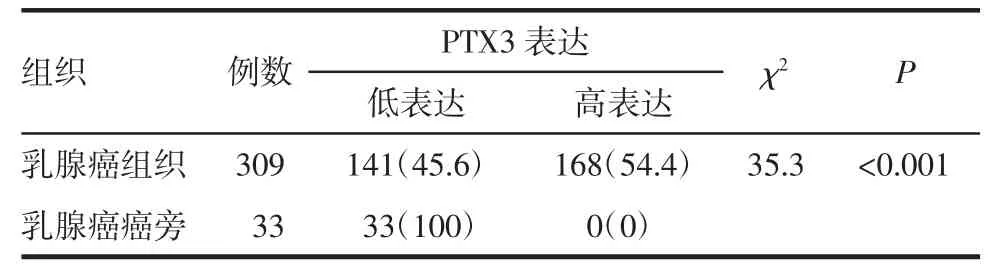
表1 乳腺癌和癌旁组织中PTX3蛋白的表达情况[n(%)]Tab 1 Expression of PTX3 in breast cancer and adjacent tissues[n(%)]
2.2 PTX3蛋白表达与IDC患者病理特征的关系 通过Spearman秩相关检验对PTX3的表达水平与数据资料间进行相关性分析,结果显示,PTX3蛋白的表达水平与乳腺癌组织学级别正相关(r=0.139,P=0.016);与患者年龄(r=0.047,P=0.414)、肿瘤大小(r=-0.049,P=0.396)、ER状态(r=-0.105,P=0.067)、PR状态(r=0.106,P=0.064)、HER2状态(r=-0.004,P=0.948)以及淋巴结转移状态(r=-0.061,P=0.331)均无明显相关性,如表2所示。
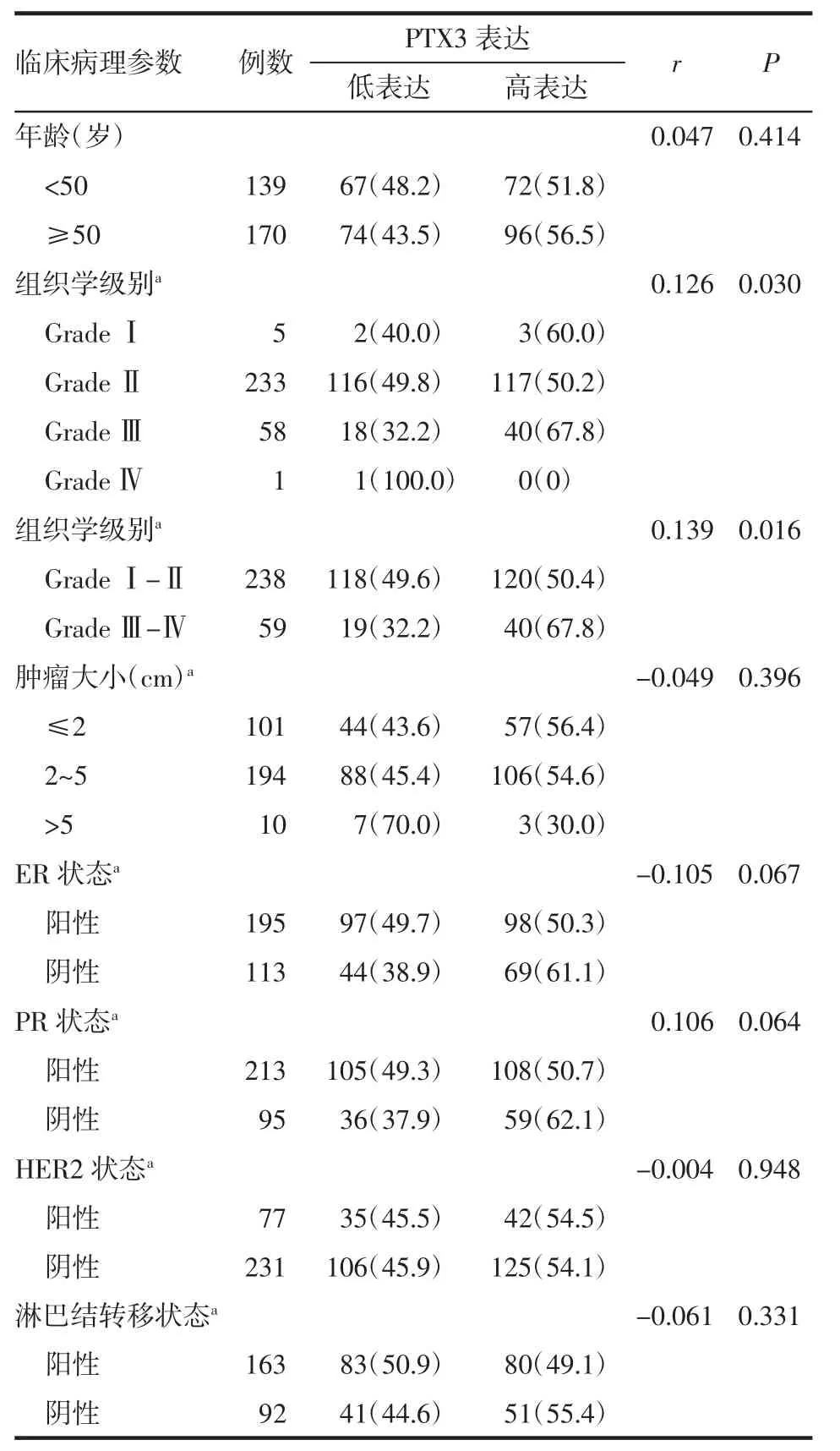
表2 PTX3蛋白表达水平与IDC患者临床病理学参数的关系[n(%)]Tab 2 Relationship between PTX3 and clinicopathological parameters in IDC patients[n(%)]
进一步分析PTX3蛋白在不同级别的IDC患者中的表达情况,结果显示,在组织学级别为Ⅰ级和Ⅱ级的患者中,PTX3蛋白表达平均得分为153.2分,在Ⅲ级及Ⅳ级患者中平均得分为169.2分(图3),表明PTX3蛋白在高组织学级别的乳腺癌组织中高表达(t=2.035,P<0.05)。
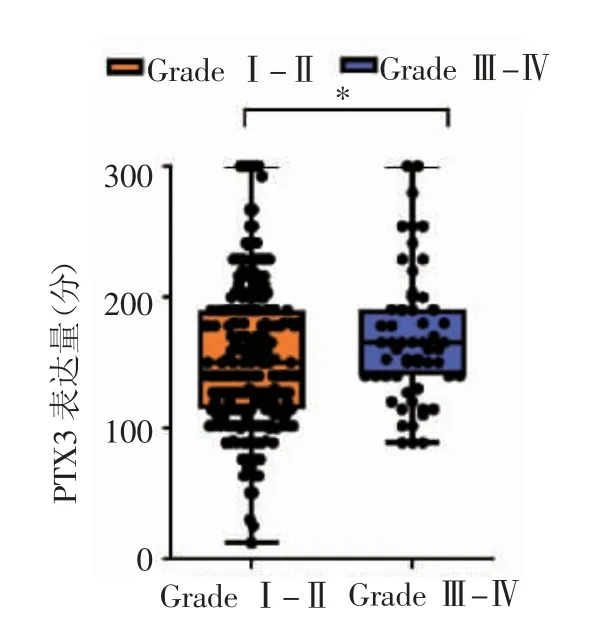
图3 PTX3在不同组织学级别乳腺癌中的表达情况Fig 3 The expression of PTX3 in breast cancer of different histological grades
2.3 PTX3蛋白表达对乳腺癌患者预后的影响Kaplan-Meier生存分析显示:PTX3高表达组的患者总生存期显著低于PTX3低表达组(χ2=5.708,P=0.017,图4A),无进展生存期也显著低于PTX3低表达组(χ2=4.958,P=0.026,图4B)。运用Cox比例风险回归模型进行单因素分析,并将单因素分析结果中P<0.1的多个危险因素纳入到多因素Cox回归模型中进行分析,结果表明:PTX3蛋白表达是IDC患者总生存(HR=1.006,95%CI:1.001~1.011,P=0.021)(表3)和 无 进 展 生 存(HR=1.004,95%CI:1.000~1.008,P=0.042)的独立预后因素(表4)。

表3 IDC患者总生存的单因素和多因素分析Tab 3 Univariate and multivariate analysis of overall survival in patients with IDC
3 讨论
乳腺癌是女性最常见的恶性肿瘤,据估计全世界每年所有新诊断出的癌症患者中有10%为乳腺癌患者[11],探究乳腺癌进展中的关键分子,可以提供有价值的预后信息以及靶点治疗新思路。PTX3是一种进化中保守的体液模式识别分子(PRM),在先天免疫中发挥重要作用。在炎症反应中,PTX3可激活效应子发挥功能,在损伤以及细胞外基质的形成和重塑中具有复杂的调节作用[3]。多项研究表明PTX3可能是癌症相关炎症的标志物,与多种癌症的预后相关[5-7,18],是体内先天免疫、炎症、组织修复和癌症等过程的关键组分。
在本研究中,通过对309例乳腺癌患者癌组织及33例癌旁组织免疫组化染色发现,PTX3蛋白在乳腺癌组织中的表达明显高于癌旁组织。以往研究表明PTX3在多种肿瘤中高表达并发挥促癌作用。在头颈癌中,表皮生长因子(EGF)通过磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)和核因子(NF)-κB通路上调PTX3表达,EGF诱导c-Jun与PTX3启动子上的AP1位点结合,在NF-κB的协同下上调PTX3表达,促进肿瘤细胞迁移、侵袭和转移[19];体外实验发现在基底样乳腺癌中,NF-κB、Wnt/β-catenin、JNK-Jun信号通路的激活均能够上调PTX3蛋白表达进而增强乳腺癌细胞干性、EMT、细胞迁移和侵袭[13-14]。由此推测,PTX3在乳腺癌组织中的高表达可能与PI3K-Akt、NF-κB、Wnt/β-catenin、JNK-Jun通路相关,需进一步验证。
临床病理资料分析结果表明,PTX3高表达患者总生存期及无进展生存期均较短,单因素与多因素分析表明PTX3可以作为乳腺癌的独立预后因素,即PTX3高表达患者预后差。但PTX3在乳腺癌中发生、发展的作用机制尚未明确。以往研究发现:在黑色素瘤中,肿瘤细胞自分泌产生的PTX3会激活IKK/NF-κB信号通路,从而促进EMT因子TWIST1诱导的迁移侵袭[8]。在胶质瘤的研究中发现,PTX3蛋白高表达可以促进肿瘤细胞增殖和转移,敲除PTX3后,基质金属蛋白酶(MMP)-1、MMP-2和MMP-9的表达下调,使胶质瘤细胞的迁移和侵袭受到抑制。同时,动物学实验表明,敲除PTX3基因抑制体内异种移植瘤的生长[20-21]。Zhang等[13]发现,在BLBC细胞系中过表达PTX3可以激活Hedgehog信号通路和Yes相关蛋白(YAP)信号通路。Hedgehog信号通路在控制细胞增殖、组织形成、干细胞维持和发育中具有重要作用;YAP是Hippo通路的转录共激活因子,Hippo通路对调节肿瘤干性十分重要[22]。PTX3可能是通过调控Hedgehog和Hippo-YAP通路在乳腺癌中发挥促癌作用。根据以上结果笔者推测,PTX3可能通过NF-κB抑制蛋白激酶(IKK)/NF-κB、Hedgehog和Hippo-YAP通路参与调控肿瘤细胞的迁移、侵袭、EMT以及细胞干性,从而促进乳腺癌的恶性进展。关于PTX3的具体作用机制还需要通过细胞功能学实验进一步证实。
综上所述,笔者通过统计分析临床病理资料发现PTX3蛋白在乳腺癌组织中高表达且与患者组织学分级呈正相关;PTX3蛋白是乳腺癌患者总生存期与无进展生存期的独立预后因子,其高表达患者预后差。笔者推测,PTX3蛋白在乳腺癌中的高表达可能受PI3K-Akt、NF-κB、Wnt/β-catenin、JNK-Jun等通路的调节,然后通过Hedgehog、Hippo-YAP等信号通路调控乳腺癌EMT、细胞干性、细胞迁移、侵袭等生物学特性进而促进乳腺癌的恶性进展。

