从“孕妇”在医学研究伦理相关法规指南中脆弱性标识的变化谈“弱势受试者”
田 蜜,贺建昌
(1 安宁市第一人民医院医学伦理委员会,云南 昆明 650300,tianmi151@126.com;2 云南省中医医院临床药理研究中心,云南 昆明 650021)
美国是最早建立伦理委员会和伦理审查法规制度的国家,研究伦理公认的三大基本原则:尊重、有益/不伤害、公正,也是最早在美国《贝尔蒙报告》[1]中提出的。生物医学研究中,“弱势受试者”在世界范围内并没有统一的定义,人们经常使用社会学中的“弱势人群”,比如老人、儿童和孕妇。但“孕妇是否是弱势受试者”一直是医学伦理领域争论的焦点,2018年美国卫生和公众服务部(United States Department of Health and Human Services,HHS)在新修订的联邦法规(Code of Federal Regulations,CFR)Title 45的Part 46(以下简称“45 CFR 46”)中将“孕妇”从“弱势群体”中删除[2]。我国2020年版《药物临床试验质量管理规范》[3](GCP)中“孕妇”也被从前期修订意见稿[4]术语的“弱势受试者”中删除。随着社会和医学实践的进步,人们对于“弱势受试者”的理解正发生着变化。
以前,在医学研究伦理体系中,孕妇这一特殊人群被认为是“弱势受试者”,其理由是:①胎儿易受伤害;②孕妇的健康状况相对比较脆弱。现在,孕妇已不再作为典型的可能的“弱势受试者”,此变化背后的考量是什么?带着这样的疑问,笔者梳理了生物医学研究中“弱势受试者”的概念起源、其特征和定义在不同法规指南中的规定和演变,借此希望引起同仁对“弱势受试者”这一概念及应用更深入的思考和讨论。
1 国际法规指南关于“弱势受试者”或“脆弱性”的内容
1979年美国《贝尔蒙报告》第一次在涉及人的生物医学研究领域提出受试者“弱势”及“脆弱性”的概念[1]。
《赫尔辛基宣言》最早在2000年版[5]中提及“脆弱性”,2008年版[6]对其具体的特征进行了简单描述,2013年版本[7]强调了“更容易受到不公正对待或者额外的伤害(being wronged or incurring additional harm)”,之后的法规指南大多以此为基础。
《ICH-GCH 》1996年版[8]、2016年版[9]对“弱势受试者”的解释为“指受到不正当的影响(unduly influenced)而成为临床研究志愿者的人”,这些不正当影响包含了对研究预期利益的期望以及因拒绝参加而可能受到的等级中资深成员的报复,其他还包括传统被视为弱势群体的人、那些无能力给出知情同意的人等。
国际医学科学组织理事会(CIOMS)《涉及人的健康相关研究国际伦理准则》对“弱势”或“脆弱性”的解释最为宽泛:2002年版[10]强调是“相对(或绝对)地无能力保护自己的利益”;2016年版[11]中,引用了《赫尔辛基宣言》的内容:“根据《赫尔辛基宣言》,脆弱群体和个人‘可能更容易受到不公正对待或额外的伤害’”,列举了“脆弱性”的不同特征和情境,并特别指出“在研究中对待脆弱人群的传统做法,是将整个阶层标注为弱势群体。本准则对脆弱性的解读,试图避免把整个阶层的人都视为脆弱人群。”
美国45 CFR 46关于“脆弱性”问题的规定展开了很长一段时间广泛征求意见和讨论,争论点之一就是“是否应将孕妇和身体残疾者定性为易受胁迫或不适当影响的人”。美国网站上有关“脆弱性引用的修订”过程文件[12]提到“目前正在征求公众对这些拟修改的与弱势群体有关条款的意见。因为有人提议,唯一需要考虑的脆弱性是易受胁迫或不适当影响,而不是其他类型的脆弱性……特别要求公众讨论是否应将孕妇和身体残疾者定性为易受胁迫或不适当影响的人。”最终采纳了大多数人的意见,不再将“孕妇”或“残疾人”作为可能易受胁迫或不当影响的人群。脆弱性的特征仅需考虑“可能易受胁迫或不当影响”,并且这一特征包含了对参与研究的受试者知情同意能力的考虑:“决策能力受损的个人”。
笔者认为国际法规指南有关“脆弱性”的特征可统一概括为“易受到不正当影响/额外伤害”。因为以上提到的胁迫、不公正对待都可归纳为不正当影响;“相对(或绝对)地无能力保护自己的利益”是易受到不正当影响/额外伤害的前提之一。根据这一定义,我们就不难理解美国45 CFR 46将“孕妇”从“弱势受试者”中删除的考量:孕妇并不因为怀孕而使其知情同意能力改变、无能力保护自己的利益、易受不正当影响/额外的伤害。
国际法规指南中关于“弱势受试者”或“脆弱性”的内容见表1。
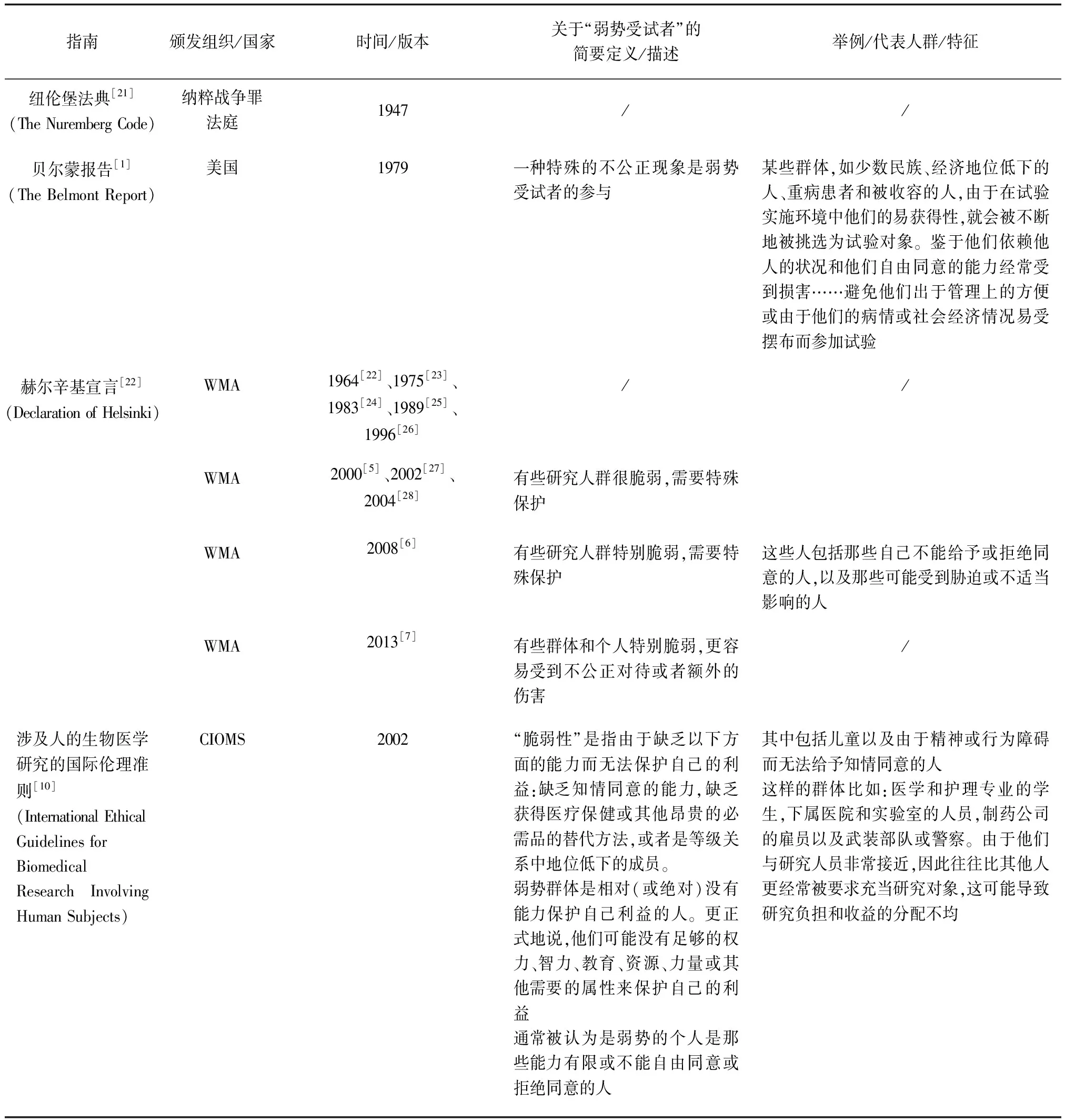
表1 国际法规和指南中关于“弱势受试者”或“脆弱性”的内容

续表
2 国内法规指南关于“弱势受试者”或“脆弱性”的内容
1999年、2003年版GCP[6-7]未提及“弱势受试者”,2016年修订稿征求意见稿[13]、2018年修订草案征求意见稿[4]、2020年版[3]中,“弱势受试者”的定义结合了CIOMS和ICH中的描述,即“指维护自身意愿和权利的能力不足或者丧失……意愿……受到不正当影响……未成年人和无能力知情同意的人等”。2016年修订稿征求意见稿、2018年修订草案征求意见稿中的举例包含了“孕妇”,2020版中,将“孕妇”从“弱势受试者”的举例中删除。
《药物临床试验伦理审查工作指导原则》[14]关于“弱势受试者”的定义引用了CIOMS的《涉及人的健康相关研究国际伦理准则》[10-11]的内容,但其特征描述仅侧重受试者知情同意能力。
《涉及人的生物医学研究伦理审查办法》[2016年版、2018修订草案(征求意见稿)][13-14]、《涉及人的临床研究伦理审查委员会建设指南》[15]及《中医药临床研究伦理审查管理规范》[16]等部分法规指南虽提到“弱势受试者”或“弱势群体”,但并未对其进行定义或解释。其余法规指南[17-20]未提及“弱势受试者”相关内容,具体内容见表2。

表2 国内法规和指南中关于“弱势受试者”或“脆弱性”的内容

续表
综上,国内法规指南仅GCP及《药物临床试验伦理审查工作指导原则》[14]对“弱势受试者”进行了定义;GCP修订过程中对“弱势受试者”的解释引用也经历了数次微调,其定义与ICH-GCP也并非完全一致,前者在“不正当影响”的基础上强调了“维护自身意愿和权利的能力不足或丧失”,具体对比见表3。

表3 2016版ICG-GCP 与我国2020版GCP有关“弱势受试者”的对比
另外,《中国临床研究能力提升与受试者保护高峰论坛》(CCHRPP)工作委员会发布的“保护脆弱受试者的伦理审查要点”[21]中提到“‘脆弱性’是指个体在同意或拒绝同意参加研究的能力上存在不足”,即强调的是知情同意能力;“‘脆弱性’”的理解应该是环境依赖性和动态性的,而不是针对特定群体并对其进行永久性标记的静态定义,我们应当更加关注个体“脆弱性”。
3 讨论
笔者认为弱势受试者的“脆弱性”特征可概括为“易受到不正当影响或者额外伤害”;受试者“维护自身意愿和权利的能力不足或者丧失”是可能受到“不正当影响”的原因之一。
从法规指南中有关“弱势受试者”的“脆弱性”特征的不同描述及变化,我们不难理解“孕妇”为什么会被从法规指南的“弱势受试者”中删除。这种变化提示我们:医学伦理体系中的“弱势群体”与传统社会学的“弱势群体”并不相同,前者有其自己的特点。过去将某一类人群、某一阶层的整个群体贴标签为“弱势群体”的做法过于宽泛。
“弱势受试者”不应单纯地被排除在生物医学研究之外,因为每个人都有从医学进步中获益的权利,我们要做的是在研究过程中给予特别关注和特殊保护。等级关系团体中的成员,如医学院校学生、制药公司雇员、军人等,我们关注的是知情同意的真实有效性,是否被胁迫,因此,可以对知情同意的过程及效果进行动态评估来提供特殊保护,而不是“一票否决”纳入此类人群研究的伦理合理性。针对涉及“弱势受试者”的研究,我们更应该考虑具体的研究方案、研究环境、社会环境、受试者背景以及导致受试者脆弱性的因素,对受试人群的不同特征或层次进行评估,然后针对这些特征或因素采取相应的保护措施。
4 结语
关注涉及“弱势受试者”的研究是研究伦理三大原则“尊重、有益/不伤害、公正”的体现,2020版GCP也明确指出伦理委员会应“特别关注弱势受试者”。国内外法规指南针对涉及“弱势受试者”的研究制定了相应的要求,比如要求所开展研究的目标是针对参与者群体的健康需求;安全保障措施的设计可以从促进自愿决策、限制可能的隐私泄露,以及保护这些处于高度伤害风险的人群的利益等方面来实施。尽管潜在的参与临床试验的弱势受试者已在伦理审查中受到越来越多的关注,但伦理委员会如何开展审查以做到切实保护弱势受试者的权益仍面临诸多挑战。因此,明确弱势受试者的定义、特征、范围及其保护策略,统一弱势受试者的伦理审查要点,更有利于保护弱势受试者在参与临床试验过程中的安全和权益。

