促红细胞生成素治疗糖尿病视网膜病变的研究进展
刘丹丹,徐国彤,张敬法
0引言
糖尿病视网膜病变(diabetic retinopathy,DR,简称糖网病)是糖尿病在眼部的一种严重并发症。在我国糖尿病人群中DR患病率为23%。随着糖尿病患者病程的延长,DR患病率逐年提高,致盲率也逐年上升。因此,及早发现及控制糖尿病,及时诊治DR,降低致盲率,减轻家庭及社会负担,已成为亟待解决的问题之一[1]。随着临床和基础研究的不断深入,DR不再是传统意义上单纯的微血管并发症,而是糖尿病继发的全视网膜并发症,累及视网膜内各类细胞,包括神经元(神经节细胞、无长突细胞、水平细胞、双极细胞和光感受器细胞)、血管组成细胞(周细胞和血管内皮细胞)、胶质细胞(Müller细胞、星形胶质细胞和小胶质细胞)以及视网膜色素上皮(retinal pigment epithelium,RPE)细胞[2]。当前对DR发病机制的认识聚焦为微血管病变、神经元病变以及中低度的炎症反应。本文旨在探讨促红细胞生成素(erythropoietin,EPO)对DR的保护作用及机制,以期为EPO干预治疗早期DR及视网膜退行性疾病提供新的方向。
1促红细胞生成素及其在眼内的作用
EPO是一种糖蛋白激素,在体内具有抑制骨髓中红系祖细胞的凋亡并诱导其分化成熟为红细胞。胎儿发育期间,EPO主要在肝脏产生,成人后肾脏间质成纤维细胞成为产生EPO的主要来源,通过自分泌或旁分泌的方式经血流到达骨髓,刺激造血干细胞向红细胞分化。然而,成人循环中大约10% EPO来自肾脏以外的组织,如大脑、视网膜、脾脏、肺、胎盘、子宫和睾丸[3]。随着EPO及其受体(EPOR)在视网膜中的发现及其在DR中作用研究的深入。EPO对维持视网膜正常生理功能及在病理状态下均具有重要作用。
EPO在人出生前对视觉发育至关重要。早在2008年,美国犹他大学的Shrena Patel研究发现胎儿玻璃体及血清中EPO含量随胎龄增加而增加,且玻璃体中EPO浓度显著较血清高[4]。在成人视网膜中,EPO表达调控主要基于组织中氧饱和度的反馈机制,即通过低氧诱导因子1(hypoxia-inducible factor-1,HIF-1)来调控。在缺氧条件下,HIF-1α表达增加、蛋白稳定性增强并与HIF-1β形成二聚体转运至细胞核中,根据细胞类型,诱导下游多种基因的转录[如EPO、血管内皮生长因子(vascular endothelial growth factor,VEGF)],影响视网膜功能[5]。
近年来,EPO在DR中的作用也相继被挖掘。研究表明,在患有慢性肾功能衰竭的非糖尿病患者中,EPO治疗可显著增加低血糖发生率,提示EPO可能对胰腺β细胞有直接作用[6]。加拿大多伦多大学Diana Choi团队研究发现,重组人EPO(rhEPO)可通过结合胰腺β细胞内EPOR激活下游JAK2激酶信号通路,最终增加β细胞数量,降低血糖水平[7]。除EPO全身作用外,我们团队在临床个案研究中发现,玻璃体腔内注射EPO可提高难治性、弥漫性糖尿病黄斑水肿患者的视力,并显著减轻黄斑水肿[8],表明眼内注射EPO对视网膜具有保护作用,该保护机制可能是通过负反馈抑制HIF-1α/VEGF信号通路,从而降低VEGF的表达与分泌[9]。随着EPO治疗DR的研究进展,其抗凋亡、神经保护、神经营养、抗炎、抗氧化等作用被相继报道。
2 EPO在DR中的抗凋亡作用
神经元凋亡是包括DR在内的多种神经系统疾病的“终末共同途径”[10]。在DR早期,视网膜内神经元发生退行性病变,主要以神经元凋亡(neuronal apoptosis)和胶质反应(reactive gliosis)为主要特征。研究表明EPO治疗可减少早期DR动物模型中视网膜神经元的凋亡。外源EPO可与视网膜神经元细胞上EPOR结合,并激活JAK2激酶及其下游多个信号转导途径,包括细胞外信号调节激酶1/2(ERK1/2)和PI3K/Akt等信号通路,抑制促凋亡基因(如Bax和Bak)的表达并促进抗凋亡基因(如Bcl-xL和Bcl-2)的表达,从而抑制内在死亡途径实现抗神经元凋亡作用[11](图1)。
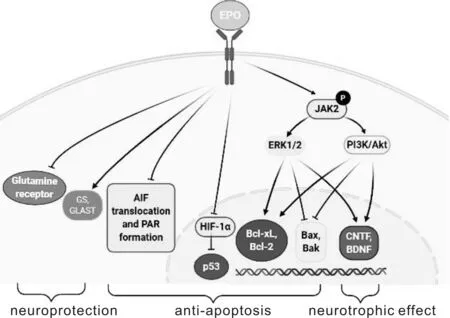
图1 DR中,EPO的神经保护、抗凋亡和神经营养作用 ↑表示促进;表示抑制。
HIF-1α是EPO蛋白表达的主要调控因子,低氧条件下HIF-1α的过表达抑制了p53的泛素化和降解,维持了p53的稳定性,从而导致凋亡相关基因表达增加,诱导细胞凋亡[12-13]。在糖尿病大鼠模型中,玻璃体腔注射外源EPO通过负反馈抑制其上游转录因子HIF-1α的表达[9],这可能是EPO抑制神经元凋亡的作用机制之一。
3 EPO在DR中的神经保护和神经营养作用
EPO在多种中枢神经系统疾病中发挥神经保护和神经营养作用[14-15]。我们课题组在过去几年中率先开展了在链脲菌素诱导的1型糖尿病大鼠眼内注射EPO的疗效观察,研究发现:玻璃体腔内注射EPO能有效保护视网膜内多种类型细胞(如各类神经元、血管组成细胞、胶质细胞、RPE细胞等)防止糖尿病损伤,为EPO干预治疗早期DR提供了理论依据。在神经营养和保护作用方面,外源性EPO可通过与糖尿病大鼠视网膜内Müller细胞胞膜上的EPOR结合激活胞内ERK和Akt信号通路,刺激脑源性神经营养因子(brain derived neurotrophic factor,BDNF)和睫状神经营养因子(ciliary neurotrophic factor,CNTF)表达,减轻Müller细胞的反应性神经胶质增生[16]。
谷氨酸是视网膜中主要的兴奋性神经递质,视网膜内谷氨酸水平大量升高导致神经元兴奋性毒性增加,从而促使糖尿病状态下神经元的死亡。EPO可通过调节谷氨酸代谢相关蛋白的表达发挥其神经保护作用,如上调糖尿病大鼠视网膜内谷氨酰胺合成酶(glutamine synthetase,GS)和谷氨酸-天冬氨酸转运体(glutamate-aspartate transporter,GLAST)的表达,从而维持正常的谷氨酸-谷氨酰胺循环;EPO可下调谷氨酸受体,减轻神经元过度兴奋和神经元毒性[17]。此外,视网膜内氧化应激增强和聚腺苷二磷酸核糖聚合酶[poly (ADP-ribose) polymerase,PARP]的激活也与DR的进展有关,EPO可抑制视网膜内聚ADP-核糖聚合物[PAR,poly (ADP-ribose)]的形成并降低核凋亡诱导因子(apoptosis inducing factor,AIF)水平,维持视网膜内环境稳态[18]。
4 EPO对血-视网膜屏障的保护作用
糖尿病性黄斑水肿(diabetic macular edema,DME)以及增殖性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)是导致DR患者视力损伤或致盲最常见的并发症。目前随着医疗水平的进步及早期筛查、防治力度的加大,PDR发病率不断降低。当前,DME成为DR患者最主要的致盲原因。DME发病机制复杂,血-视网膜屏障(blood-retinal barrier,BRB)的破坏是主要原因。在前期临床研究中,玻璃体腔注射EPO对难治性、弥漫性DME患者治疗有效,能显著消退黄斑水肿并提升视力[8],表明EPO具有保护和维持BRB的作用。
4.1EPO对血-视网膜内屏障的保护作用血-视网膜内屏障(inner BRB,iBRB)主要由视网膜血管内皮细胞、周细胞、胶质细胞等组成,内皮细胞间所形成的紧密连接是组成iBRB的分子基础。在DR进展过程中,视网膜内微血管内皮细胞及周细胞发生丢失和凋亡、紧密连接蛋白表达减少或分布异常、星形胶质细胞退行性改变、Müller细胞增生、小胶质细胞活化及各种炎性因子表达增加[19],导致iBRB破坏、渗漏增加。玻璃体腔注射EPO可防止糖尿病大鼠视网膜内微血管内皮细胞和周细胞凋亡、降低视网膜微血管通透性,维持iBRB完整性[20-21]。在作用机制上,EPO通过抑制VEGF/VEGFR2/Src通路减少内皮细胞间黏附连接分子VE-cadherin的磷酸化和内化,从而维持内皮细胞屏障功能[20]。我们近期的研究发现,EPO可通过调节Src/Akt/cofilin信号通路抑制糖尿病大鼠视网膜内小胶质细胞活化和吞噬作用进而保护视网膜微血管完整性[22]。此外,EPO的抗炎作用在糖尿病大鼠视网膜内及乙二醛处理的Müller细胞模型中也得到了验证[23]。EPO亦可通过维持视网膜Müller细胞中锌转运体8(zinc transporter 8,ZnT8)水平调控细胞内锌离子水平,从而维持细胞稳态[24]。以上研究均提示EPO对iBRB具有保护作用,维持内环境稳态。
4.2EPO对血-视网膜外屏障的保护作用血-视网膜外屏障(outer BRB,oBRB)主要由RPE细胞及细胞间紧密连接构成,是维持视网膜稳态及视觉生理状态的重要基础。大量有关DR临床和基础研究都观察到oBRB的破坏以及RPE功能失常,包括早期细胞凋亡、细胞间连接破坏、RPE细胞转运能力下降、生长因子或炎性因子表达异常等[25]。
糖尿病大鼠玻璃体腔注射EPO可通过下调RPE-Bruch膜-脉络膜毛细血管复合体(RPE-Bruch’s membrane choriocapillaris complex,RBCC)中HIF-1α和JNK信号通路,从而上调RPE细胞中紧密连接蛋白,如ZO-1和occludin的表达,维持oBRB完整性。体外乙二醛诱导的RPE细胞模型验证了上述保护作用[26]。在高糖+IL-1β诱导的RPE细胞模型中,EPO可通过激活下游的JAK2和PI3K/Akt信号通路,增加RPE细胞内Ca2+内流和细胞间紧密连接蛋白ZO-1的表达,抑制高糖和IL-1β对oBRB功能的破坏[27]。
以上研究均表明EPO通过多条信号通路和途径发挥了对血-视网膜屏障的保护作用,从而维持视网膜内环境的稳态(图2)。
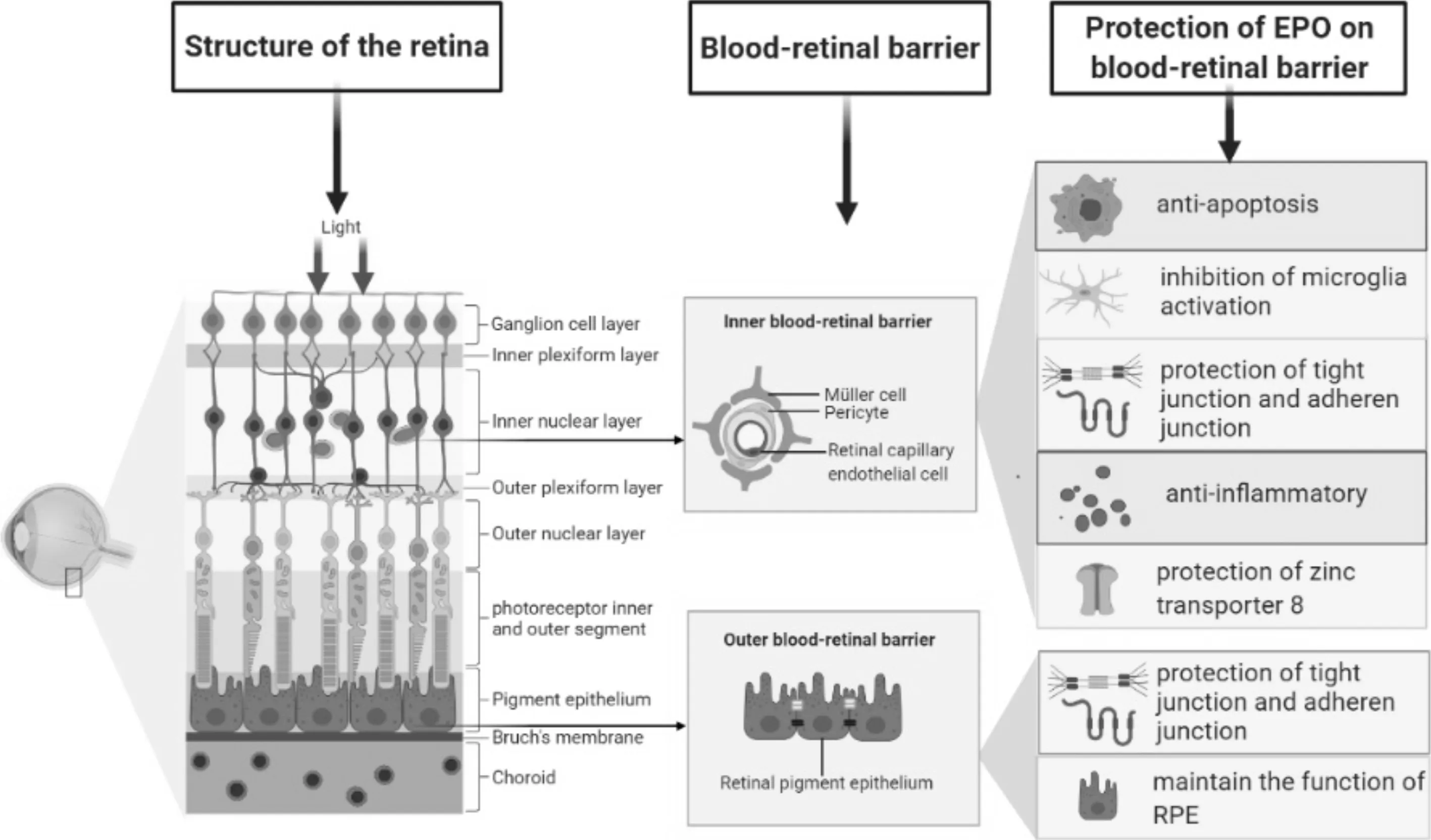
图2 DR中EPO通过多条信号通路和途径发挥其对血-视网膜屏障的保护作用。
5 EPO对视网膜退行性病变及其他眼病的保护作用
EPO具有的抗凋亡特性及神经保护、神经营养作用使其成为治疗视网膜退行性疾病(如早产儿视网膜病变、视网膜色素变性、年龄相关性黄斑变性、青光眼等)的理想药物。PDR和早产儿视网膜病变具有相似病因病理特征和发病过程。在疾病的早期阶段,视网膜内HIF-1α被抑制或降解,EPO表达降低,此时外源给予EPO可通过上述多条途径发挥保护作用以维持BRB完整性和神经元的正常生理功能。然而,在增殖性视网膜病变晚期,视网膜的严重缺氧导致HIF-1α大量表达,从而触发大量新生血管形成,此时,EPO治疗具有促进病理性新生血管形成的作用[28]。因此,增殖性疾病早期给予EPO可能是预防及控制病变进展的有效治疗方法,而疾病晚期则需要抑制EPO。
对于其他多种视网膜退行性疾病如视网膜色素变性、年龄相关性黄斑变性及青光眼等,由于EPO具有抗凋亡和神经营养等作用,眼内注射可以阻止这些退行性眼病共同的晚期阶段(终末共同途径),即细胞死亡,也具有潜在的应用价值。
6讨论与展望
糖尿病已经成为全球范围内的公共性疾病,DR作为糖尿病眼部并发症,对糖尿病患者的生活质量产生巨大影响,加重患者及其家庭的医疗负担。DR进展累及视网膜内几乎所有类型细胞,例如导致周细胞和内皮细胞凋亡、星形胶质细胞退化、Müller细胞与小胶质细胞活化、视网膜神经元凋亡、RPE变性等。本文主要就EPO治疗DR可能的作用机制进行了综述,探讨了EPO的神经保护、神经营养、抗炎、抗凋亡及保护BRB功能的作用,使得EPO或EPOR激动剂成为未来治疗DR的潜在药物。但EPO具有的促红细胞生成作用也使其在PDR中的应用受到较大争议[29]。研究表明,EPO可通过与不同形式的受体结合发挥不同功能:如结合同源二聚体(EPOR/EPOR)发挥促红细胞生成作用,而结合异源二聚体(EPOR/βCR)发挥非促红细胞生成作用,即神经保护作用等[30]。因此,选择性靶向异源二聚体的新药物研发,如具有非促红细胞生成作用的EPO衍生肽有望成为后续预防及治疗DR强有力的潜在药物。另外,EPO/EPOR轴在其他多种神经退行性疾病中也被广泛研究,如阿尔茨海默症、帕金森病、肌萎缩性侧索硬化症、脊髓损伤等,EPO具有的抗氧化应激、抗凋亡及抑制继发性神经炎症过程的作用使其在神经退行性疾病治疗方面具有广阔的前景。

