毛水苏多糖对糖尿病小鼠肾脏的保护作用
孙宏莱,刘 悦,刘德江,李丽丽,N.V.扎依湄科,申 健,*
(1.佳木斯大学生命科学学院,黑龙江佳木斯 154007;2.中-乌农林技术开发与应用国际合作联合实验室,黑龙江佳木斯 154007;3.乌克兰国家科学院M.M.格里什科国家植物园,乌克兰基辅 01014)
随着全球经济水平的不断提高,人们的生活习惯、膳食方面发生了巨大的改变,纷至沓来的是糖尿病等多种慢性疾病发生率的不断上升,极大地影响了人们的日常生活,危害了身体的健康[1]。糖尿病是一种由胰岛素分泌量降低,生物作用受到损伤所导致的代谢性疾病。Ⅱ型糖尿病患者不可能被彻底治愈,生活中,饮食的控制、身体锻炼的加强、防止相关并发症的发生与恶化是控制这类病人的病情发展的基本方式[2]。而蛋白尿、血尿等正是糖尿病并发症的一种主要临床特征,其发病机制与糖代谢紊乱、血脂异常和细胞因子表达异常等多种因素密切相关[3]。近年来研究表明,肾小球细胞炎症因子的过度表达会导致肾小球血管及滤过膜通透性增加,进而导致尿蛋白渗出增加,加剧糖尿病病理进展[4]。因此对于糖尿病患者肾脏的保护也成为了辅助治疗手段的一种。
目前,临床上使用的一些降糖类药物虽然能改善Ⅱ型糖尿病患者的健康状况,但都会产生低血糖、胃肠道疾病及心脑血管疾病等不同的不良反应及毒副作用[5−6]。因此,天然的降糖活性物质的研究开发及生产问题成为了主要研究热点之一。查阅大量文献可知,从植物中提取出的多糖具有良好的降糖作用,这与加强机体抗氧化活性、降低脂质过氧化损伤存在着密切的关系,如党参多糖、黄芪多糖等[7−8]。因此,从植物中提取天然多糖并研究开发出无不良反应或毒副作用小的降糖类药物已经成为了主要的发展趋势。
毛水苏(Stachys baicalensisFisch. ex Benth.)是唇形科水苏属多年生草本植物,喜欢生长于湿润、微酸的肥沃土壤,原产于巴尔干半岛、黑海沿岸至西亚,主要分布于我国东北三省、内蒙、山东、陕西等湿地地区,具有祛风解毒,止血之功效,可全株入药,但目前针对其多糖等药理活性成分的研究未见详细报道[9−10]。本实验采用STZ 低剂量腹腔注射结合喂养高脂高糖饲料创建Ⅱ型糖尿病小鼠模型。通过研究毛水苏多糖(polysaccharides fromStachys baicalensis,SBP)对糖尿病小鼠的生活状态、体重、血糖、肾脏指数与肾脏功能的影响,检测肾脏组织中的抗氧化指标,观察肾脏病理,以及测定肾脏组织中炎症因子mRNA 的表达水平,对毛水苏多糖在糖尿病患者肾脏的防治过程中的作用机制进行初步探究。
1 材料与方法
1.1 材料与仪器
雄性昆明小鼠SCXK(吉)-2020-0002 延边大学;高糖高脂饲料 北京博爱港生物技术有限公司;丙二醛测定试剂盒、超氧化物歧化酶测定试剂盒、谷胱甘肽过氧化物酶活力测定试剂盒、过氧化氢酶活力测定试剂盒 南京建成生物工程研究所;毛水苏采于佳木斯大学农林实验实习基地(46°46′58″N,130°21′6″E);Animal Total RNA Isolation Kit Cat.No.RE-03011/03014,成都福际生物技术有限公司 ;2×F8 FastLong PCR Master Mix 北京艾德莱生物科技有限公司;PrimeScriptTM RT reagent Kit with gDNA Eraser Code No.RR047A,TaKaRa ;SYBR Green qPCR Mix(with Rox) Cat. No P2091a,东盛生物科技有限公司 ;柠檬酸、柠檬酸钠、盐酸二甲双胍缓释片 北京博爱港生物技术有限公司;无水乙醇天津市凯通化学试剂有限公司;链脲佐菌素Sigma;氯化钠注射液 吉林省都邦药业股份有限公司。
台式高速冷冻微量离心机 Sigma;GA-3 型血糖仪、血糖试纸 三诺生物传感股份有限公司;TDZ4-WS 低速台式离心机 长沙湘仪离心机仪器有限公司;XDS-18 倒置显微镜 北京荣兴光恒科技有限公司;FA2004 电子天平 上海浦春计量仪器有限公司;全自动多功能酶标仪 Bio Tek;HWS-250B恒温恒湿箱 天津市泰斯特仪器有限公司;NanoDrop One Thermo Scientific;梯度PCR 仪 Eppendorf;LightCycler96 实时荧光定量PCR 仪 罗氏;−80 ℃超低温冰箱 Thermo Scientific USA;微量移液器
Eppendorf;DYY-12 型电泳仪 北京六一。
1.2 实验方法
1.2.1 SBP 的提取 在锥形瓶中加入3.00 g 烘干后的毛水苏粉末,按22:1 mL/g 的液料比加入蒸馏水,超声辅助提取(22 min,350 W,70 ℃)的溶液冷却至室温,3500 r/min 条件下离心15 min,保留上清液,进行抽滤,将得到的滤液减压浓缩,定容至10 mL,按1:4 的比例加入无水乙醇,4 ℃冰箱醇沉24 h,醇沉液离心(3500 r/min,15 min),保留沉淀物,并将沉淀加蒸馏水溶解,再次减压浓缩,冷冻干燥得到粗多糖粉末。称取适量的冻干粉末,加入一定的蒸馏水溶解,采用AB-8 大孔树脂脱除色素,5%三氯乙酸脱除蛋白,使用3500 目透析袋除盐,将得到的去杂溶液减压浓缩,经DEAE-52 纤维素层析柱分离得4 组分,取含量占比最高组分为样品(多糖纯度70.50%),冻干备用[11−12]。
1.2.2 Ⅱ型糖尿病小鼠模型的建立及实验分组 挑选体重在(20±2)g 范围内的清洁级昆明小鼠,随机平均分为7 组,每组10 只,共计70 只,均为雄性。将小鼠于恒定温度18~22 ℃和湿度50%~60%的环境下饲养,普通饲料适应性饲养7 d,适应性饲养后,随机抽取其中一组用普通饲料喂养,为空白组。其余6 组改用高脂高糖饲料持续喂养,每7 d 对小鼠的体重进行一次测量并每天更换垫料,4 周后,小鼠禁食12 h 后,使用STZ 溶液对小鼠迅速进行腹腔注射,注射剂量为80 mg/kg,注射后死亡率为4.29%。空白组小鼠注射相同剂量柠檬酸-柠檬酸钠缓冲液,恢复小鼠饮食,空白组小鼠喂食普通饲料,其余6 组小鼠喂养高脂高糖饲料维持血糖,腹腔注射结束72 h 后,对小鼠做禁食12 h 处理后,断尾取尾静脉血用于测定小鼠空腹血糖值。以11 mmol/L 作为临界值,当测定的血糖值大于此数值时,则认定为成功创建Ⅱ型糖尿病小鼠模型[8]。造模完成后,取造模成功小鼠50 只,将其随机分为5 个组,每组10 只,分别为模型、多糖低、中、高剂量组和阳性对照组。空白组和模型组小鼠每天灌胃0.1 mL/10 g 蒸馏水,多糖组小鼠按低、中、高顺序每天分别用SBP 灌胃50、100、200 mg/kg,阳性组小鼠每天用200 mg/kg 二甲双胍进行灌胃,连续灌胃28 d。除空白组小鼠一直用普通饲料喂养,其他组小鼠从开始造模至试验结束,以高脂高糖饲料喂养,保证维持小鼠高血糖症状[13−15]。
1.2.3 糖尿病小鼠体重与血糖的测定 每天给药前先记录小鼠死亡情况,观察并记录毛发、气味、精神状况及“三多一少”状,造模成功后,每周称量一次小鼠体重。给药后每7 d 取小鼠尾静脉血一次,用于测定小鼠空腹血糖值,测定前小鼠做禁食12 h 处理,连续测量4 次。
1.2.4 肾功能指标的测定 灌胃28 d 后,末次给药24 h 后,无菌环境下进行脊椎脱臼处死,用酒精球擦拭小鼠腹部,手术剪开腹,腹腔主动脉取血0.5 mL,3500 r/min 离心15 min,取上清液,分离血清,注明标签于−20 ℃保存[16]。试验结束后,按照血液分析仪操作规程,测定血肌酐(Scr)、尿素氮(BUN)和尿蛋白含量。
1.2.5 肾脏指数的测定 小鼠处死取腹主动脉血后,解剖小鼠观察肾脏情况,并摘取小鼠双侧肾脏,用生理盐水冲洗粘连组织,滤纸吸干血水,将双肾筋膜剥离后称湿重,按以下公式计算肾脏指数。取两部分组织分别浸泡在4%福尔马林固定液中和冰浴的生理盐水溶液中保存待用,进行肾脏组织病理学检测和抗氧化酶活力的测定。
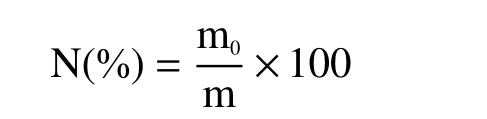
式中,N 为肾脏指数;m0为肾脏重量,g;m 为小鼠体重,g。
1.2.6 肾脏抗氧化酶活力的测定 剪取生理盐水溶液中的肾脏组织0.2 g,加入1.5 mL 预冷的生理盐水,冰浴下充分研磨,匀浆,3000 r/min 离心15 min,取上清液,迅速转移到新的离心管中,分离出组织匀浆注明标签,置于−20 ℃保存待测。试验结束后,按检测试剂盒说明书,测定超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活力、过氧化氢酶(CAT)活力及丙二醛(MDA)的含量。
1.2.7 组织病理学观察 固定液中的肾脏组织经脱水,石蜡包埋,制片,HE 染色(苏木素-伊红染色)后,在电子显微镜下观察各组小鼠组织形态学差异。
1.2.8 qRT-PCR 法检测肾脏组织中VCAM-1、IL-1β及IL-6 的mRNA 水平 取肾脏组织20 mg 在液氮中研磨,Animal Total RNA Isolation Kit 试剂盒提取总RNA。使用Nanodrop 2000 检测RNA 浓度及纯度。取适量RNA 溶液按照2×F8 FastLong PCRMasterMix试剂盒合成cDNA 第一链。对cDNA 进行PCR 扩增反应,并以GAPDH 为内参。PCR 循环条件为95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火并延伸30 s,40 个循环;熔解曲线65 ℃到95 ℃,每15 s 升温0.3 ℃。
引物使用Primer Premier 5.0 设计,由深圳华大基因科技服务有限公司合成,见表1。所得数据采用2−△△Ct法进行统计分析。

表1 荧光定量PCR 引物序列Table 1 Primer sequence of fluorescent quantitative PCR
1.3 数据处理
数据结果以平均数(average)±标准差(SD)形式表示,采用SPSS 16.0 软件分析所得数据,P<0.05 表示具有显著性差异。
2 结果与分析
2.1 小鼠外观形态的观察
在试验期间每天观察小鼠状态,发现空白组小鼠进食、饮水及排尿量基本正常,活泼好动,毛色洁白鲜亮且顺滑,体重持续增长并且增长较快,垫料更换时基本无异味;模型组小鼠体重持续下降,毛色粗糙、暗淡且有泛黄的表现,精神状态萎靡,摄食量、进水量及排尿量增加,典型的“三多一少”症状,垫料异味加重。与模型组相比较,SBP 高、中、低剂量组及二甲双胍组治疗,小鼠状态均有所改善。
2.2 SBP 对糖尿病小鼠体重的影响
体重变化是评价是否患糖尿病指标之一,它能直观的反应出能量摄入与消耗之间的动态变化。造模成功后,小鼠体重均无明显差异,将给药7、14、21、28 d 的体重列于表2。由表中数据可知:给药期间,空白组食用常规饲料,体重涨幅均在正常变化范围内,与空白组相比,实验组食用高脂高糖饲料结合STZ 注射破坏体内激素水平,致使小鼠体重均显著低于空白组(P<0.05);与模型组小鼠相比,给药组小鼠体重逐渐上升,但仍低于空白组,说明SBP 对糖尿病小鼠体重减轻状况有所改善。结束给药后,与灌胃初期(7 d)相比SBP 低、中、高剂量及阳性组体重分别提升了19.85%、23.98%、30.52%、33.48%,其中,高剂量组小鼠体重与阳性组小鼠体重差异无统计学意义(P>0.05),表明SBP 高剂量组在改善糖尿病小鼠体重方面与二甲双胍阳性组效果相当。
表2 SBP 对糖尿病小鼠体重的影响(g, ±s,n=10)Table 2 Effect of SBP on body weight of diabetic mice(g, ±s, n=10)
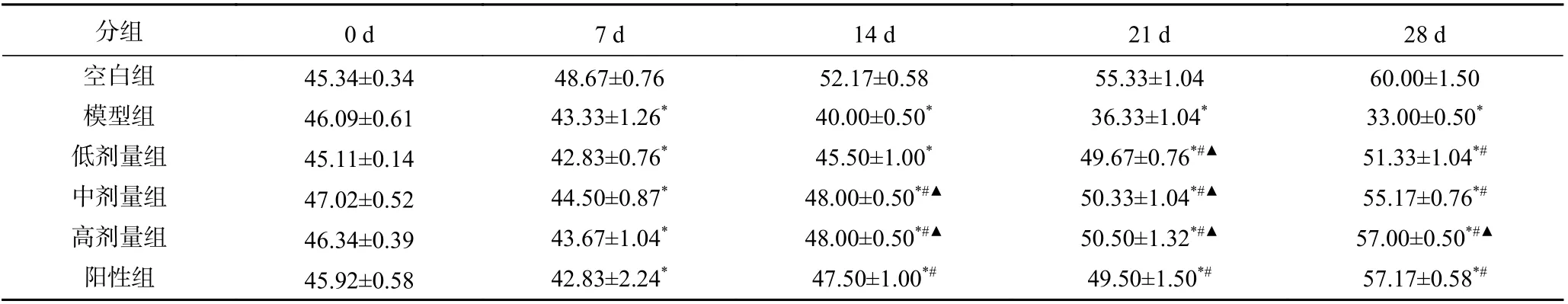
表2 SBP 对糖尿病小鼠体重的影响(g, ±s,n=10)Table 2 Effect of SBP on body weight of diabetic mice(g, ±s, n=10)
注:与空白组相比,*:P<0.05;与模型组相比,#:P<0.05;与阳性组相比,▲:P>0.05;表3~表6同。
分组 0 d 7 d 14 d 21 d 28 d空白组 45.34±0.34 48.67±0.76 52.17±0.58 55.33±1.04 60.00±1.50模型组 46.09±0.61 43.33±1.26* 40.00±0.50* 36.33±1.04* 33.00±0.50*低剂量组 45.11±0.14 42.83±0.76* 45.50±1.00* 49.67±0.76*#▲ 51.33±1.04*#中剂量组 47.02±0.52 44.50±0.87* 48.00±0.50*#▲ 50.33±1.04*#▲ 55.17±0.76*#高剂量组 46.34±0.39 43.67±1.04* 48.00±0.50*#▲ 50.50±1.32*#▲ 57.00±0.50*#▲阳性组 45.92±0.58 42.83±2.24* 47.50±1.00*# 49.50±1.50*# 57.17±0.58*#
2.3 SBP 对糖尿病小鼠空腹血糖的影响
根据每周对小鼠空腹血糖的监测,如表3 可知,模型组小鼠血糖明显高于空白组,存在显著性差异(P<0.05),且一直维持高血糖水平,说明高糖高脂饲料结合低剂量STZ 诱导的糖尿病小鼠模型成功。给药期间,高剂量组和阳性组的降血糖效果明显优于低、中剂量组,且给药组小鼠血糖持续降低,说明多糖对糖尿病小鼠有降血糖作用且较稳定,无自我恢复现象。在结束给药后,高剂量组血糖水平的调节效果已经较为明显并接近于阳性组,与模型组相比SBP 低、中、高剂量及阳性组分别降低了18.76%、23.17%、43.31%、49.92%,其中,高剂量组小鼠血糖值和阳性组血糖值差异无统计学意义(P>0.05),说明SBP 高剂量组在治疗糖尿病小鼠体内激素紊乱现象具有一定的调节作用,其治疗效果与二甲双胍阳性组相当。
表3 SBP 对糖尿病小鼠空腹血糖的影响(mmol/L, ±s,n=10)Table 3 Effect of SBP on fasting blood glucose of diabetic mice(mmol/L, ±s, n=10)

表3 SBP 对糖尿病小鼠空腹血糖的影响(mmol/L, ±s,n=10)Table 3 Effect of SBP on fasting blood glucose of diabetic mice(mmol/L, ±s, n=10)
分组 7 d 14 d 21 d 28 d空白组 5.28±0.14 5.87±0.08 5.40±0.25 5.64±0.25模型组 23.38±1.16* 26.70±0.74* 28.17±0.76* 29.64±0.60*低剂量组 24.89±1.42* 23.16±2.02*# 22.03±0.39*# 20.22±0.39*#中剂量组 24.69±4.12* 23.04±1.50*# 19.90±0.61*# 18.97±0.59*#高剂量组 23.60±2.57* 22.52±1.51*# 19.05±0.96*#▲ 13.38±1.26*#▲阳性组 25.16±1.25* 22.74±1.55*# 18.08±1.58*# 12.60±2.29*#
2.4 SBP 对糖尿病小鼠肾脏功能的影响
肌酸在体内进行代谢分解,其产物主要就是血肌酐(Scr),蛋白质在体内进行分解代谢后的末端产物即为尿素氮(BUN)。目前,临床上一般将Scr 和BUN 作为肾衰竭的常用检测项目。通常情况下健康的生物体的尿液中是不能够检测出蛋白质,对人类而言,一旦在尿常规中检测出小分子蛋白,那么就可以初步判定该患者肾脏滤过功能不完全。本试验将解剖时所取的腹主动脉血经血液分析仪检测,从而间接地反映出糖尿病小鼠肾功能情况。由表4 可知,与空白组相比,模型组、SBP 低、中、高剂量组及阳性组小鼠的Scr、BUN 和尿蛋白含量均显著升高(P<0.05),说明糖尿病小鼠的肾功能均表现出损伤情况。但经SBP 灌胃治疗28 d 后,SBP 低、中、高剂量组的Scr 较模型组相比均存在有下降趋势(P<0.05),且随着SBP 浓度的增加,下降幅度越大;SBP 低、中、高剂量组中的高剂量组BUN 下降趋势最为明显,且药效与阳性组接近,二者间差异无统计学意义(P>0.05);此外,数据显示,糖尿病小鼠在进行SBP 治疗后,较模型组而言,尿蛋白含量均显著降低,且随着SBP 浓度的增加,尿蛋白含量呈递减趋势。
表4 SBP 对糖尿病小鼠肾功能的影响(±s,n=10)Table 4 Effect of SBP on kidney function of diabetic mice(±s, n=10)

表4 SBP 对糖尿病小鼠肾功能的影响(±s,n=10)Table 4 Effect of SBP on kidney function of diabetic mice(±s, n=10)
分组 Scr(μmol/L) BUN(mmol/L) 尿蛋白(g/μmol)空白组 45.54±1.11 8.06±0.33 0.81±0.02模型组 88.85±0.49* 18.75±0.35* 12.54±0.86*低剂量组 71.87±1.68*# 17.62±0.55*# 8.40±0.24*#中剂量组 61.12±0.98*# 16.74±0.52*# 7.70±0.48*#高剂量组 56.55±0.52*# 14.05±0.81*#▲ 6.69±0.49*#阳性组 51.15±1.51*# 13.96±0.76*# 4.48±0.47*#
2.5 SBP 对糖尿病小鼠肾脏指数的影响
糖尿病患者的肾脏损伤是常见的高血糖慢性并发症之一,由于体内激素分泌紊乱,致使肾脏负担加重,进而会导致肾脏损伤或者肿大等现象的发生。将计算后的肾脏指数列于下表,由表5 数据可知,与空白组相比,模型组小鼠肾脏指数显著增加(P<0.05),说明STZ 诱导的糖尿病小鼠肾脏功能存在一定损伤。与模型组相比,SBP 低、中、高剂量及阳性组的肾脏指数均显著下降(P<0.05),分别降低了6.01%、15.74%、20.37%、24.07%,表明SBP 对于糖尿病小鼠肾脏指数的改善效果存在量效关系,且SBP 高剂量组与阳性组的肾脏指数差异无统计学意义(P>0.05)。
表5 SBP 对糖尿病小鼠肾脏指数的影响(±s,n=10)Table 5 Effect of SBP on the viscera index of diabetic mice(±s, n=10)
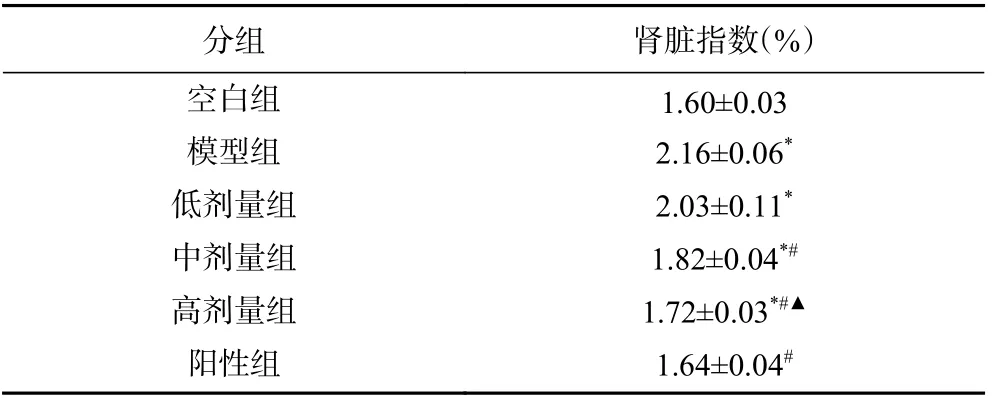
表5 SBP 对糖尿病小鼠肾脏指数的影响(±s,n=10)Table 5 Effect of SBP on the viscera index of diabetic mice(±s, n=10)
分组 肾脏指数(%)空白组 1.60±0.03模型组 2.16±0.06*低剂量组 2.03±0.11*中剂量组 1.82±0.04*#高剂量组 1.72±0.03*#▲阳性组 1.64±0.04#
2.6 SBP 对糖尿病小鼠肾脏组织抗氧化能力的影响
超氧酸氢酶(SOD)是一种防止机体体内氧化的重要金属酶。它是唯一一个将超氧阴离子作为反应底物的酶。让超氧阴离子直接分解成水和氧,阻碍过氧化脂质的生产,能够减少对机体的伤害,使机体抗氧化能力增强[17−19]。谷胱甘肽过氧化物酶(GSH-Px)是一种广泛存在于身体中的分解酶,分解过氧化物(有毒)转化生成为羟基化合物(无毒),促进过氧化氢的分解,进而促使过氧化物无法损坏细胞膜的功能及构造[20−21]。过氧化氢酶(CAT)是促进细胞内过氧化氢分解的酶。为了保护防止过氧化氢破坏抗氧化酵素系统的功能,不产生有的氢氧自由基,在机体部分组织中广泛存在于红细胞和过氧化体中[22−23]。由表6中数据可知,成功建立模型后,与空白组相比,模型组小鼠肾脏组织的SOD、GSH-Px 和CAT 含量均迅速下降,分别下降了49.12%、51.29%和55.06%(P<0.05)。给药后,给药组小鼠的SOD、GSH-Px、CAT 含量均有所上升,且随浓度的增加呈现递增趋势,与模型组相比,SBP 高剂量组SOD、GSH-Px 和CAT 含量分别上升了45.59%、52.99%和50.24%(P<0.05),其中CAT 含量变化与阳性组接近,二者间差异无统计学意义(P>0.05),说明SBP 能改善糖尿病小鼠肾脏组织中SOD、GSH-Px 和CAT 活力下降的症状,且其中对于CAT 活力的改善效果SBP 高剂量组等同于阳性组。
表6 SBP 对糖尿病小鼠抗氧化指标的影响(±s,n=10)Table 6 Effect of SBP on antioxidant indicators of diabetic mice(±s, n=10)

表6 SBP 对糖尿病小鼠抗氧化指标的影响(±s,n=10)Table 6 Effect of SBP on antioxidant indicators of diabetic mice(±s, n=10)
分组 SOD(U/mg) GSH-Px(U/mg) CAT(U/mg) MDA(nmol/mg)空白组 26.61±0.74 1314.51±78.78 45.66±0.45 1.22±0.10模型组 13.54±0.53* 640.35±65.94* 20.52±0.97* 3.04±0.10*低剂量组 15.91±0.93*# 801.05±25.29*# 26.62±0.76*# 2.89±0.05*中剂量组 18.70±0.49*# 878.43±35.11*# 27.75±0.80*# 2.18±0.08*#高量组 19.70±0.59*# 979.65±40.74*# 30.83±0.34*#▲ 1.95±0.05*#阳性组 21.92±0.75*# 1151.82±58.35*# 30.66±0.41*# 1.56±0.17*#
丙二醛(MDA)是人体脂质过氧化伤害的重要标志,其含量降低可提高机体抗氧化能力[24−25]。由下表数据可知,与空白组相比,模型组小鼠肾脏组织的MDA 含量迅速升高(P<0.05),说明模型组小鼠处于脂质过氧化现象。给药结束后,与模型组相比,SBP 低、中、高剂量组及阳性组MDA 含量均显著下降(P<0.05),说明SBP 对糖尿病小鼠肾脏组织中的MDA 具有一定程度的抑制作用,且随着浓度的增高,效果更加明显。
2.7 SBP 对糖尿病小鼠肾脏组织影响的病理学观察
为了更加直观检验糖尿病小鼠的肾脏存在的损伤情况,验证SBP 可以有效缓解糖尿病小鼠的肾脏损伤情况,在给药28 d 后,将各组小鼠的肾脏组织切片经HE 染色后,结果如图1 所示。从图中可以看出,空白组小鼠肾小球结构形态清晰正常,外形细胞规则饱满,血管充盈,肾小管形态、管腔正常,肾间质清晰可见,细胞核排列紧密均匀较为圆满。与空白组相比,模型组肾脏结构、肾小球结构不清晰且被破坏,组织出现病变情况,外形细胞形状不规则且分布不均匀,内部浸润着大量的炎性细胞,肾小管形态畸变肿胀肥大、管腔被挤压或撕扯,肾间质模糊,纤维

图1 各组小鼠肾脏组织形态学观察(HE100×)Fig.1 Histopathology of renal hetle in mice of each group(HE100×)
化程度高,细胞核排列杂乱无章,且形状多为椭圆形,个别为扁状形态,细胞核多为空核状态,个别出现溶解、破碎情况。与模型组相比,SBP 各剂量组糖尿病小鼠的肾脏病变情况有所改善,其中高剂量组治疗效果较为明显,肾小球形状有所缓解,形状较为规则清晰,肾间质纤维程度与炎性细胞浸润情况稍有改善,肾小管形态和管腔孔道有所恢复,细胞核形态也在逐步恢复,发生溶解和破碎数量较少,表明SBP 高剂量组对肾脏组织损伤具有一定的改善作用。
2.8 SBP 对糖尿病小鼠肾脏组织炎症反应的抑制作用
糖代谢的障碍紊乱可能会引起一系列病理学变化,其中炎症反应与肾小球硬化症的发生密切相关,是促进糖尿病肾病发病和发展的重要机制之一[26−27]。药理学研究表明,微炎症是初期糖尿病肾症病理学变化的特点之一。因此,靶向炎症反应是用于抑制糖尿病肾病恶化的一项有力手段。VCAM-1 是通过促进炎症反应和纤维化而参与糖尿病肾病发病的一种重要血管细胞粘结分子,其水平与患者的尿蛋白和浸润细胞的数量存在着密切的关系,可以用于患者的临床评价[28−29]。IL-1β及IL-6 可以改变血管通透性,增加了趋化蛋白因子的表达,导致肾小球膜细胞外基质部分的增殖和合成。是诱发血管病变的关键炎症因子之一[30−31]。由图2 可知,与空白组相比,模型组小鼠中VCAM-1、IL-1β及IL-6 的mRNA 水平显著升高(P<0.05),SBP 高剂量干预能够有效抑制糖尿病小鼠VCAM-1、IL-1β及IL-6 的mRNA 水平(P<0.05)。
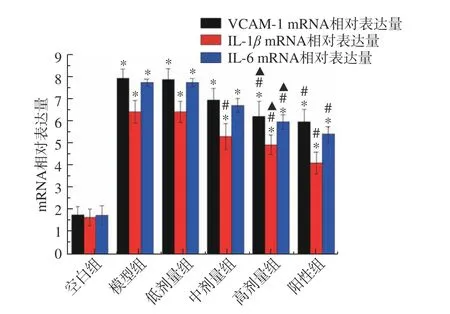
图2 SBP 对糖尿病小鼠肾脏组织中VCAM-1、IL-1β 和IL-6mRNA 表达量的影响Fig.2 Effect of SBP on mRNA levels of VCAM-1,IL-1β and IL-6 of in kidney of diabetic mice
3 讨论与结论
采用STZ 低剂量腹腔注射结合喂养高脂高糖饲料建立Ⅱ型糖尿病小鼠模型,研究了毛水苏多糖对糖尿病小鼠肾脏的保护作用。结果表明,在高脂高糖的饲养条件下,小鼠出现体重减轻、血糖升高、肾脏器官肿胀、肾功能以及肾脏结构损伤等症状。经过毛水苏多糖28 d 灌胃干预后,可显著降低糖尿病小鼠的血糖和肾脏指数(P<0.05),改善小鼠体重下降的情况,使小鼠的精神状态趋于正常。与模型组相比,高剂量组的毛水苏多糖降低了小鼠体内血肌酐、尿素氮含量,缓解糖尿病尿糖、尿蛋白等症状的发生,修复肾脏的肿大和损伤,缓解肾脏组织发生的病理学改变,炎症细胞浸润而造成的肾小球畸变和细胞核空核、肾小球形态结构模糊混乱等症状都有所改善。
此外,实验结果显示,毛水苏多糖能够显著改善糖尿病小鼠的抗氧化能力减弱症状(P<0.05)。较空白组而言,模型组小鼠肾脏组织的抗氧化酶活力系统中SOD、GSH-Px 和CAT 活力均下降,MDA 含量上升。但在毛水苏多糖各剂量组连续灌胃干预28 d后,小鼠肾脏组织的抗氧化酶活力系统中SOD、GSHPx 和CAT 活力有所回升,MDA 含量较模型组也明显降低。因此,可以初步判定毛水苏多糖对糖尿病小鼠肾脏的保护可能与抗氧化损伤有关。毛水苏多糖高剂量组的效果最为明显,虽与空白组水平仍存在一定差距,但从总体上分析可以得出,毛水苏多糖确实具有增强小鼠抵抗脂质过氧化反应的能力,有效抑制机体过氧化和脂质过氧化情况的发生。并且从检测的VCAM-1、IL-1β及IL-6 的mRNA 水平中可以看出毛水苏多糖具有调节糖尿病小鼠肾脏组织的炎症作用,本实验以与糖尿病患者肾脏恶化的相关炎症因子VCAM-1、IL-1β及IL-6 为指标,评价了毛水苏多糖对改善肾脏炎症损伤的效果,发现毛水苏多糖高剂量组能够调节炎症因子,明显降低其mRNA 的表达水平,进而间接性的抑制糖尿病肾脏组织的损伤。
综上所述,毛水苏多糖具有明确的降血糖活性,能够明显改善糖尿病小鼠的肾脏损伤情况。其保护机制可能与下调VCAM-1、IL-1β及IL-6 介导的炎症反应,上调SOD、GSH-Px、CAT 并下调MDA 抗氧化通路减轻氧化应激损伤有关,但由于所用多糖成分为粗提物,其重复性、稳定性尚未可知,虽然经历了除杂的过程但仍然是一种复合物,其确切机制、药物的具体作用成分以及作用靶点尚不明确,因此有待进行更深一步研究。

