1-MCP 处理期不同成熟度‘霞晖8 号’桃果实贮藏中品质和生理生化特性的影响
侯佳迪,朱丽娟,王军萍,刘少伟,郁志芳
(南京农业大学食品科技学院,江苏南京 210095)
水蜜桃是我国桃果实的主要类型,在我国中南部地区栽培广泛。其果实汁液丰富、甜度高、口感好;富含多种维生素,其中以维生素C 含量最高,其蛋白质和铁含量也比苹果高3~5 倍;除此之外,水蜜桃还具有美肤、清胃、祛痰润肺等功效,深受消费者喜爱,尤其是中晚熟品种[1]。水蜜桃采收期间高温、雨水多,易受到外界微生物侵染[2],进而影响果实的商品性和贮藏时间。
水蜜桃作为一种成熟期短且贮藏困难的水果,采用适当的保鲜技术和方法以延缓果实的衰老、延长货架期十分必要。目前,关于水蜜桃贮藏保鲜技术已有较多研究,如Zhao 等[3]使用热空气和瓜氏毕赤酵母处理桃果实,发现二者单独处理均可以在不同程度上改善桃果实质量指标,在联合处理后能够明显提高总酚含量并减少了谷胱甘肽含量,抑制丙二醛和相对电导率的上升。Zhu 等[4]则提出一氧化氮可能与ACC 氧化酶结合形成ACC 氧化酶-NO 复合物,该复合物经过与ACC 螯合,阻断乙烯生成通路,减少乙烯释放量。Liu 等[5]初步研究结果显示,5 μL/L 1-MCP 可以有效地延迟桃果实中阳性酚类化合物峰值的出现并抑制总抗氧化活性。李军等[6]研究提出,采用1.0 μL/L 1-MCP 熏蒸12 h 结合0.02 mm MAP包装处理‘湖景蜜露’可有效维持贮藏期间果实琥珀酸脱氢酶和细胞色素氧化酶的活性,减弱细胞呼吸代谢,延缓果实采后后熟及衰老进程。目前,对水蜜桃贮藏保鲜技术的探索多采用成熟度较高的果实为对象,对于成熟度稍低的果实研究较少。本实验以‘霞晖8 号’为实验材料,深入探究1-MCP 处理对不同成熟度水蜜桃果实常温贮藏期间品质和生理生化特性的影响,为1-MCP 高效应用于采后水蜜桃保鲜技术的开发提供实践依据。
1 材料与方法
1.1 材料与仪器
‘霞晖8 号’水蜜桃 于2019 年7 月30 日采自江苏省溧水市北山桃园,果实采收后以空调运输车2 h内送至实验室,20 ℃条件下选取无病虫害、无机械伤、大小均匀果实用于实验,果实根据硬度分为低成熟度和高成熟度两组。三氯乙酸 分析纯,上海凌峰化学试剂有限公司;2-硫代巴比妥酸(生化试剂)、愈创木酚(化学纯)、30%过氧化氢溶液(分析纯) 上海沪试化工有限公司;氮蓝四唑 含量>98%,上海瑞永生物科技有限公司;L-甲硫氨酸 含量>98%,上海瑞永生物科技有限公司;核黄素 中国惠兴生化试剂有限公司;二硫代硝基苯甲酸、无水乙醇 分析纯,广东光华科技股份有限公司;L-抗坏血酸 含量>99.99%,麦克林;Ttiton X-100 化学纯,上海源叶生物科技有限公司;碘 分析纯,国药集团化学试剂有限公司;硫代硫酸钠 分析纯,南京寿德试验器材有限公司;可溶性淀粉 西陇科学股份有限公司;其余所有试剂 均为分析纯。
FE30 电 导 率 仪 METTLER TOLEDO 公 司;PAL-1G 迷你电子数显折光仪 ATAGO 公司;GY-4 果实硬度计 深圳市朗普电子科技有限公司;6890N 气相色谱仪(配有氢火焰离子检测器和联机工作台)、19095P-S23 气相色谱毛细柱(30 m×0.53 mm)
安捷伦科技(中国)有限公司;Checkmate 3 二氧化碳呼吸测定仪 Dansensor 公司;H1750R 台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;Alpha-1860A 紫外可见分光光度计(配有石英比色皿和玻璃比色皿) 上海谱元仪器有限公司;XW-80A 微型旋涡混合仪 上海沪西分析仪器厂有限公司。
1.2 实验方法
1.2.1 材料及处理方法 将低成熟度和高成熟度的‘霞晖8 号’桃果实分别随机分为两组,一组用于1-MCP 处理,一组为对照。分组的果实放入泡沫箱中,以10 μL/L 的1-MCP 处理并保持密闭12 h,处理结束后将果实放入塑料袋中并置于塑料筐在(20.0±1.0)℃贮藏;以同样方式操作但不进行1-MCP 处理为对照(CK)。贮藏期间分别于0、2、4 和6 d 测定果实的品质和生理生化指标。测定每样品20 个果实,每处理3 个平行样品。
1.2.2 硬度和可溶性固形物的测定 硬度测定根据Denoya 等[7]的方法并稍作修改,使用GY-4-J 水果硬度计,用直径为8.0 mm 的锥形探针头在10 mm最终穿透深度处固定的纹理分析仪来测定桃果实的硬度。去除1 mm 果皮的每个水果赤道的对侧进行了两次测量,结果用牛顿(N)表示。可溶性固形物使用ATAGO 迷你数显折射计测定,测定结果根据当前室温进行校正,结果以%表示。
1.2.3 呼吸速率和乙烯释放量的测定 呼吸速率采用呼吸仪法进行测定,取800 g 左右完整桃果实(约4 个)放入密封的呼吸罐中,于20 ℃下放置1 h。各处理及三个平行样品的质量相近。呼吸速率直接用呼吸测定仪测定,结果表示为 CO2mg·kg−1·h−1,计算公式如下
呼吸强度(CO2μg/ kg·h)=(1.96×1000×V×A%)/(t×m)
式中:CO2密度为1.96×103g/L,A%为呼吸仪数值,m 为样品重量,kg,t 为测定时间,h。
乙烯释放量使用安捷伦6890N 气相色谱仪测定,抽取1 ml 上述放置1 h 后呼吸罐中的气体,注射入备有火焰离子化检测器的气相色谱仪中检测,采用外标法定量,结果表示为μL−1·kg−1·h−1。
GC 条件 色谱柱:19095P-S23 石英毛细柱(30 m×0.53 mm,0.25 μm);后进样口:120 ℃;后检测口250 ℃;保留时间4 min;氢气流速30 mL/min,空气流速260 mL/min,尾吹气(氮气)流速30 mL/min;柱箱温度100 ℃,进样量1 mL。

丙二醛(MDA)测定参照Shah 等[8]的实验方法并稍做修改。取2 g 桃果实样品用5 mL 5%的三氯乙酸在冰浴上研磨匀浆,匀浆液以10000 r/min 的转速在4 ℃下离心10 min,取上清液即为MDA 提取液,再取2 mL 提取液,于100 ℃水浴保温30 min,静置放凉后于波长450、532 和600 nm 下测定OD 值,最终结果表示为μmol·g−1FW。
MDA(μmol/L)=6.45×(A532−A600)−0.56×A450
1.2.5 超氧化物歧化酶(SOD)和过氧化物酶(POD)活性的测定 用NBT 荧光法测定SOD 活性,取2 g桃果实加入6 mL 预冷的磷酸缓冲液(pH 7.8,50 mmol/L)在冰浴上研磨成浆,10000 r/min 转速4 ℃下离心20 min,取上清液按加入反应试剂。暗中对照管加入核黄素后立即用锡箔纸裹住遮光,全部试剂加完后摇匀。将其余6 管放在4000 Lx 日光灯下显色反应45 min。反应结束后用黑布遮盖终止反应。以暗中对照管作为空白(调零),在560 nm 处抑制NBT 光还原的50%为1 个酶活性单位(U),最终结果表示为 U·g−1FW。
SOD( U·g−1FW) =( OD对照−OD样品) ×V/(50%×OD对照×Vs×m×t)
式中:SOD 总活性以鲜重酶单位每克表示;比活力单位以酶单位每毫克蛋白表示;OD 对照为光照对照管的吸光度;OD 样品为样品管的吸光度;V 为样品液总体积,mL;Vs 为测定时样品用量,0.1 mL;t 为反应时间(h),min;m 为样品质量,g。
POD 活性测定方法参照张玉敏[9]的方法并稍作修改,称取2 g 桃果实样品于研钵中,加入6 mL 磷酸缓冲液(pH 7.8,50 mmol/L)在冰浴上研磨成浆,匀浆液于4 ℃ 12000 r/min 转速离心30 min,取上清液进行后续测定。再吸取1 mL 上清液,加入0.3%愈创木酚溶液2.2 mL,再加入0.3% H2O20.6 mL,每隔1 min 记录吸光值A470的读数,连续记录3~5 min。POD 以每分钟内吸光度A470变化0.001 所需的酶量为1 个酶活力单位,结果表示为U·min−1·g−1FW。
1.2.6 还原型抗坏血酸(RASA)和还原型谷胱甘肽(RGSH)含量的测定 RASA 测定方法根据红菲罗啉比色法并略作修改,称取5 g 样品加入10 mL 50 g/L TCA 溶液,在冰浴条件下研磨成浆状,4 ℃ 12000 r/min 条件下离心10 min,取1 mL 上清液加入1 mL 50 g/L TCA 溶液,于534 nm 处根据吸光值和标准曲线计算含量,结果表示为μg·g−1FW。RGSH 含量测定参照Wang 等[10]的实验方法并稍作修改,取2 g样品加入4 mL 4 ℃预冷的50 g/L TCA,冰浴研磨匀浆,匀浆液于4 ℃ 12000 r/min 条件下离心20 min,取1 mL 上清液,加入1 mL pH 7.8 0.1 mol / L PBS、0.5 mL 4 mmol / L 二硫代硝基苯甲酸,充分混匀后在412 nm 处根据吸光值和标准曲线计算含量,结果表示为 μg·g−1FW。
1.2.7 原果胶和聚半乳糖醛酸酶(polygalacturonase,PG)的测定 原果胶测定采用咔唑法[11]。称取样品5 g 研磨呈匀浆,加入50 mL 95%的乙醇,于沸水浴上加热30 min,重复3 次。过滤,滤渣放入三角瓶中,加40 mL 水,60 ℃水浴上加热30 min。过滤并洗涤滤纸和滤渣,滤渣放入三角瓶中,加50 mL 0.5 mL/L 硫酸,沸水浴加热1 h,过滤,洗涤滤渣,合并洗涤液冷却后移入100 mL 容量瓶中定容。吸取定容后测定液1 mL,沿试管壁缓慢加入6 mL 浓硫酸,混匀后沸水浴上加热20 min,冷却至室温,加入0.2 mL 0.15%咔唑溶液,摇匀后于暗处放置2 h,于530 nm 波长处测定吸光度值,根据标准曲线计算原果胶含量。聚半乳糖醛酸酶测定方法参考庄青[12]的实验方法并稍作修改。称取50 g 桃组织样品,匀浆后过滤待测,取3~5 mL 加入10 mL 1%果胶溶液(pH 3.5)和5 mL 水(调到pH 3.5),置于50 ℃水浴中保温2 h。取出后煮沸,冷却至室温待测。吸取5 mL 上述反应液,注入150 mL 的碘量瓶中,加1 mL 1 mol/L Na2CO3溶液和5 mL 0.1 mol/L 碘溶液,摇匀塞紧,室温下静置20 min(加入2 mL 1 mol/L H2SO4溶液,用0.05 mol/L Na2S2O3标准液滴定于淡黄色,加0.5%淀粉指示剂1 mL 继续滴定至蓝色消失为止,以不加酶液作空白)。上述条件下,每小时催化果胶分解生成1 mg 游离半乳糖醛酸定为一个酶活力单位。
1.2.8 琥珀酸脱氢酶(SDH)和细胞色素氧化酶(CCO)的测定 桃组织样品线粒体提取参照Palou 等[13]的方法,按1:4 的比例称取样品,加入4 ℃预冷的提取液(提取液包括50 mmol/L pH 7.5 Tris-HCl、1 mmol/L EDTA、0.1% BSA、0.5% PVP、0.1%
半胱氨酸、0.25 mol/L 蔗糖、0.3 mol/L 甘露醇)、匀浆3 次,每次15 s,用4 层纱布过滤,滤液4 ℃3000 r/min 离心20 min,取上清液4 ℃ 14000 r/min离心20 min,沉淀用80 mL 洗涤液(含1 mmol/L EDTA、0.1% BSA、10 mmol/L pH 7.2 Tris-HCl、0.25 mol/L 蔗糖、0.3 mol/L 甘露醇)洗涤,4 ℃14000 r/min 离心20 min,重复洗涤步骤,得到沉淀即为粗线粒体。用4 mL 悬浮液(内含10 mmol/L pH 7.2 Tris-HCl、0.25 mol/L 蔗糖、0.3 mol/L 甘露醇、1 mmol/L EDTA)悬浮粗线粒体沉淀,悬浮液即为线粒体制备液,用于SDH 和CCO 活性的测定。
SDH 活性测定参照Ackrell 等[14]方法并稍作修改。反应混合液包括0.5 mL 0.2 mmol/L pH 7.4 磷酸钾缓冲液、0.5 mL 0.2 mol/L pH 7.4 琥珀酸钠、0.2 mL 0.9 mmol/L 2,6-二氯酚靛酚钠(DCPIP)和蒸馏水。置于30 ℃条件下保温5 min,然后加1.0 mL线粒体制备液混匀,测定时加0.5 mL 0.33%甲硫酚嗪(PMS)摇匀,于600 nm 处测定吸光值的变化。CCO 活性测定参照Errede 等[15]的方法并稍作修改。反应系统包括:1.75 mL 200 mmol/L pH 7.4 磷酸钾缓冲液、0.5 mL 蒸馏水、0.5 mL 2% Triton X-100 和1 mL 线粒体制备液。放置在30 ℃条件下保温2 min,加入0.5 mL 20 mol/L 还原型细胞色素C,立即测定550 nm 处吸光值的变化。
1.3 数据处理
试验重复3 次,每组3 个平行,所有数据均为平行样品的平均值,以±s 表示。数据使用Excel 2019 处 理, SAS V8.0 进 行 ANOVA 分 析, 用Duncan’s 方差分析进行差异显著性检验,其中P<0.05 为显著差异水平。
2 结果与分析
2.1 1-MCP 处理对桃果实硬度和可溶性固形物含量变化的影响
果实硬度是最主要的品质指标之一,其变化可用于判断贮藏期间果实品质的改变大小。图1 显示,贮藏期间‘霞晖8 号’桃果实的硬度均发生不同程度的下降,且前两天下降明显,低成熟度果实的硬度在贮藏期间的各测定时间均显著高于高成熟度;贮藏6 d 后果实硬度大小为低成熟度1-MCP>低成熟度CK>高成熟度1-MCP>高成熟度CK,1-MCP 处理低成熟度和高成熟度果实的硬度分别为25.93 N和4.99 N,均显著高于两种成熟度对照果实同时间测定的8.42 N 和3.41 N,表明1-MCP 对延缓低成熟度果实的硬度下降更有效。
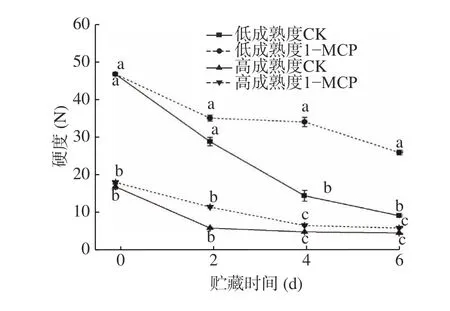
图1 1-MCP 处理对两种不同成熟度果实硬度变化的影响Fig.1 Effect of 1-MCP treatment on firmness change of peach fruits harvested at two maturity
可溶性固形物是果实风味的主要物质基础,‘霞晖8 号’桃果实贮藏期间可溶性固形物的变化如图2 显示。贮藏6 d 期间,对照和1-MCP 处理的两种成熟度果实的可溶性固形物均有下降,低成熟度果实的对照和处理果实间可溶性固形物贮藏期间变化差异不显著,高成熟度对照和处理果实的可溶性固形物除第4 d 外都有显著差异,但从图2 看出,1-MCP不论对成熟度高低的桃果实处理与否,可溶性固形物总体下降规律变化不大,说明1-MCP 处理对桃果实在贮藏期间可溶性固形物的变化影响不大。
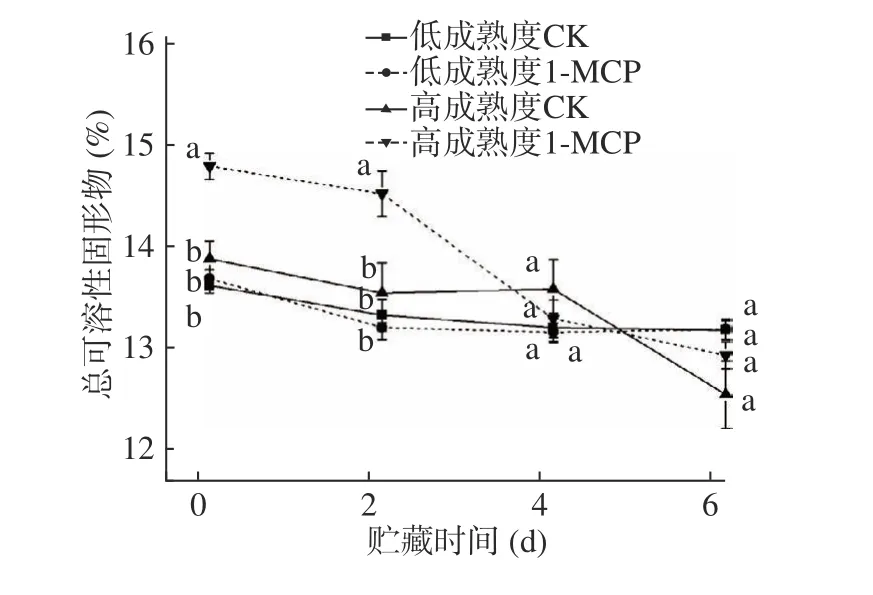
图2 1-MCP 处理对两种不同成熟度果实总可溶性固形物变化的影响Fig.2 Effect of 1-MCP treatment on total soluble solid change of peach fruits harvested at two maturity
2.2 1-MCP 处理对桃果实乙烯释放量和呼吸速率的影响
桃果实属呼吸跃变型果实,呼吸强度变化可反映果实的衰老进程[16];乙烯在果实贮藏过程中起到调控成熟的关键作用,内源乙烯的合成及信号传导直接关系到果实的成熟速率。图3 显示,高成熟度对照果实第2 d 出现乙烯最大值,而1-MCP 处理的高成熟度果实和低成熟度果实乙烯高峰出现在贮藏第4 d,且对于高成熟度果实,1-MCP 处理延迟了乙烯高峰,显著减少了乙烯释放量,峰值较对照降低了15.88%。以上结果表明,1-MCP 能有效抑制不同成熟度果实乙烯释放,在延缓果实成熟衰老方面有显著效果。

图3 1-MCP 处理对两种不同成熟度果实乙烯释放量变化的影响Fig.3 Effect of 1-MCP treatment on ethylene release change ofpeach fruits harvested at two maturity
两种成熟度的‘霞晖8 号’果实经1-MCP 处理后,贮藏期间呼吸强度均显著低于同时间的对照果实,高成熟度果实整体呼吸强度显著高于低成熟度果实(图4)。跃变型果实成熟期间,乙烯生物合成与呼吸作用存在相关,比较1-MCP 处理对两种成熟度‘霞晖8 号’果实乙烯释放和呼吸速率影响可见,作用效果是一致的,符合1-MCP 作用机制的研究结果[17]。值得注意的是,四组桃果实的呼吸高峰出现时间均晚于乙烯高峰,当乙烯释放量达到峰值时,果实呼吸速率恰好处于初步上升阶段,原因是乙烯高峰的出现加速果实成熟进程,促进代谢消耗,进而提高了果实的呼吸速率[18−19]。

图4 1-MCP 处理对两种不同成熟度果实呼吸速率变化的影响Fig.4 Effect of 1-MCP treatment on breathing rate change of peach fruits harvested at two maturity
2.3 1-MCP 处理对桃果实相对电导率和丙二醛(MDA)含量的影响
电导率的变化可以判断果实细胞的受损程度[20]。由图5 可知,不论是低成熟度组还是高成熟度组,在贮藏全过程中电导率均呈上升趋势,低成熟度果实电导率整体低于同期高成熟度果实。两种不同成熟度果实初始电导率分别在40%和55%左右,1-MCP 处理可以显著抑制贮藏期间电导率的上升,其中贮藏前期,对照组和处理组相对电导率差异较小,随着贮藏的推进,两者的差异逐渐增大,在贮藏后期(第6 d),两成熟度对照组和处理组相对电导率均存在显著差异(P<0.05)。结果表明,1-MCP 能有效维持细胞膜完整性,防止细胞破裂受损,避免果实细胞液过度流失,且对于低成熟度果实贮藏中后期作用效果更明显。MDA 含量常用于评价植物膜脂过氧化强弱和果实成熟衰老的指标[21]。由图6 可知,两种成熟度果实MDA 含量随贮藏时间的延长而增加,且以1-MCP 处理果实中MDA 含量较同成熟度同时间对照果实为低,相较于高成熟度组,1-MCP 在抑制低成熟度果实贮藏后期MDA 的升高具有更显著的效果,对照和处理果实第6 d 的MDA 含量分别为2.54 μmol·g−1FW 和2.35 μmol·g−1FW,达到显著差异,推测是因为贮藏后期组织细胞更易受到氧化影响,1-MCP 可以降低细胞膜脂受氧化程度,进而对MDA 增加有一定的抑制作用,表明1-MCP 对于维持桃果实组织完整性,延长商业货架期具有重要意义。
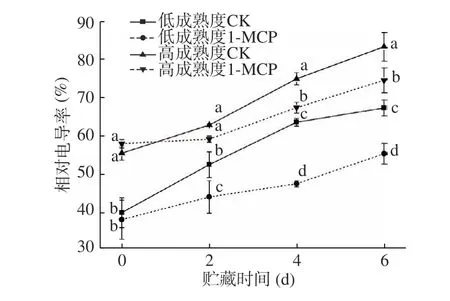
图5 1-MCP 处理对两种不同成熟度果实相对电导率变化的影响Fig.5 Effect of 1-MCP treatment on relative conductivity change of peach fruits harvested at two maturity
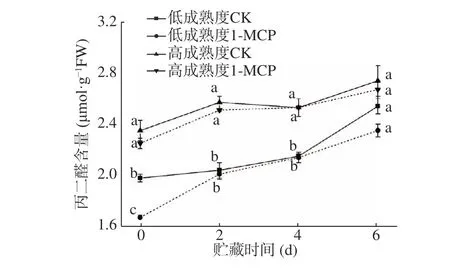
图6 1-MCP 处理对两种不同成熟度果实丙二醛变化的影响Fig.6 Effect of 1-MCP treatment on MDA change of peach fruits harvested at two maturity
值得注意的是,无论低或高成熟度果实还是1-MCP 处理与否,贮藏期间桃果实中的MDA 含量和电导率变化保持一致,表明膜脂过氧化与细胞膜通透性存在相关性,与Huan 等[22]的研究结果一致,且1-MCP 处理果实在保持低成熟度果实细胞正常形态方面具有更好的效果。
2.4 1-MCP 处理对桃果实超氧化物歧化酶(SOD)和过氧化物酶(POD)活性的影响
SOD 活性可以直观地反映果实受到氧化的程度[23]。由图7 可知,贮藏期间四组果实SOD 活性均有不同程度的上升。低成熟度处理组相较于其对照组明显延后并减缓了SOD 活性的升高,在整个贮藏期间呈现先下降后上升的趋势;高成熟度桃果实中,对照和处理果实SOD 活性在整个贮藏期间无显著差异(P>0.05),贮藏第6 d 两组果实SOD 活性分别为0.95 U·g−1FW 和0.92 U·g−1FW。表明1-MCP 对低成熟度桃果实SOD 活性影响显著,而对高成熟度果实贮藏全过程影响较小。
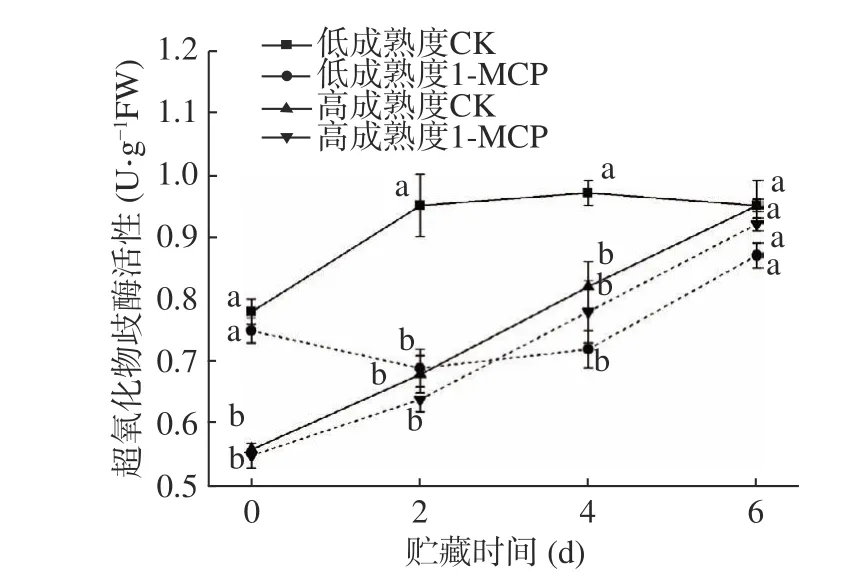
图7 1-MCP 处理对两种不同成熟度果实超氧化物歧化酶活性变化的影响Fig.7 Effect of 1-MCP treatment on SOD activity change of peach fruits harvested at two maturity
植物体中含有大量活性较高的过氧化物酶,其与植物的呼吸作用、光合作用及生长素的代谢等都有密切关系,可作为组织成熟衰老的一个重要指标[24]。图8 显示,贮藏前期四组果实POD 活性均处于较低水平,随着贮藏的推进,各组POD 活性上升,在贮藏第6 d,两成熟度处理组果实POD 活性均显著低于各自对照组,但两处理组之间活性并未出现显著差异。
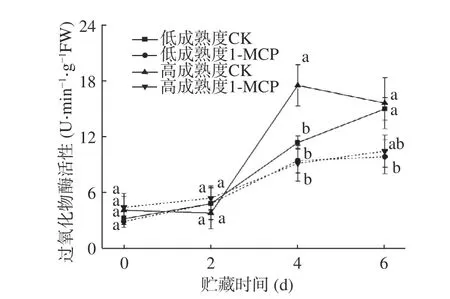
图8 1-MCP 处理对两种不同成熟度果实过氧化物酶活性变化的影响Fig.8 Effect of 1-MCP treatment on POD activity change of peach fruits harvested at two maturity
氧化酶系活性变化在植物成熟衰老期间起到非常最重要的作用,随着贮藏的进行,SOD 和POD 活性总体呈上升趋势,1-MCP 可以减缓低成熟度果实在贮藏前期氧化酶活快速上升,说明1-MCP 处理可以降低果实受氧化程度,延缓果实衰老。
2.5 1-MCP 处理对桃果实还原型抗坏血酸(RASA)和还原性谷胱甘肽(RGSH)含量的影响
果实中抗坏血酸的氧化型和还原型含量多少及比例可反映果实成熟衰老过程中被氧化的程度。由图9 得知,除贮藏前两天的低成熟度果实,RASA 含量总体呈下降趋势,RASA 积累速度大于氧化分解速度,贮藏第2 d,对照果实和处理果实RASA 含量达到最大值。贮藏中后期,果实逐步走向衰老,内部生理代谢与外界环境加速RASA 的氧化分解;高成熟度桃果实中,两组果实的RASA 含量在整个贮藏过程呈下降趋势,且至贮藏后期含量无显著差异(P>0.05)。以上结果表明,1-MCP 能够有效延缓桃果实RASA 含量的下降,以贮藏前期作用效果更为显著。

图9 1-MCP 处理对两种不同成熟度果实还原型抗坏血酸变化的影响Fig.9 Effect of 1-MCP treatment on ASA change of peach fruits harvested at two maturity
与抗坏血酸类似,谷胱甘肽在果实内部存在的两种形态也会进行转化。两成熟度桃果实RGSH 变化趋势与RASA 相似(图10),其中低成熟度果实RGSH 第2 d 出现最大值,且以1-MCP 处理的为高(28.71 μg·g−1FW,比对照多61.80%),贮藏后期明显降低;两组高成熟度桃果实贮藏期间RGSH 含量呈下降趋势,贮藏前中期下降幅度较大,后期逐渐趋于稳定。不管是低还是高成熟度果实,1-MCP 处理都能使桃果实保持较高的RGSH 含量[25]。

图10 1-MCP 处理对两种不同成熟度果实还原型谷胱甘肽变化的影响Fig.10 Effect of 1-MCP treatment on GSH change of peach fruits harvested at two maturity
1-MCP 处理可以有效保持桃果实的还原型RGSH 含量,表明1-MCP 能调节氧化还原代谢,维持细胞正常代谢,进而调节果实成熟衰老进程,这与1-MCP 作用当前研究结果相符[26]。
2.6 1-MCP 处理对桃果实原果胶和聚半乳糖醛酸酶(PG)活性的影响
原果胶在贮藏期间受到果胶酶、果胶甲酯酶和纤维素酶的共同作用,转变为可溶性果胶,是导致果实成熟期硬度下降的主要原因[27]。如图11 所示,贮藏期间两种成熟度果实原果胶含量变化趋势一致,在贮藏中期,PG 活性增强,原果胶含量快速下降,表现为果实硬度急剧降低;贮藏第6 d 时,两种成熟度处理果实原果胶含量分别为同期对照组的1.88 倍和1.14 倍。结果表明,1-MCP 对果胶成分的转变具有抑制效果,可以减缓原果胶向可溶性果胶的转变,其中以低成熟度果实作用效果更为明显。
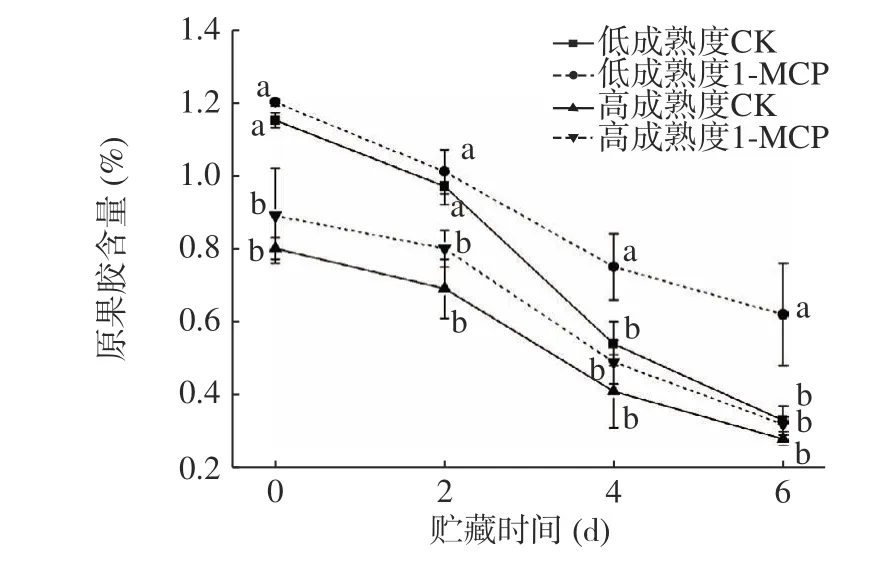
图11 1-MCP 处理对两种不同成熟度果实原果胶变化的影响Fig.11 Effect of 1-MCP treatment on protopectin change of peach fruits harvested at two maturity
果胶水解过程中,聚半乳糖醛酸酶可以催化果胶中的聚甲基半乳糖醛酸残基水解,将细胞间层和细胞壁中的原果胶转变为可溶性果胶。从图12 可以看出,果实贮藏前期PG 活性较低;随着贮藏进行,PG 活性出现最大值,两处理组在第4 d PG 活性较同期对照组分别降低了25.75%和7.44%。可以得出,PG 对桃果实内果胶的水解作用主要发生在贮藏中后期,与本实验中原果胶含量下降速率变化保持一致,其中1-MCP 处理低成熟度果实抑制PG 活性效果明显好于高成熟度果实。
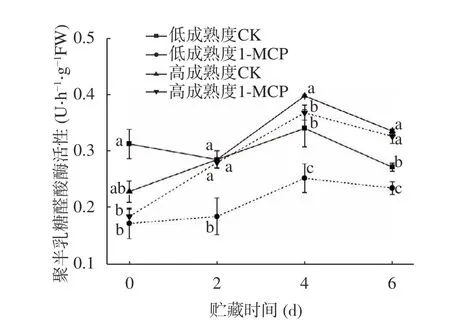
图12 1-MCP 处理对两种不同成熟度果实聚半乳糖醛酸酶活性变化的影响Fig.12 Effect of 1-MCP treatment on PG activity change of peach fruits harvested at two maturity
在果实成熟衰老过程中,果胶形态的转变与果实硬度存在密切关联,对比1-MCP 对两种成熟度桃果实贮藏期间原果胶、PG 活性和硬度的变化影响可知,其作用效果保持一致,且以处理低成熟度果实效果为佳。1-MCP 对于果实贮藏期间原果胶向可溶性果胶的转变具有延缓作用,同时可以抑制PG 活性的提升,对于维持桃果实硬度和组织细胞完整性存在关键作用[28]。
2.7 1-MCP 处理对桃果实琥珀酸脱氢酶(SDH)和细胞色素氧化酶(CCO)活性的影响
位于线粒体内膜、连接电子传递和氧化磷酸化的SDH 是反映细胞呼吸功能的一种标志酶,其活性可作为TCA 循环进行程度的重要指标[29]。由图13可知,不论是低成熟度还是高成熟度桃果实,SDH 活性均呈下降趋势,1-MCP 处理果实在贮藏前中期SDH 活性显著高于对照组,而在贮藏末期,处理和对照组低成熟度果实SDH 活性无显著差异(P>0.05)。结果显示,1-MCP 可以通过维持胞内高水平SDH 活性,稳定呼吸链的电子传递,更好地保持TCA 循环效率,其中以高成熟度果实处理效果更显著。
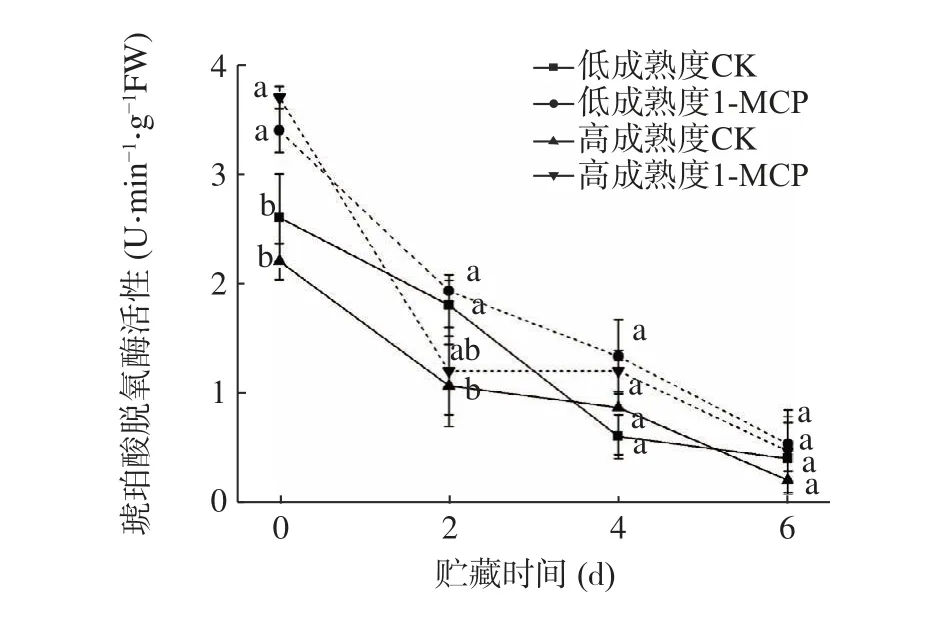
图13 1-MCP 处理对两种不同成熟度果实琥珀酸脱氢酶活性变化的影响Fig.13 Effect of 1-MCP treatment on SDH activity change of peach fruits harvested at two maturity
CCO 处于电子传递链末端,具有质子泵的作用,与ATP 合成具有密切联系,较高的CCO 活性有利于ATP 生成[30]。图14 显示,两种成熟度桃果实CCO活性在前期快速下降,并在后续贮藏过程中相对稳定。值得注意的是,1-MCP 处理过后的CCO 活性多高于对照,且1-MCP 对于高成熟度桃果实CCO 活性的保持具有更明显的效果,尤其是在贮藏后期,果实CCO 活性增强,有利于TCA 循环ATP 的生成。

图14 1-MCP 处理对两种不同成熟度果实细胞色素氧化酶活性变化的影响Fig.14 Effect of 1-MCP treatment on CCO activity change of peach fruits harvested at two maturity
TCA 循环是高等植物呼吸过程中的主要阶段,也是植物能量获取的重要来源。SDH 将琥珀酸催化成延胡索酸,释放H+的同时生成ATP,而CCO 能够通过电子传递,为氧化磷酸化提供能量。SDH 和CCO 活性直接影响呼吸链和TCA 循环的顺利进行,在贮藏后期,低成熟度1-MCP 处理桃果实SDH 活性下降得到延缓,CCO 活性上升,细胞防御能力增强,能量生成和呼吸链效率得到提高,与本实验研究贮藏后期呼吸速率出现高峰相符。表明1-MCP 处理可以促进呼吸高峰产生,对于细胞电子传递和能量代谢的正常进行具有重要推动作用[31]。
3 讨论与结论
1-MCP 是一种竞争性乙烯结合受体,其能够抑制乙烯与其受体的正常结合,达到阻断乙烯信号传导的效果,而采后果实的成熟衰老,与其自身释放的内源乙烯作用密切相关[32]。乙烯信号的正常传递与否,决定果实硬度、色泽、香气等表观特性;细胞呼吸链效率和氧化酶系活性以及营养成分的积累,从而影响果实的贮藏时间和生理品质[33]。
由于果实的成熟衰老,桃果实组织细胞膜脂受到氧化,磷脂双分子层通透性提高,果胶酶活性上升,胞间原果胶被逐步水解为可溶性果胶,导致细胞粘合程度降低,整体结构松散,果实硬度急剧下降,大量研究显示[34−35],经1-MCP 处理后较高成熟度桃果实在硬度、PG 活性等方面具有更显著的保鲜效果。同时,细胞膜受到氧化破坏导致细胞外液中电解质含量提高,果实原本正常代谢平衡受到打破,致使EL 和MDA 含量在果实贮藏后期提高,呈现一致快速上升趋势。本实验结果表明,1-MCP 对于细胞膜结构具有一定的维持作用,可以明显降低两种成熟度桃果实贮藏后期EL 水平以及低成熟度MDA 含量,与Wang 等[36]研究结果一致。除此之外,果实自身氧化程度的加深不仅会对细胞膜结构产生改变,还会影响抗坏血酸、谷胱甘肽等营养物质从还原态向氧化态发生转变,而营养物质形态的转变,一般要早于细胞膜结构的氧化,往往在果实成熟初期就开始发生。在本研究中发现,使用1-MCP 处理能够显著延缓两种成熟度果实还原型营养物质在贮藏前中期的快速降低,延缓细胞膜脂的氧化,降低果实自身代谢有害物质的积累,为不同成熟度水蜜桃果实贮藏期间营养成分的保持提供理论依据,从营养价值角度维持了果实的商品性,并证明1-MCP 对桃果实贮藏保鲜有积极调控效果。
10 μL/L 1-MCP 对两种成熟度‘霞晖8 号’桃果实品质和生理生化特性变化影响的结果显示:1-MCP 处理桃果实作用大小与成熟度有关,以低成熟度果实作用更为明显;1-MCP 对桃果实品质和生理生化特性变化的影响指标间存在差异,以硬度和原果胶含量影响显著。1-MCP 处理延缓桃果实成熟主要表现在降低了果实MDA 含量、减少了电导率增加、抑制了乙烯释放和呼吸作用、维持了果实硬度和原果胶含量、降低了多聚半乳糖醛酸酶活性、抑制了氧化酶系SOD 和POD 活性、保持了较高的还原型ASA 和GSH 含量、延缓了呼吸链中SDH 和CCO活性的降低等方面;整体上看,1-MCP 处理‘霞晖8 号’桃果实以较低成熟度效果更好。以上的研究结果对1-MCP 应用于桃果实的保鲜具有参考作用。

