双菌微囊化发酵耦合泡沫分离强化乳链菌肽生产的工艺
周静萍,刘 伟,杨春燕,殷 昊,卢 珂
(河北工业大学化工学院,天津 300131)
随着食品安全问题的日益加剧,天然、安全的生物防腐剂备受人们的青睐。乳链菌肽(C143H228N42O37S7,Nisin),是由乳酸链球菌亚种(Lactococcus lactissubsp.lactis)中某些菌株分泌的一种羊毛硫细菌素,是目前联合国粮食和农业组织/世界卫生组织(FAO/WHO)唯一批准使用的天然食品防腐剂[1]。Nisin 能够强烈抑制革兰氏阳性菌的生长,并有效阻止孢子萌发及毒素的形成[2]。但由于Nisin 的发酵生产存在产能不足、产率低、碳源成本高等问题,严重制约了Nisin 的工业应用[3]。
近年来,国内外研究者在Nisin 高产菌株选育[4]、培养基优化[5]、发酵条件控制[6]及发酵方式开发[7]等方面进行了大量研究。例如:高艳飞等[8]以葡萄糖部分替代蔗糖优化Nisin 发酵培养基,大幅降低碳源成本的同时,Nisin 效价达到了以蔗糖为单一碳源的水平。Subha 等[9]将乳酸链球菌包埋于海藻酸钠胶粒中,并将其用于连续发酵,Nisin 产量较分批发酵提高了4 倍。然而,以上研究并没有解决发酵过程中Nisin 对产生菌生长及自身合成的反馈抑制问题[10]。酸性条件下,Nisin 分子通过静电作用吸附在产生菌细胞膜表面,其疏水侧链插入到膜内并与磷脂结合,使细胞膜发生去极化,小分子代谢物(如氨基酸、ATP 等)快速外泄造成膜内外能差消失,引起细胞自溶[11]。因此,发酵过程中及时移除Nisin 对于进一步提高产量具有重要意义。
Nisin 的分离方法主要有盐析法、凝胶过滤色谱法、树脂吸附法和水相两相法[12−15]等。但上述方法很难与发酵过程耦合,实现原位分离Nisin。泡沫分离是一种以气泡为介质的界面吸附分离技术,具有设备简单、操作条件温和、易放大和环境友好等优点。近年来,泡沫分离技术与微生物发酵过程耦合强化生物表面活性素(如鼠李糖脂和脂肽)生产引起了研究者们的广泛兴趣[16−17]。但发酵-泡沫分离耦合技术应用于工业生产Nisin 面临着以下技术瓶颈:(1)泡沫分离能够有效富集Nisin,但副产物乳酸的大量积累导致发酵液pH 降低,酸胁迫会增强H+-ATPase 活性,从而抑制菌体细胞的生长和繁殖[18];(2)泡沫对菌体细胞具有夹带作用,且气泡聚并产生的剪切力会引起细胞损伤,不利于高密度发酵[19]。
Nisin 的工业生产通常采用补料分批发酵和pH 控制发酵方式,将发酵液中乳酸的浓度维持在毒性水平以下[20−21]。但由于高渗透压和酸性阴离子的存在,这些方法的生产效率较低。虽然双水相体系和树脂吸附法能够从发酵液中原位回收乳酸,但是有机试剂会对菌体细胞造成不可逆损害[22−23]。基于微生物群体感应效应,在培养基中共培养特定菌株来改善发酵环境的研究受到人们的广泛关注[24]。Hamedi 等[25]提出将解脂耶氏酵母(以乳酸为碳源)和乳酸链球菌混合发酵来提高Nisin 产量,但解脂耶氏酵母会大量分泌有机酸,发酵液依然存在酸化问题。为了避免泡沫夹带菌体细胞,Cui 等[26]设计了一种新型发酵-泡沫分离耦合装置,利用0.45 μm的混合纤维膜来阻断菌体细胞与气泡的接触,但Nisin 的分离效率较低。细胞固定化是通过化学或物理方法把游离态细胞定位在一个固定的区域内,并有效保持细胞活性的技术[27]。Gao 等[28]以κ-卡拉胶为包埋载体,制备了乳酸链球菌固芯凝胶颗粒,并将其负载于丝瓜络的孔道结构中,进行发酵-泡沫分离耦合连续生产Nisin。由于凝胶颗粒的空间位阻限制了细胞生长和物质扩散,有害代谢产物会加速菌体细胞衰老或自溶,Nisin 的单批次产量远远低于游离细胞发酵。微胶囊是一种新兴的细胞固定化方法,其内部液芯环境可以为细胞提供生长空间,并且囊膜允许双向扩散营养物质和代谢产物,有助于实现高密度发酵[29]。微胶囊固定细胞的关键在于选择适宜的制备材料,其应符合以下条件:(1)成膜材料中至少有一种聚合物;(2)聚合物带有电荷或通过调节pH 而带有电荷,以便发生凝聚成膜反应;(3)成膜材料应具有良好的生物相容性;(4)材料易得,生物稳定性好,界面反应条件温和,界面凝聚反应迅速[30]。海藻酸盐、壳聚糖、淀粉和琼脂等天然多糖是常用的囊材。
基于以上研究,本文拟采用能够代谢乳酸的酿酒酵母为辅助菌与乳酸链球菌进行共培养,并对双菌进行微胶囊固定化,构建发酵与泡沫分离耦合系统强化Nisin 生产。首先,建立乳酸链球菌与酿酒酵母共培养发酵体系,并对发酵条件进行优化。随后,优化了海藻酸钠-壳聚糖-海藻酸钠(ACA)液芯微胶囊制备条件。最后,以富集比、回收率和Nisin 总效价为评价指标,研究发酵和泡沫分离耦合时间,气泡尺寸及气体体积流率对Nisin 回收效率的影响。
1 材料与方法
1.1 材料与仪器
乳酸链球菌(Lactococcus lactissubsp.lactisATCC 11454)、酿酒酵母(Saccharomyces cerevisiaeW303-1A)、和藤黄八叠球菌(Micrococcus luteusNCIB 8166) 均由河北工业大学生物工程系菌种保藏室提供,并于4 ℃进行低温保存;蛋白胨生物试剂、酵母浸粉生物试剂 北京奥博星生物技术有限公司;乳糖、蔗糖、葡萄糖 分析纯,天津市风船化学试剂厂科技有限公司;壳聚糖、海藻酸钠、柠檬酸钠、KH2PO4、NaCl、MgSO4·7H2O、Na2HPO4分析纯,天津市登峰化学试剂厂。
752N 紫外可见光分光光度计 上海精密科学仪器有限公司;BKQ-Z30I 高压蒸汽灭菌锅 山东博科生物产业有限公司;Agilent 1100 高效液相色谱仪美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 培养基的制备 酿酒酵母种子培养基:蛋白胨2.0 g/L,酵母浸粉1.0 g/L,葡萄糖2.0 g/L,自然pH。121 ℃下高压蒸汽灭菌20 min[31]。
乳酸链球菌种子培养基:蛋白胨15 g/L,酵母浸粉15 g/L,蔗糖15 g/L,NaH2PO420 g/L,NaCl 2.0 g/L,MgSO4·7H2O 0.2 g/L,pH 为6.9。121 ℃下高压蒸汽灭菌20 min[32]。
共培养发酵培养基:蛋白胨15.0 g/L,酵母浸粉15.0 g/L,KH2PO415.0 g/L,NaCl 2.0 g/L,MgSO4·7H2O 0.2 g/L,4.0%碳源;初始pH 为6.9。121 ℃下高压蒸汽灭菌20 min。
效价检测SI 培养基:葡萄糖5.0 g/L,胰蛋白胨8.0 g/L,NaCl 5.0 g/L,酵母浸粉3.0 g/L,Na2HPO42.0 g/L,Tween 20 5.0 mL/L,琼脂10.0 g/L,pH 为7.2。121 ℃下高压蒸汽灭菌20 min[32]。
1.2.2 共培养可行性探究实验
1.2.2.1 共培养发酵和纯培养发酵 将乳酸链球菌种子液和酿酒酵母种子液分别以3%(v/v)的接种量转接至发酵培养基中,于150 r/min,30 ℃条件下进行共培养发酵,分别以相同接种量的乳酸链球菌和酿酒酵母的纯培养(单一菌体)发酵液作为对照组;每3 h 取样一次,并于600 nm 条件下测定发酵液吸光值。
1.2.2.2 生物量检测 采用分光光度法于600 nm 处测量样品的吸光值(OD600),通过绘制出乳酸链球菌和酿酒酵母纯培养和共培养发酵的生长曲线,来确定菌体生物量。采用平板计数法测定乳酸链球菌和酿酒酵母的活细胞浓度[33],分别取乳酸链球菌和酿酒酵母单一培养种子液,通过磷酸盐缓冲溶液进行梯度稀释,每个梯度均稀释10 倍,随后分别添加5 mg/L环己酰亚胺(抑制酿酒酵母生长)和5 mg/L 链霉素(抑制乳酸链球菌生长)的选择性培养基上进行均匀涂布,30 ℃培养36 h,分别测定乳酸链球菌种子液和酿酒酵母种子液的活细胞浓度(CFU/mL)。
1.2.3 共培养发酵条件的选择
1.2.3.1 碳源筛选 为了研究碳源对乳酸链球菌与酿酒酵母共培养发酵生产Nisin 的影响,将乳酸链球菌种子液和酿酒酵母种子液分别按照3%(v/v)的接种量转接入不同碳源(4%葡萄糖、4%乳糖和4%蔗糖)的乳酸链球菌发酵培养基中进行分批培养,并于30 ℃、150 r/min 下共培养发酵24 h,分别测定发酵液的Nisin 效价和pH。
1.2.3.2 接种比例的筛选 选定乳酸链球菌与酿酒酵 母 的 初 始 接 种 比 例 为10−1:1、100:1、101:1、102:1、103:1、104:1,固定酿酒酵母的接种量为3%,于150 r/min,30 ℃条件下培养24 h。发酵结束后,分别取样测定发酵液的Nisin 效价。
1.2.3.3 Nisin 效价测定 本研究采用改良的双剂量琼脂扩散法测定Nisin 效价[30]。将含检测菌的SI 培养基倒入无菌培养皿中,并于4 ℃储藏30 min,然后用7 mm 的无菌空心打孔器在凝固的琼脂上打孔。将Nisin 标准液和样品注入孔中(每孔135 μL),置于生化培养箱中35 ℃培养24 h,用计算机辅助设计软件(Auto CAD)测量抑菌区直径,并根据抑菌区直径和Nisin 标准品的效价计算出样品溶液的效价。
1.2.4 ACA 液芯微胶囊细胞固定化条件选择
1.2.4.1 固定化工艺 取乳酸链球菌种子液和酿酒酵母种子液按照一定接种比例混合,于6000 r/min和4 ℃条件下离心10 min,保留菌泥。随后,将乳酸链球菌与酿酒酵母的菌悬液按照体积比10:1 与海藻酸钠溶液均匀混合。以5.0 mL/min 速率将该混合溶液滴加到20.0 g/L CaCl2溶液中,固化2 h,用无菌水反复冲洗,得到双菌共固定的海藻酸钙凝胶珠。将其置于壳聚糖溶液(pH 5.5)中覆盖壳聚糖膜,制得双菌共固定的海藻酸钙-壳聚糖固芯微胶囊。海藻酸钙与壳聚糖的静电聚合反应如图1 所示。在0.05%海藻酸钠溶液在微胶囊表面覆膜一定时间后,用0.50 g/L 柠檬酸钠溶液对固芯微胶囊进行液化,制得双菌共固定化的海藻酸钠-壳聚糖-海藻酸钙液芯微胶囊。
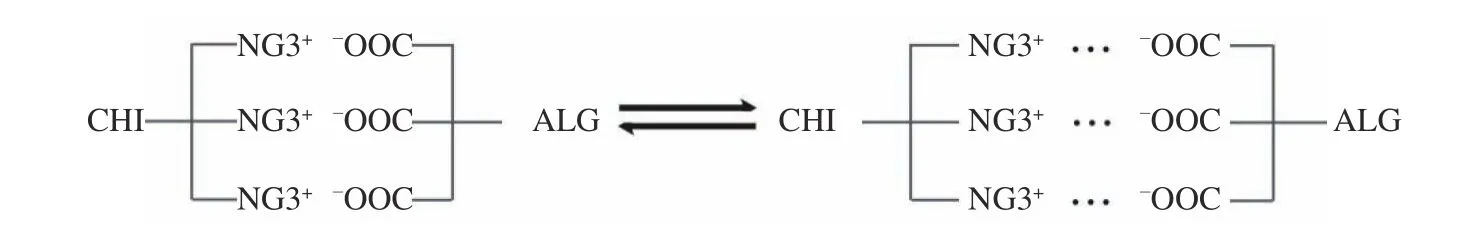
图1 海藻酸钙的羧基与壳聚糖的氨基静电作用示意图Fig.1 Electrostatic interaction between the carboxyl of sodium alginate and amino of chitosan
1.2.4.2 海藻酸钠浓度的选择 为了探究海藻酸钠浓度对双菌共固定微胶囊的影响,分别用9、12、15、18、21 g/L 的海藻酸钠溶液制备ACA液芯微胶囊,并以Nisin 效价和发酵液菌体浓度为指标对微胶囊性能进行评价。
1.2.4.3 壳聚糖浓度的选择 分别用4.5、5.0、5.5、6.0、6.5 g/L 的壳聚糖溶液对海藻酸钙凝胶珠进行覆膜,制备双菌共固定ACA 液芯微胶囊,并以Nisin 效价和发酵液菌体浓度为指标对微胶囊性能进行评价。
1.2.5 微胶囊固定细胞发酵耦合泡沫分离生产Nisin条件选择
1.2.5.1 生产工艺 微胶囊固定细胞发酵-泡沫分离耦合装置如图2 所示,泡沫分离塔由高度600 mm、内径40 mm 的有机玻璃管制成,与1.5 L 的发酵罐衔接在一起。在塔底安装烧结玻璃制成的气体分布器,气体体积流率通过气体转子流量计进行调节。首先,将800 mL 灭菌后的发酵培养基装入发酵罐。随后,乳酸链球菌和酿酒酵母按一定比例接种到共培养发酵培养基中,30 ℃条件下培养一段时间。发酵-泡沫分离耦合操作开始后,将无菌空气泵入泡沫分离塔产生气泡。泡沫通过塔顶的倒L 形末端流入收集器中,并采用机械搅拌进行消泡。
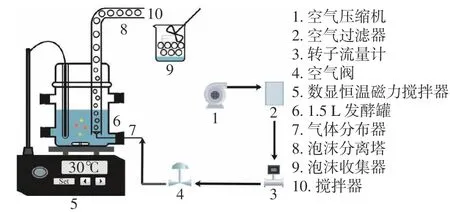
图2 固定化微囊发酵-泡沫分离耦合装置Fig.2 Immobilized fermentation-foam fractionation containing microcapsules coupling device
1.2.5.2 耦合时间的筛选 发酵温度为30 ℃、分布器孔径为180 μm、气体体积流率为60 mL/min,以富集比、回收率为评价指标,在发酵18~27 h 期间,探究耦合时间对Nisin 分离效率的影响。
1.2.5.3 分布器孔径的筛选 发酵温度为30 ℃、耦合时间为发酵24 h、气体体积流率为60 mL/min,以富集比、回收率为评价指标,探究分布器孔径(125、150、180、250 和425 μm)对发酵液中Nisin 分离效率的影响。
1.2.5.4 气体体积流率的筛选 发酵温度为30 ℃、耦合时间为发酵24 h、分布器为180 μm,以富集比、回收率为评价指标,探究气体体积流率(20~120 mL/min)对发酵液中Nisin 分离效率的影响。
1.2.5.5 评价指标的测定 Nisin 的分离效率可通过富集比(E)和回收率(R,%)来评价,如式(1)和式(2)所示。
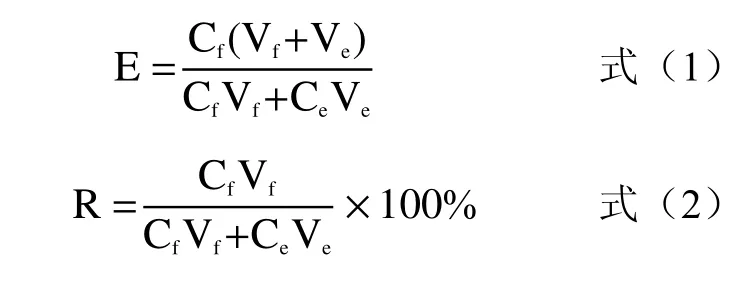
式中,Cf和Ce分别为消泡液和残余发酵液中Nisin 的效价,IU/mL;Vf和Ve分别为消泡液和残余发酵液的体积,mL。
1.3 数据分析
每组实验重复3 次,并通过Origin 和Auto CAD软件进行数据处理和分析。
2 结果与分析
2.1 乳酸链球菌与酿酒酵母共培养的可行性研究
如图3 所示,乳酸链球菌与酿酒酵母共培养发酵液的生物量明显高于这两种菌的纯培养。纯培养发酵条件下,乳酸链球菌生长迅速,快速进入指数期,但20 h 后生物量呈现下降趋势;而酿酒酵母生长较为缓慢,20 h 后开始进入指数期。发酵液初始pH 明显高于酿酒酵母的最适pH4.0[34],所以在纯培养发酵过程中酿酒酵母生长缓慢。共培养发酵条件下,乳酸链球菌分泌的有机酸会引起发酵液酸化,从而为酿酒酵母的生长提供了条件[35]。此外,已有研究表明乳酸菌和酵母菌之间存在营养促进作用,乳酸菌会刺激酵母菌生长并分泌氨基酸(如缬氨酸、亮氨酸)和维生素B6,进一步促进乳酸菌的生长繁殖和代谢过程[36],所以共培养发酵液的生物量明显高于乳酸链球菌的纯培养,且稳定期延长。因此,乳酸链球菌与酿酒酵母之间存在互利共生作用,可以进行共培养发酵。

图3 乳酸链球菌和酿酒酵母的共培养和纯培养生长曲线Fig.3 The growth curves of Lactococcu slactiss ubsp.lactis and Saccharomyces cerevisiae in pure cultivation and co-cultivation
2.2 共培养碳源筛选
由图4 可知,以4%乳糖为碳源时,Nisin 效价和发酵液pH 均为最高,分别为3162.3 IU/mL 和5.27;以4%蔗糖和4%葡萄糖为碳源时,Nisin 效价十分接近。酿酒酵母不能代谢乳糖,仅能够以乳酸链球菌代谢的副产物乳酸为碳源[37],从而解除乳酸链球菌发酵的pH 抑制,促进其生长代谢和Nisin 合成,因此乳糖培养基中Nisin 效价和pH 最高。然而,酿酒酵母和乳酸链球菌均可代谢葡萄糖和蔗糖生成乳酸,导致发酵液的pH 迅速降低,从而抑制Nisin 的生物合成。所以,4%葡萄糖发酵液和4%蔗糖发酵液的Nisin 效价和pH 明显低于4%乳糖发酵液。因此,为了提高Nisin 产量,本研究选择4%乳糖作为共培养发酵的底物碳源。
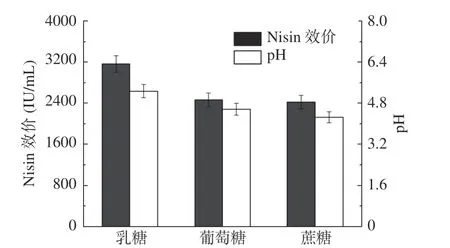
图4 碳源类型对Nisin 效价和发酵液pH 的影响Fig.4 Effects of carbon source type on Nisin titer and pH of fermentation broth
2.3 乳酸链球菌与酿酒酵母的最佳接种比例
如图5 所示,随着乳酸链球菌与酿酒酵母接种比例的升高,Nisin 效价呈现先增加后降低的变化趋势,pH 呈现逐渐降低的趋势。随着乳酸链球菌与酿酒酵母初始接种比例从10−1:1 增加到102:1 时,乳酸链球菌接种的初始细胞浓度逐渐增加,细胞生长和代谢速度加快,促进了Nisin 的快速合成。乳酸链球菌与酿酒酵母初始接种比例从102:1 增加到104:1 时,由于乳酸链球菌初始接种的细胞浓度较高,酿酒酵母不能完全吸收其分泌的有机酸,培养基酸化降低了乳酸链球菌细胞内酶的活性及其对营养物质的利用速率,从而降低了Nisin 的合成速率。因此,本研究中乳酸链球菌与酿酒酵母的最佳接种比例为102:1。
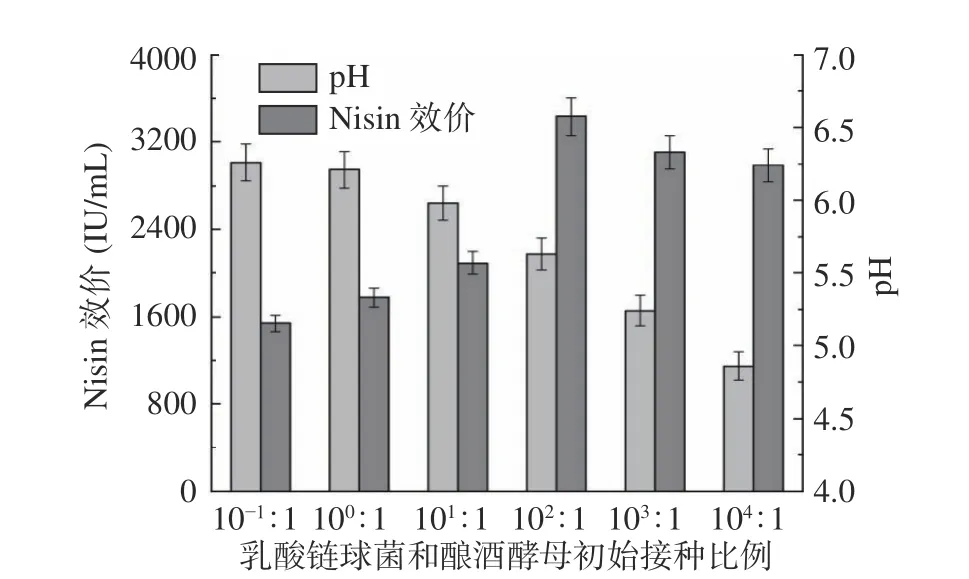
图5 乳酸链球菌与酿酒酵母接种比例对Nisin 效价的影响Fig.5 Effects of inoculation ratio of L. lactis and S. cerevisiae on Nisin titer
2.4 ACA 液芯微胶囊细胞固定化条件优化
2.4.1 海藻酸钠浓度的确定 如图6 所示,海藻酸钠浓度从9 g/L 增加到15 g/L 时,Nisin 效价缓慢降低;而海藻酸钠浓度从15 g/L 增加到21 g/L 时,Nisin效价迅速下降。海藻酸钠浓度从9 g/L 增加到15 g/L时,发酵液中菌体生物量明显下降;海藻酸钠浓度从15 g/L 增加到21 g/L 时,发酵液中菌体生物量平缓下降。海藻酸钠浓度从9 g/L 增加到15 g/L 时,海藻酸钠的-COO-和Ca2+逐渐结合充分,微胶囊壁膜的致密性和机械强度增加,发酵过程中剪切作用导致囊膜破裂,菌体细胞泄漏情况减少[38],因此,发酵液中的菌体生物量明显下降,Nisin 效价缓慢降低。当海藻酸钠浓度高于15 g/L 时,过高的海藻酸钠浓度会引起溶液粘度增加,阻碍Ca2+的移动,限制其与-COO-的结合,造成微胶囊内所含活菌数下降,进一步影响Nisin 的合成与传质,因此,发酵液中的菌体生物量降低,Nisin 效价变化明显。综合考虑微囊固定化效果和Nisin 效价,选择15 g/L 的海藻酸钠浓度制作乳酸链球菌与酿酒酵母的固定化微胶囊。

图6 海藻酸钠浓度对Nisin 效价和生物量的影响Fig.6 Effect of sodium alginate concentration on Nisin titer and biomass
2.4.2 壳聚糖浓度的确定 如图7 所示,壳聚糖浓度从4.5 g/L 增加到5.5 g/L,Nisin 效价缓慢下降,发酵液中菌体生物量迅速下降。这是因为壳聚糖浓度越高,溶液中活泼氨基的数量越大,与海藻酸钠分子中的-COO-发生交联反应形成的半透膜致密程度越高,微胶囊壁膜的稳定性和支撑作用越高[10],对Nisin 的传质效果影响较小。壳聚糖浓度从5.5 g/L 增加到6.5 g/L,Nisin 效价下降速度增加,发酵液中菌体生物量缓慢降低。这是由于过高的壳聚糖浓度会引起半透膜的渗透性降低,直接影响到营养物质和发酵产物在囊膜两侧的传递,不利于菌体细胞的生长和代谢。综合考虑微胶囊传质性能和Nisin 效价,选择5.5 g/L的壳聚糖浓度制作乳酸链球菌与酿酒酵母的固定化液芯微胶囊。

图7 壳聚糖浓度对Nisin 效价和生物量的影响Fig.7 Effects of chitosan concentration on Nisin titer and biomass
2.5 发酵-泡沫分离耦合生产Nisin 的工艺研究
2.5.1 耦合时间对Nisin 分离效率的影响 如图8(A)所示,随着耦合时间从18 h 增加到27 h,发酵液中Nisin 的效价呈现先增加后降低的趋势,在耦合24 h 效价最高。随着泡沫分离耦合微胶囊固定细胞耦合的起始时间越晚,Nisin 富集比先从4.7 下降到3.2,随后增加至3.8;而其回收率先从61.2%增加至78.9%,然后下降到65.3 %。这是由于气体鼓入发酵罐后,发酵液中Nisin 效价越高,Nisin 在气泡表面的表面过剩越高,增加了气泡表面液膜厚度和持液能力,从而提高泡沫的持液率和稳定性[39]。泡沫夹带大量间隙液进入消泡液,Nisin 的富集比降低,回收率增加。
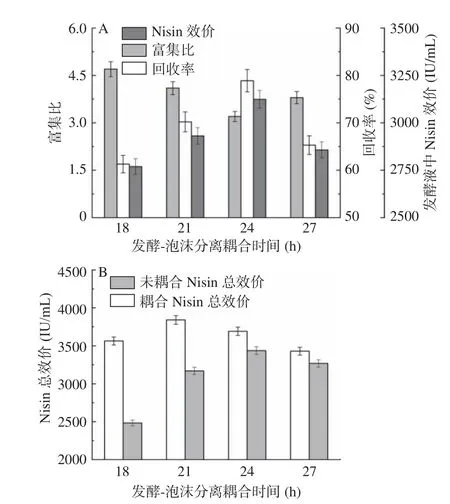
图8 发酵-泡沫分离耦合时间对Nisin 的富集比/回收率和总效价的影响Fig.8 Effects of initial coupling time of fermentation and foam fractionationon enrichment ratio and recovery percentage of Nisin and total titer of Nisin
由图8(B)所示,在任意耦合时间条件下,微胶囊固定细胞发酵-泡沫分离耦合操作Nisin 总效价均高于非耦合操作。并且在发酵21 h 后进行泡沫分离耦合操作时,发酵液中Nisin 总效价最高,为3824.7 IU/mL。当泡沫分离较早耦合于微胶囊固定细胞发酵时,气泡会将大量营养物质带离培养基,导致菌体细胞对底物基质的利用率降低,Nisin 的合成速率缓慢[40]。当泡沫分离耦合于微胶囊固定细胞发酵的起始时间较晚时,Nisin 在发酵液中的积累会对菌体细胞产生产物抑制,抑制其自身的合成。综合以上分析,可在微胶囊固定细胞发酵21 h 进行发酵-泡沫分离耦合操作回收Nisin。
2.5.2 分布器孔径对Nisin 分离效率的影响 如图9所示,随着气体分布器孔径从125 μm 增大到425 μm,Nisin 富集比由4.3 增大至6.9,其回收率由79.1%下降到48.9%;Nisin 总效价由3452.1 IU/mL 增加到4113.2 IU/mL。气体分布器的孔径越大,液相中气泡的初始尺寸越大[41]。小尺寸气泡在液相中上升速度慢,有利于Nisin 分子吸附在气泡表面,增大气泡周围液膜的厚度,所形成的泡沫稳定性越强,将大量发酵液夹带出发酵体系,不利于菌体细胞的生长代谢。与小气泡相比,大气泡界面能更低,气泡之间聚结和歧化作用会降低泡沫稳定性,导致发酵液夹带能力差,营养物质损失少。因此,随着气体分布器孔径的增加,Nisin 的富集比增加,回收率降低,总效价增加。综合考虑Nisin 的富集比、回收率以及总效价,选择孔径为180 μm 的气体分布器进行发酵-泡沫分离耦合操作。
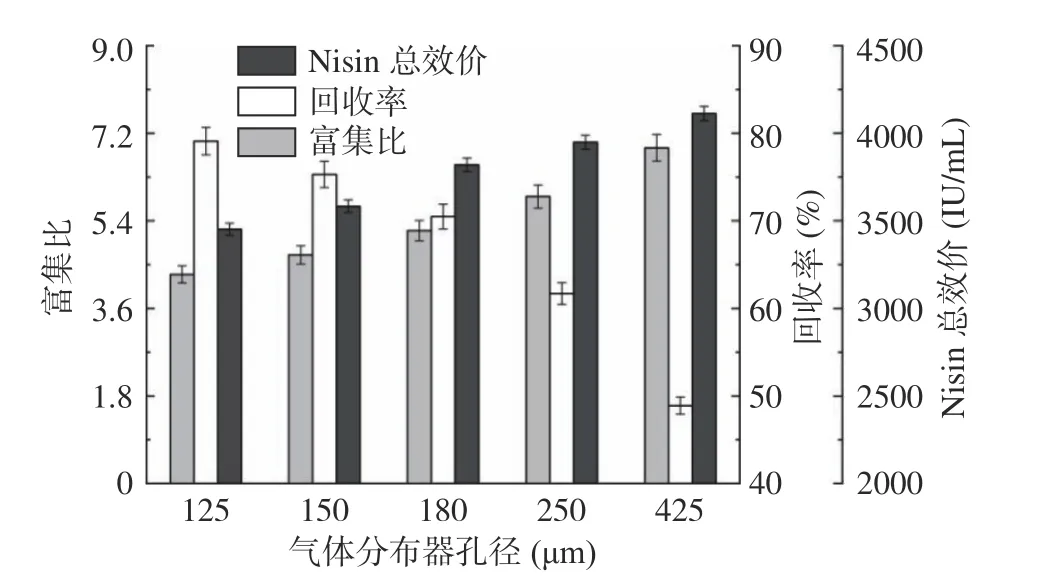
图9 气体分布器孔径对Nisin 的富集比、回收率和总效价的影响Fig.9 Effects of pore diameter of gas distributor on enrichment ratio andrecovery percentage of Nisin, and total titer of Nisin
2.5.3 气体体积流率对Nisin 分离效率的影响 如图10 所示,随着气体体积流率从20 mL/min 升高到120 mL/min,Nisin 富集比由6.5 下降到3.8,而其回收率由52.1%增加到83.7%。同时,发酵液中Nisin 总效价由4083.1 IU/mL 降至3469.8 IU/mL。随着气体体积流率的增加,溶液中气泡的生成速度加快,气泡在分离塔内的停留时间缩短,且泡沫的迅速堆积增加了plateau 边界通道数量,阻碍了夹带溶液的回流[42]。泡沫的持液率较高,导致发酵液中营养物质的大幅度减少。因此,随着气体体积流率的增加,Nisin 的回收率增加,富集比下降。此外,气体体积流率越大,发酵液的气含率越高,气泡运动对液芯微胶囊膜造成的剪切破坏越强。综合考虑Nisin 的富集比、回收率以及总效价,选择40 mL/min 作为发酵-泡沫分离耦合操作的最适气体体积流率。
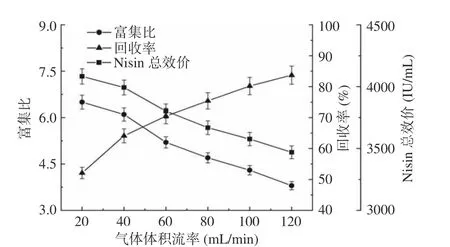
图10 气体体积流率对Nisin 的富集比、回收率和总效价的影响Fig.10 Effects of volumetric air flow rate on enrichment ratio andrecovery percentage of Nisin, and total titer of Nisin
综上,利用微胶囊固定细胞发酵耦合泡沫分离生产Nisin,在耦合时间为21 h,分布器孔径180 μm,气体体积流率40 mL/min 条件下,Nisin 的富集比和回收率分别为5.8 和63.1 %,总效价为3973.2 IU/mL。
3 结论
本文开发了一种乳酸链球菌与酿酒酵母双菌微囊化发酵与泡沫分离耦合强化Nisin 生产的新工艺,并对操作参数进行优化。实验结果表明,以4%乳糖为底物碳源,乳酸链球菌与酿酒酵母的初始接种比例为102:1 时,共培养发酵液中Nisin 效价较乳酸链球菌纯培养显著提高。采用ACA 液芯微胶囊包埋乳酸链球菌与酿酒酵母,其制备条件为海藻酸钠浓度15 g/L 和壳聚糖浓度5.5 g/L。利用微胶囊固定细胞发酵耦合泡沫分离生产Nisin,在耦合时间为21 h,分布器孔径180 μm,气体体积流率40 mL/min 条件下,Nisin 的富集比和回收率分别为5.8 和63.1 %,总效价为3973.2 IU/mL。

