非瓣膜性心房颤动患者左心房血栓形成的危险因素分析及PLR预测其左心房血栓形成的临床意义
黄莉莉,胡光玲,张智文,杨海涛
(河南省人民医院心脏中心/华中阜外心血管病医院/郑州大学华中阜外医院 心血管内科,河南 郑州 450003)
心房颤动(atrial fibrillation,AF)是临床常见的快速型心律失常之一,其不但导致患者生活质量恶化,还与脑卒中、心力衰竭等可导致患者病死率增加[1]。其中以非瓣膜性心房颤动(nonvalvular atrial fibrillation,NVAF)最多见。心房颤动时左心房失去正常的收缩节律,导致左心房血流淤滞,进而引起血栓的形成。血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)是一种新型的炎症标志物,其获取方法简单,易于检测,近些年来受到临床的关注。PLR是炎症和氧化应激的标志物,与心血管疾病等不良临床结果独立相关,在评价心血管疾病的病情和预后方面有着较高的临床价值[2]。并且PLR是根据血细胞分析得出的综合性指标,比单个血细胞计数更敏感,更准确。但目前关于PLR与左心房血栓(left atrial thrombus,LAT)关系的研究较少,本研究旨在探讨PLR与NVAF患者LAT形成的关系,评价其预测NVAF患者LAT形成的临床意义,为临床提供参考。
1 资料与方法
1.1 研究对象回顾性分析2018年1月至2020年1月于华中阜外心血管病医院接受过经食管超声心动图检查的所有NVAF患者的临床资料,严格按照纳入及排除标准选取研究对象。纳入标准:接受过经食管超声心动图检查的NVAF患者,且心房颤动的诊断符合美国心脏病协会2014诊断标准[3]。排除标准:严重的其他心血管系统疾病,曾行心房颤动射频消融治疗;严重肝、肾功能不全以及全身其他系统疾病。最终共有116例患者纳入了本项研究。
1.2 资料收集收集纳入患者的一般临床资料,包括性别、年龄、抽烟、饮酒、体质量指数(body mass index,BMI)合并疾病及卒中史等。实验室检查指标包括甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、血肌酐(serum creatinine,SCR)、尿酸(uric acid,UA)、C反应蛋白(C reactive protein,CRP)、血红蛋白(hemoglobin,Hb)、血小板(platelet,PLT)、国际标准化比值(international normalized ratio,INR)等。记录超声心动图指标包括左心房内径(left atrial internal diameter,LAD)、左心室舒张末内径(left ventricular end diastolic diameter,LVEDD)和左心室射血分数(left ventricular ejection fraction,LVEF),并计算出PLR值。
1.3 分组方法使用经食管超声心动图探查左心房和左心耳来判断左心房是否有血栓,左心房血栓的诊断标准[4]为:左房内探测到内部回声均匀,边界清晰的团块状实质性回声影像。将纳入研究的116例患者按照经食管超声心动图的检查结果分为血栓组(n=30)和非血栓组(n=86)。

2 结果
2.1 血栓组与非血栓组患者各临床指标比较单因素分析结果显示,两组患者在基线资料方面相比,血栓组患者心房颤动病程长于非血栓组(P<0.05),而在性别、年龄、抽烟、饮酒、高血压、冠心病、心功能不全、肾功能不全、糖尿病和BMI等方面差异无统计学意义(P>0.05);两组患者实验室检测指标方面相比,血栓组CRP、PLT和PLR高于非血栓组(P<0.05),淋巴细胞和INR则低于非血栓组(P<0.05),而在TG、TC、SCR、UA和Hb等指标方面差异无统计学意义(P>0.05);超声心动图指标方面相比,血栓组LAD长于非血栓组(P<0.05),而LVEDD和LVEF与非血栓组相比差异无统计学意义(P>0.05),见表1。
2.2 左心房血栓形成的多因素logistics回归方程分析以左心房是否有血栓为因变量,以心房颤动病程、CRP、INR、LAD 和PLR为自变量,经多因素logistics回归方程分析,心房颤动病程、CRP、LAD和PLR是NVAF患者LAT形成的独立危险因素,INR是NVAF患者LAT形成的独立保护因素。见表2。

表1 血栓组与非血栓组患者各临床指标比较
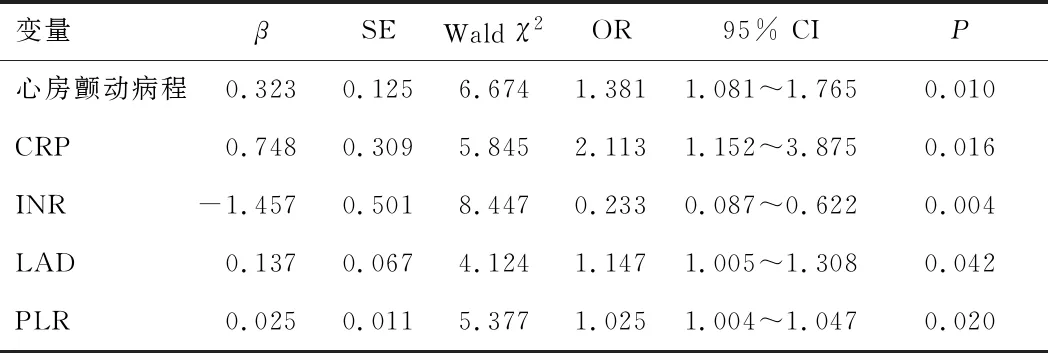
表2 左心房血栓形成的多因素logistics回归方程分析
2.3 PLR预测左心房血栓形成的ROC曲线分析ROC曲线方程分析结果显示,PLR预测LAT形成的曲线下面积为0.653(95% CI:0.559~0.739,P<0.05),灵敏度为56.67%,特异度为73.26%,最佳截断值为0.299,见图1。
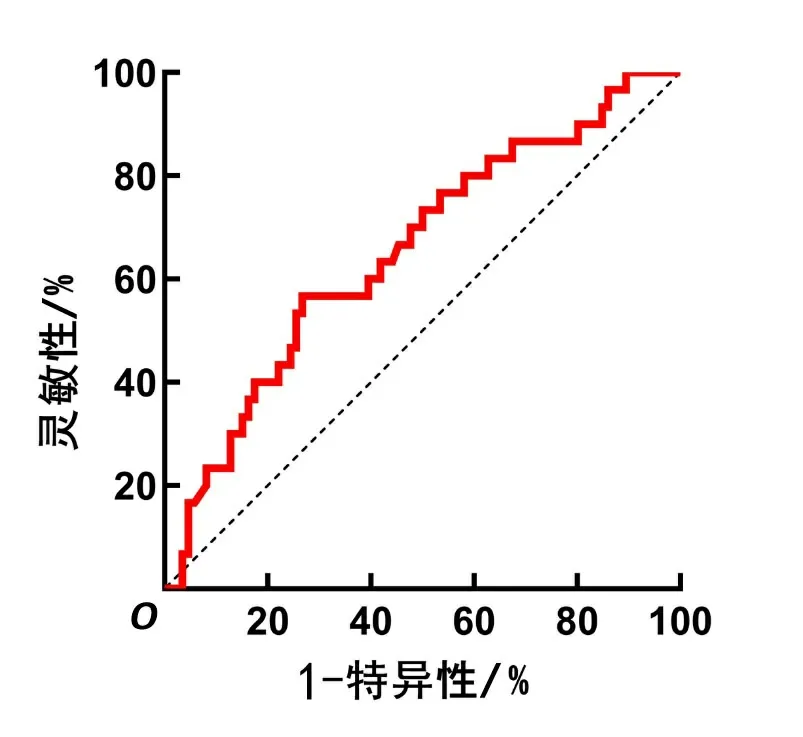
图1 PLR预测NVAF患者LAT形成的ROC曲线
3 讨论
心房颤动是临床常见的心律失常,心房颤动时左心房失去有节律的收缩,导致左心房血流瘀滞,使左心房处于一种血栓前的高凝状态,这种状态会增加缺血性卒中的风险[5]。LAT的形成与很多因素有关,血液在心房内瘀滞不仅可以损伤心房内皮细胞,激活凝血因子,形成心房附壁血栓,而且可以影响心室射血功能,进而扩张腔室,这可能是LAT形成的主要因素[6]。目前越来越多的研究表明了炎症在心房颤动血栓前状态中的潜在作用。Maehama等[7]观察到血浆CRP水平升高的患者发生LAT的概率更高,且更易发生不良心脑血管事件;Cianfrocca等[8]的研究发现左心房血栓患者的CRP明显高于无左心房血栓的患者,提示CRP可有效预测NVAF患者LAT的形成,CRP的增加与LAT相关,这些研究都表明炎症是心房颤动患者LAT形成的独立危险因素。
PLR是一种新型的炎症标志物,检测价格低廉且方便、迅速。血小板反映了机体的凝血功能及炎症反应,淋巴细胞反映了机体免疫炎症状态,而PLR整合了两者的相关信息,因此能更全面地反映机体的凝血功能和炎症反应状态[9]。PLR在评估心血管疾病及其预后方面发挥了重要作用。Gary等[10]研究发现,高水平的PLR可能损害血液黏度,从而损害心肌组织氧供应。此外,血小板体积增加可能改变血液黏度,并加重炎症。但目前国内外少有关于PLR在评估心房颤动患者LAT形成的研究。
本研究结果显示,血栓组与非血栓组在性别、年龄、抽烟、饮酒、高血压、冠心病、心功能不全、肾功能不全、糖尿病、BMI、TG、TC、SCR、UA、Hb、LEVDD和LEVF等方面相比,差异无统计学意义;血栓组心房颤动病程长于非血栓组,CRP、PLT和LAD水平均高于非血栓组, INR则低于非血栓组,差异具有统计学意义;经过多因素logistics回归方程分析,PLR、心房颤动病程、CRP和LAD是NVAF患者LAT形成的独立危险因素,INR是NVAF患者LAT形成的独立保护因素;ROC曲线分析显示PLR预测LAT形成的曲线下面积为0.653,具有较好的临床预测价值。
综上所述,PLR、心房颤动病程、CRP和LAD是NVAF患者LAT形成的独立危险因素,INR是NVAF患者LAT形成的独立保护因素,PLR可以作为一种预测和评估NVAF患者LAT形成的指标,高水平的PLR可能是预测LAT形成的早期预警信号,可通过加强对NVAF患者PLR的监测及时评估患者左心房LAT形成的可能。但本研究尚存在一定局限性,本研究样本量较少,今后还需进行多中心研究纳入更多的病例进一步验证PLR水平与NVAF患者LAT形成的关系。

