顶空气相色谱法测定国产米格列奈钙原料药中有机溶剂残留
李 珉,侯金凤,刘海涛,车宝泉,李文东
(北京市药品检验所·国家药品监督管理局仿制药研究与评价重点实验室·中药成分分析与生物评价北京市重点实验室,北京102206)
米格列奈,化学名为2-(S)-苄基-4-氧代-4-(顺-全氢异吲哚-2-基)丁酸,是继瑞格列奈、那格列奈之后的又一新型苯甲酸衍生物类降糖药物。2004年由日本Kissei制药公司研制的米格列奈钙首次在日本上市[1-3]。米格列奈钙可通过抑制胰腺B细胞膜上ATP依赖型K+通道,促进Ca2+内流,从而增加细胞内Ca2+浓度,促进胰岛素分泌,发挥降血糖作用,具有起效快、作用时间短、引起低血糖危险性小的优点,可单独用于经饮食和运动疗法不能有效控制高血糖的非胰岛素依赖型糖尿病患者,又称“餐时血糖调节剂”[4-6]。目前,各国药典中仅《日本药局方》ⅩⅦ版[7]中收录了米格列奈钙原料,但其标准中未设置残留溶剂项目。国内各企业所产米格列奈钙原料分别执行不同的标准[8-11]控制不同溶剂残留。在已有文献报道中,米格列奈钙残留溶剂的检测方法均未能完全覆盖各企业[12-13]。本研究中针对撰写时在产的5家国内企业使用的9种残留溶剂,建立了统一的米格列奈钙残留溶剂的测定方法,并对国内上市产品进行了评价。现报道如下。
1 仪器与试药
1.1 仪器
7890型气相色谱仪,包括火焰离子化检测器(FID)、7697A型顶空进样器(美国Agilent公司);XA205型电子天平(瑞士MettlerToledo公司,精度为十万分之一)。
1.2 试药
米格列奈钙原料样品(企业A,批号分别为0320160401,0320160501,0320160601;企业B,批号分别为01616015,01616021,01616022;企业C,批号分别为150801,150802,150803;企业D,批号分别为MG-161101,MG-161102,MG-160403;企业E,批号分别为170401Y,170402Y,170403Y)。甲 醇(批 号 为20150717)、无水乙醇(批号为20150717)、异丙醇(批号为20110803)、乙腈(批号为20141105)、二氯甲烷(批号为20150710)、正己烷(批号为20150723)、乙酸乙酯(批号为20120222)、四氢呋喃(批号为20141109)和三乙胺(批号为20110905),均购自国药集团化学试剂有限公司,均为色标对照品,含量均为100%;二甲基亚砜为色谱纯(美国Merck公司);水为纯化水。
2 方法与结果
2.1 气相色谱条件
色谱柱:Agilent DB-624毛细管柱(以6%氰丙基苯基-94%二甲基聚硅氧烷为固定液,60 m×0.53 mm,3 μm);柱温:程序升温,初始柱温为40℃、维持12 min,以5℃/min的速率升至80℃、维持5 min,再以50℃/min的速率升至200℃、维持15 min;进样口温度:220℃;顶空瓶平衡温度:80℃;平衡时间:30 min;进样时间:1 min;载气:高纯度氮气;载气流速:1.0 mL/min;分流比:10∶1;检测器:FID;检测器温度:250℃。
2.2 溶液制备
分别取甲醇300 mg、乙醇500 mg、异丙醇500 mg、乙腈41 mg、二氯甲烷60 mg、正己烷29 mg、乙酸乙酯500 mg、四氢呋喃72 mg和三乙胺20 mg,精密称定,置同一100 mL容量瓶中,用二甲基亚砜溶解并定容,摇匀,作为混合对照品贮备液。精密量取5 mL,置50 mL容量瓶中,用二甲基亚砜定容,摇匀,即得混合对照品溶液。取样品约100 mg,精密称定,置顶空瓶中,精密加入二甲基亚砜1 mL,密封,即得供试品溶液。取二甲基亚砜作为空白溶液。
2.3 方法学考察
专属性试验:取上述混合对照品溶液、空白溶剂各适量,按2.1项下色谱条件进样测定,记录色谱图(见图1)。各成分色谱峰分离度均大于2.9,基线分离良好,无干扰峰,表明专属性良好。

图1 空白溶液及对照品溶液高效液相色谱图1.methanol 2.ethanol 3.isopropanol 4.acetonitrile 5.dichloromethane 6.n-hexane 7.ethyl acetate 8.tetrahydrofuran 9.triethylamine A.Blank solution B.Reference solutionFig.1 HPLC chromatograms of blank solution and reference solution
线性关系考察:分别精密量取2.2项下混合对照品贮备液适量,以二甲基亚砜制成系列混合对照品溶液。按2.1项下色谱条件进样测定,记录峰面积。以待测成分质量浓度(X,mg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,得回归方程和线性范围。结果见表1。

表1 线性关系考察结果Tab.1 Results of the linear relation test
检测限与定量限考察:分别精密量取2.2项下混合对照品溶液适量,倍比稀释,并按2.1项下色谱条件进样测定,以信噪比为3∶1和10∶1分别计算检测限和定量限。结果见表2。

表2 检测限和定量限考察结果Tab.2 Results of LOD and LOQ
精密度试验:取2.2项下混合对照品溶液适量,按2.1项下色谱条件连续进样测定6次,记录峰面积。结果,甲醇、乙醇、异丙醇、乙腈、二氯甲烷、正己烷、乙酸乙酯、四氢呋喃、三乙胺峰面积的RSD分别为5.07%,5.46%,5.16%,5.14%,3.91%,4.71%,3.77%,3.75%,4.62%(n=6),表明仪器精密度良好。
加样回收试验:取已知含量的样品(企业A,批号为0320160401)适量,共9份,每份100 mg,分别加入一定质量浓度的混合对照品溶液,按2.2项下方法制备供试品溶液,再按2.1项下色谱条件进样测定,记录峰面积,并计算回收率。结果见表3。
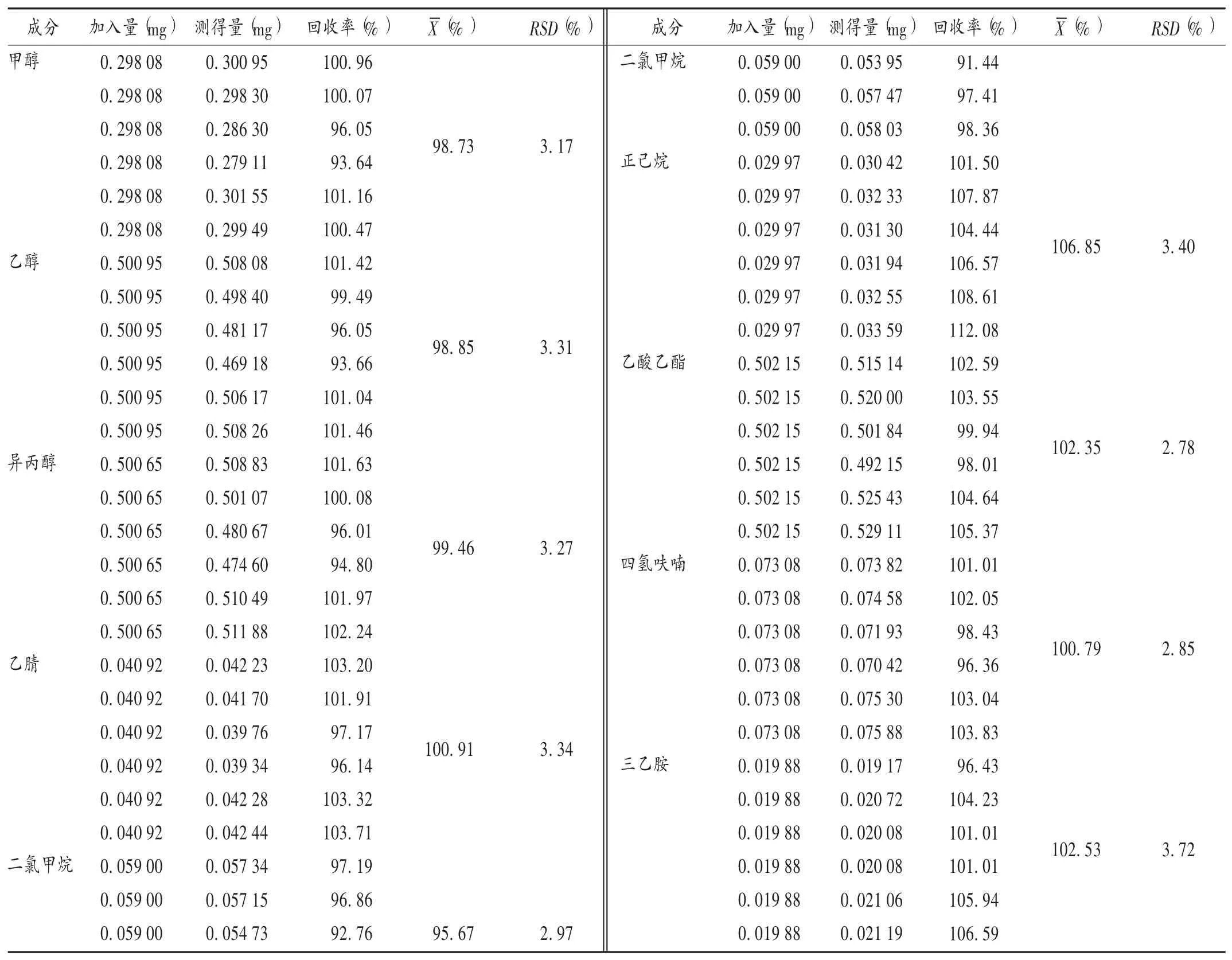
表3 加样回收试验结果(n=6)Tab.3 Results of the recovery test(n=6)
2.4 样品含量测定
取样品各适量,分别按2.2项下方法制备供试品溶液,再按2.1项下色谱条件进样测定。结果均未检出任何有机溶剂残留。详见图2。

图2 供试品溶液高效液相色谱图Fig.2 HPLC chromatograms of test solution
3 讨论
目前各国药典中,即使是唯一收录了米格列奈钙原料的ⅩⅦ版《日本药局方》[7]中也未设置残留溶剂项目。国内各家企业生产时均执行不同的标准[8-11]控制不同残留溶剂。由于各企业生产工艺中所使用的有机溶剂不同,本文作者与目前国内拥有米格列奈钙生产批准文号的6家生产企业进行了沟通,对在产5家企业工艺中使用到的溶剂进行了汇总。
本研究中,除三乙胺(未收录)外,各溶剂均按2020年版《中国药典(四部)》通则0861残留溶剂测定法中规定的限度来折算并制备[14]。而在2020年版《中国药典(二部)》中,存在3个品种的残留溶剂中包含了三乙胺。分别为齐多夫定项下三乙胺限度为0.02%[15]481-482,拉米夫定项下三乙胺限度为0.032%[15]774-775,罗红霉素项下三乙胺限度为0.032%[15]797-799。根据最低限度折算对照品溶液中三乙胺的浓度,并进行制备。对新建方法灵敏度进行验证,除三乙胺外,各残留溶剂的定量限均低于前述规定限度的1/20,检测限均低于规定限度的1/100。而三乙胺定量限和检测限分别为2020年版《中国药典(二部)》中最低限度0.02%的1/20和1/50,该结果表明新建方法灵敏度较高。
本研究中建立的顶空气相色谱法可测定米格列奈钙原料中9种残留溶剂含量,经方法学验证,该方法灵敏度高,专属性、精密度、准确度等均符合分析需求。采用该方法对5家国内企业的15批次产品进行了残留溶剂测定,各企业产品均未检出残留溶剂。该结果表明国内各企业米格列奈钙产品的溶剂残留较少,工艺控制较好。

