miR-22-3p在妊娠期糖尿病患者胎盘外泌体中的表达及其对血管内皮细胞功能的影响*
郑 芳,肖新益
(湖北省黄石爱康医院妇科,黄石 435000)
妊娠期糖尿病(gestational diabetes mellitus,GDM)作为临床上常见的妊娠并发症,严重影响母婴健康,其不仅增加孕产妇及胎儿的致死致残率,也使GDM 患者及其子代远期罹患糖尿病、肥胖等代谢及心脑血管疾病的风险显著增加[1-3]。胎盘组织血管病变是GDM 主要病理损伤之一。同时,有数据证实GDM患者与胎儿血管内皮细胞已出现初期病理性改变,这可能与GDM 母体与子代不良预后具有相关性[4]。外泌体(exosomes)是由双层磷脂分子所包裹的囊泡样小体(直径约为30~150 nm),其能作为细胞与组织间重要的信息载体,将其内的生物信息物质(如蛋白、DNA、mRNA、miRNA/lncRNA 等)传递给靶细胞,从而参与影响后者的功能[5-6]。microRNA(miRNA)是一类广泛存在于真核细胞内,主要通过与靶基因的3’非翻译区(UTR)结合,在转录后水平发挥负性调控基因表达的短链非编码RNA[7]。大量研究表明,在GDM患者胎盘组织中miRNA表达谱较正常妊娠者出现显著改变,其中miR-22-3p 呈异常高表达现象[7-9]。而最新一项研究[6]显示,miR-22-3p 在GDM 患者胎盘外泌体中的表达同样显著高于正常妊娠女性,这提示miR-22-3p 在GDM 中的作用可能不仅限于胎盘组织,还能够通过外泌体的形式影响其他组织器官。既往关于miR-22-3p在研究表明,miR-22-3p能够通过影响血管内皮细胞功能而参与影响心脑血管疾病的进展[10-11]。基于以上研究背景,本实验通过体内外实验检测miR-22-3p 在GDM 患者胎盘外泌体中的表达及其相关作用机制,以期进一步阐明GDM发生、发展的分子机制。
1 对象与方法
1.1 研究对象 选取自2018年10月至2019年7月在湖北省黄石爱康医院妇科产科住院分娩的GDM孕产妇10例(GDM组),另取同时期年龄及孕周相匹配的正常妊娠孕产妇10 例作为对照组(Normal组)。GDM 的诊断参考谢兴等主编的第9 版《妇产科学》的诊疗标准[12]。纳入标准:(1)年龄在23~35岁的育龄期女性;(2)自然受孕,单胎妊娠,且处于37~41孕周内;(3)GDM组孕产妇符合GDM诊断标准。排除标准:(1)年龄<22岁或>35岁者,孕周<37 周或>41 周者;(2)非自然妊娠,或多胎妊娠者;(3)妊娠前诊断为糖尿病者;(4)妊娠合并心脑血管、肺、肝、肾等疾病,妊娠合并甲状腺等内分泌疾病者。本研究经我院伦理委员会审批,所有受试者均签署知情同意书。
1.2 细胞系及主要试剂 人脐静脉内皮细胞系(HUVEC)购自美国ATCC 细胞库;RPMI 1640、0.25 %胰蛋白酶(美国Hyclone 公司);TRIzol 试剂(美国Invitrogen 公司);胎牛血清(FBS)、青链霉素混合液(均为100 U/mL)(杭州四季青生物公司);内皮细胞生长因子(ECGS)(美国Sciencecell 公司);PCR试剂盒(日本TaKaRa);CD63多克隆抗体(美国Bioworld公司);TSG101、PLAP、Netrin-1及GAPDH单克隆抗体(美国SantaCruz 公司);CCK-8 试剂盒(美国Sigma 公司);含miR-22-3p mimic、miR-22-3p inhibitor 及阴性对照序列(miR-NC)的质粒(上海吉玛生物公司);Matrigel基质胶(美国BD公司);免疫组化EnVison 二步法试剂盒、二氮基联苯胺(DAB)显色试剂盒(北京中杉金桥生物技术公司);荧光酶检测试剂盒(美国Promega 公司);辣根过氧化酶标记(HRP)的二抗(武汉博士德生物公司);PCR 引物有上海生工合成。
1.3 胎盘组织样本采集 胎盘娩出后立即从胎盘中央处取约2 cm×1 cm 大小的胎盘全层组织3~5块,避开出血点及钙化梗死灶,无菌生理盐水冲洗干净后迅速置于冰上运回实验室以备后续实验使用。
1.4 外泌体的分离及鉴定 参考文献[13]的方法进行胎盘外泌体的分离,具体方法如下:取孕产妇空腹肘静脉血3 mL,经过滤、蔗糖不连续密度梯度离心纯化,PEG6000进行沉淀后所得沉淀物即为胎盘外泌体,并将Normal组外泌体记为N-exo,GDM组记为GDM-exo。取约10 μg胎盘外泌体进行适当稀释后,3.5%的多聚甲醛固定后滴加到铜网上,2%的铀酸盐染色,室温晾干后应用透射电子显微镜(transmission electron microscopy,TEM)观察外泌体形态;参考NanoSight NS300 纳米粒径分析仪(nanoparticle tracking analysis,NTA)使用说说方法测量外泌体的粒径大小及分布;采用Western blotting 实验检测外泌体特征性蛋白CD63、TSG101 及胎盘外泌体特征性蛋白抗体PLAP的表达。
1.5 细胞的培养、转染 常规复苏HUVEC 后使用含10%FBS、1%青链霉素与10 ng/mL ECGS 的RPMI 1640培养基于37 ℃、5%CO2恒温培养箱进行培养。待HUVEC 贴壁生长融合至80%时,0.25 %的胰酶进行消化传代。取生长汇合至80%的HUVEC,调整细胞密度至2×105个/孔接种至6 孔板中培养过夜;转染前将更换培养基为Opti-MEM,参考转染试剂Lipofectamine3000 说明书,将100 nmol/L的含miR-22-3p mimic、miR-22-3p inhibitor、miR-NC的质粒分别转染入HUVEC内,6 h后将培养基更换为含10%FBS 的DMEN/HG 常规培养基中并置于37 ℃、5% CO2恒温培养箱中进行培养。转染48 h后更换含有2 μg/mL嘌呤霉素与10%FBS的DMEM/HG培养液,继续培养3 d,将细胞转移至新的培养板中,待1~2周细胞出现克隆时,挑取单克隆至6孔板中进行扩大培养,建立上述转染细胞的稳定细胞系以备后续实验使用。
1.6 细胞分组 将方法“1.5 项”中转染后的HUVEC安实验目的分为5组,分别为阴性对照组(negative control,NC 组),使用含常规葡萄糖浓度(5.6 mmol/L)的RPMI1640 培养液培养的HUVEC;高糖组(highglucose,HG 组),使用葡萄糖浓度为30 mmol/L 的高糖培养液培养的HUVEC;高糖+miR-22-3pmimic组(HG+miR-22-3p mimic组),高糖培养液培养转染miR-22-3p mimic 的HUVEC;高糖+miR-22-3p inhibitor组(HG+miR-22-3p inhibitor),高糖培养液培养转染miR-22-3p inhibitor后的细胞;高糖+miR-NC 组,即高糖培养液进行培养的经转染miR-NC 后细胞。上述各组细胞培养24 h 后,收集细胞,以备后续实验使用。
1.7 CCK-8 检测细胞的增值活力 取转染后的HUVEC,常规消化后调整细胞密度至2×103个/孔接种于96 孔板中,上述条件的培养箱中培养24 h 后,更换为无血清培养基饥饿细胞6 h,并按“1.4 项”分组方法进行不同处理后置于培养箱进行常规培养,分别于0 h、12 h、36 h、48 h 时向每孔加入10 μL CCK-8 试剂,置于酶标仪490 nm 波长处检测每孔吸光度值(D490),每组每个时间点每组设置5个复孔,绘制各组细胞的生长曲线。
1.8 内皮细胞迁移能力检测 Martrigel基质胶4 ℃溶解后,按1∶8 比例使用RPMI-1640 培养基进行稀释,并取40 μL 稀释后的基质胶均匀平铺于12 孔板底层。取转染后的HUVEC,将调整细胞密度至2×104个/孔接种至12孔板中,按方法“1.6项”进行不同分组处理。每组设定3 个复孔,于培养箱培养24 h后,显微镜下观察小管形成情况,计算形成的管样节点数。
1.9 实时荧光定量PCR(RT-qPCR)采用TRIzol法提取待测细胞中总RNA,分光光度计检测浓度与纯度后,根据逆转录试剂说明书逆转录为cDNA.按照RT-PCR试剂说明书确定的反应体系及条件进行实时定量,RT-PCR 反应条件为:95°C(30 s)预变性后,变性95°C(7 s)→退火60°C(30 s)→72 ℃(15 s),40 个循环周期。RT-qPCR 引物为:miR-22-3p 上游引物为5’-AAGCTGCCAGTTGAAGAACTGTA-3’,下游引物为5’-GCTGTCAACGATACGCTACGTAAC-3’;U6 上游引物为5’-ACTTCAGCAGCACATATACTAAAAA-3’,下游引物为5’-CGCTTCACGAATTTGCATGTCAT-3’。以U6为内参,采用2-ΔΔCt方法分析miR-22-3p的表达量。上述实验单独重复3次。
1.10 Western blotting 实验 采用外泌体蛋白提取试剂盒进行提取外泌体中的总蛋白。BCA 法进行蛋白定量,蛋白样品经沸水中加热变性后,取30 μg的蛋白进行SDS-PAGE 分离,采用湿转法将分离后的蛋白转至PVDF膜上,5%的脱脂奶粉于室温下封闭2 h 后,分别加入CD63(1∶300)、TSG101(1∶300)和PLAP(1∶300)一抗,4 ℃摇床孵育过夜。TBST溶液清洗后,以辣根酶标记的二抗(1∶5 000)室温孵育2 h,TBST 溶液再次清洗后,均匀滴加ECL 发光液后于凝胶成像仪进行曝光拍照。以上实验单独重复3次。
1.11 免疫组织化学染色(Immunohistochemical staining,IHC)取适量胎盘组织固定于4%甲醛溶液中,梯度酒精进行脱水,石蜡包埋,制成约4 μm的石蜡切片,采用EnVison 二步法检测两组胎盘组织中Netrin-1的表达。Netrin-1抗体稀释比例为1∶200,其余操作参考说明书进行。染色结果判定采用结果判定采用Sinicrope[14]改良法,按胎盘细胞染色强度进行评分。所有标本均经3位高级职称的病理医师通过双盲法独立评估。
1.12 统计学方法 采用SPSS 19.0 统计软件进行数据分析,计量资料使用均数±标准差()表示,两组间比较采用t检验,多组间比较采用单因素方差分析,两两比较采用SNK-q 检验;计数资料以百分率(%)表示,组间比较采用χ2检验;相关性分析采用Speaman 相关性检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 胎盘外泌体的鉴定及miR-22-3p含量测定 TEM、NTA观察结果显示,从NC组与GDM组孕产妇外周血中提取的胎盘外泌体呈典型杯状结构,直径约为30~150 nm(图1A 和图1B)。此外,Western blotting结果显示,两组受试者的胎盘外泌体均高表达外泌体标志性分子CD63、TSG101 和胎盘特异性蛋白耐热碱性磷酸酶(PLAP)(图1C)。RT-PCR 检测上述外泌体中miR-22-3p 表达水平,结果显示,与NC 组相比,GDM 组外泌体中miR-22-3p 含量显著增加(P<0.05)(图1D)。
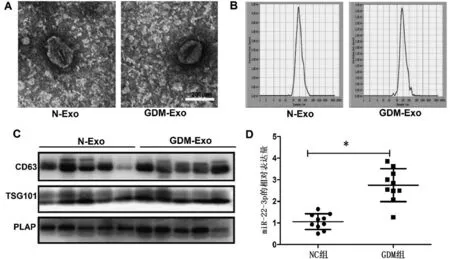
图1 GDM胎盘外泌体高表达miR-22-3p
2.2 转染后内皮细胞中miR-22-3p 的表达 RTPCR 检测结果显示,与NC 组相比,转染miR-22-3p mimic 的内皮细胞中miR-22-3p 的表达明显增加(P<0.01),而转染miR-22-3p inhibitor 的细胞中miR-22-3p的表达显著降低(P<0.01),miR-NC的细胞中miR-22-3p 的表达无明显变化(P>0.05),见图2。
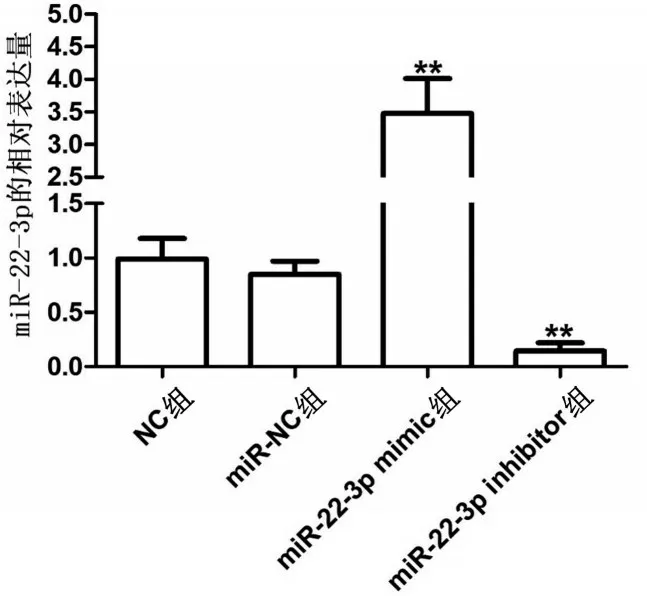
图2 RT-PCR检测转染后内皮细胞中miR-22-3p的表达
2.3 miR-22-3p 对高糖环境下内皮细胞增殖活性的影响 CCK-8实验结果显示,与NC组细胞相比,HG组,HG+miR-22-3p mimic组、HG+miR-22-3p inhibitor 和HG+miR-NC 组细胞的增殖活性均显著增加(P<0.05);与HG 组相比,HG+miR-22-3p mimic组内皮细胞的增殖活性增加趋势更为明显(P<0.05),而HG+miR-22-3p inhibitor 组细胞的增殖活性明显降低(P<0.05),HG+miR-NC 组无明显变化(P>0.05),见图3。

图3 miR-22-3p抑制高糖环境下内皮细胞的增殖活性
2.4 miR-22-3p对高糖环境下内皮细胞成管能力的影响 小管形成实验结果显示,与NC 组相比,HG组,HG+miR-22-3p mimic组、HG+miR-22-3p inhibitor和HG+miR-NC组内皮细胞的小管形成能力均明显增加(P<0.05 或P<0.01);与HG 组相比,HG+miR-22-3p mimic 组细胞的小管形成能力显著增加(P<0.05),而HG+miR-22-3p inhibitor 组细胞的小管形成能力明显降低(P<0.05),HG+miR-NC 组无明显变化(P>0.05),见图4。
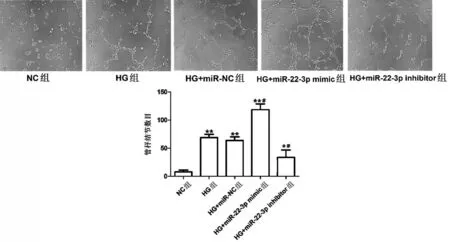
图4 miR-22-3p抑制高糖环境下内皮细胞的成管能力
2.5 miR-22-3p 与Netrin-1 的靶向关系 生物信息学预测显示,miR-22-3p 与Netrin-1 基因的3’-UTR具有靶向结合位点,见图5A。双荧光素酶基因报告实验结果证实,与共转染miR-NC+Netrin-1(WT)的细胞相比,共转染miR-22-3p mimic+Netrin-1(WT)的细胞荧光素酶活性显著降低(P<0.05)。而Netrin-1(MUT)的表达不受miR-22-3p 的影响,即miR-22-3p可直接与Netrin-1的3’-UTR结合并抑制其表达,见图5B。
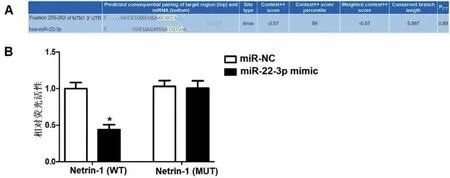
图5 miR-22-3p靶向抑制Netrin-1表达
2.6 Netrin-1 在胎盘组织的表达及其与miR-22-3p的关系 IHC 染色观察Netrin-1 在胎盘组织中的表达,结果表明,Netrin-1主要表达于绒毛内的血管内皮细胞中,少数分布于滋养细胞中,而与Normal 组相比,GDM 组Netrin-1 表达强度显著降低(P<0.05)。Speaman 相关系数分析显示,在GDM 组胎盘组织外泌体中miR-22-3p 含量与Netrin-1 蛋白表达水平呈负相关关系(r=-0.74,P<0.05),见图6。
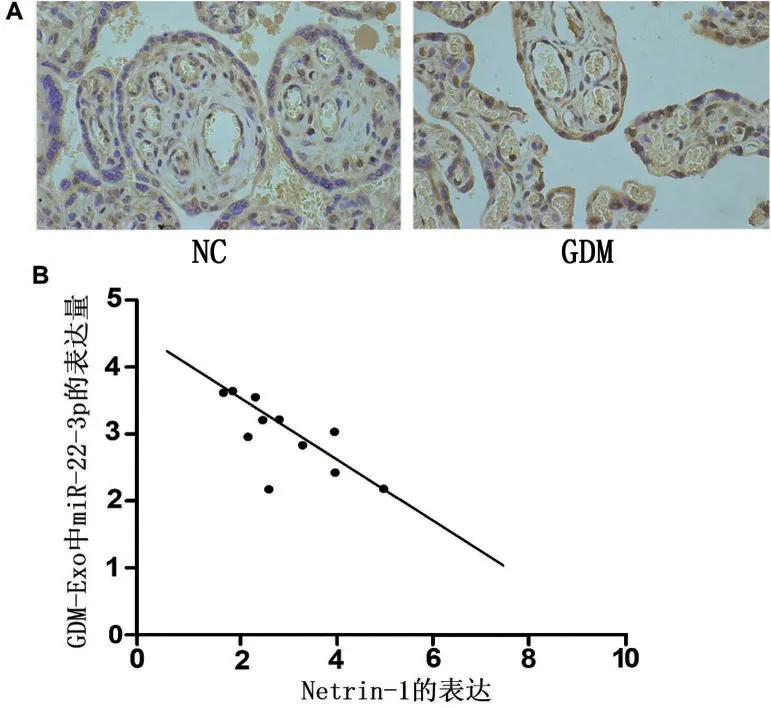
图6 Netrin-1在GDM胎盘组织中表达显著降低
3 讨论
GDM 是最常见的妊娠并发症之一,其在全球的发病率约为9%~15%。GDM 患者发生子痫、早产、剖腹产、巨大儿及远期罹患2型糖尿病及心血管疾病的风险均较正常妊娠女性显著增加[1-2]。然而,尽管GDM具有如此高的发病率与诱发其他疾病的风险,但其具体病理生理学机制仍不清楚。众所周知,血管内皮功能紊乱是GDM 特征性病理变化之一[4]。而GDM 的发展与妊娠胎盘向母体循环中释放大量的激素、细胞因子、胎盘特异性蛋白、非编码RNA 及细胞外囊泡等密切相关[15]。外泌体是纳米级胞外囊泡,由特异性分子(如CD63、TSG101 等)包裹而成。由于这些微小囊泡能够选择性地将其包裹的内容物转移至特定的靶细胞中而参与影响后者的生物学行为,故外泌体能够形成细胞间通讯的完整网络[5]。已有大量研究证实,妊娠期胎盘组织能够通过释放外泌体来介导母胎界面的免疫调节、子宫螺旋动脉的重塑及胎盘屏障的形成等重要事件[16],如在用低氧(1%的氧浓度)模拟子痫前期(pre-eclampsia,PE)环境下,滋养细胞分泌的外泌体能够抑制血管内皮细胞的迁移,并诱导其释放高浓度的肿瘤坏死因子α(TNF-α),而后者又能损害内皮细胞的结构,阻碍螺旋动脉的重铸,从而诱发PE 的发生[17]。在妊娠期免疫耐受的相关研究中发现,胎盘外泌体表达的活化NK 细胞受体NKG2D 的第二配体,即UL-16 结合蛋白(UL-16 Binding proteins,ULBP)可通过下调NK细胞、γδT细胞表面的NKG2D受体表达从而降低上述免疫细胞的细胞毒性,进而诱导母体对胎儿免疫耐受,维持正常的妊娠过程[18]。而在GDM中,最新的研究发现,GDM患者体内胎盘外泌体分泌水平较较正常女性相比,其在孕早期升高2.2 倍,孕中期增加1.5 倍,孕晚期约增加1.8倍,这提示外泌体与GDM的病理生理学发生机制密切相关[19-20]。
本实验首先通过分离妊娠孕产妇外周血中胎盘外泌体,分析发现miR-22-3p在GDM患者胎盘外泌体中的含量显著高于正常对照组(P<0.05),这与既往的研究结果一致[6]。为进一步明确miR-22-3p在GDM 中的具体作用,本课题组又采用脂质体稳定转染技术过表达或敲低其在血管内皮细胞中表达,并应用高糖进行培养上述转染后的细胞以模拟GDM体内环境,细胞功能实验显示,高糖环境能显著促进内皮细胞的增殖及小管形成能力,而上调细胞中miR-22-3p表达能够显著促进高糖的对内皮细胞的上述促进作用,敲miR-22-3p 表达却能显著减弱高糖上述作用。随后,应用生物信息技术分析显示miR-22-3p能够与Netrin-1基因的3’-UTR具有靶向结合位点,双荧光素酶基因报告实验证实miR-22-3p能够靶向抑制Netrin-1表达。
神经导向因子Netrin-1 又名NTN1L,是一种分泌型蛋白,因最初发现其具有神经引导作用而被命名,但随着对其研究的深入,Netrin-1已被证实能够在多种细胞中参与各种生物学过程,如细胞极性、黏附、迁移和血管生成。近年来,有学者报道Netrin-1同样参与了胎盘的形成与发育,这提示Netrin-1 可能在胎盘相关的妊娠疾病中发挥重要作用[21]。而在GDM 中,有学者研究发现,Netrin-1 能够与其受体相互作用能够保护血管内皮细胞免受高糖刺激的损伤[22],这提示在GDM中Netrin-1可能发挥保护性作用。本研究发现,胎盘外泌体高表达的miR-22-3p 能够靶向调控Netrin-1 表达,且在GDM 胎盘组织中Netrin-1 表达较正常妊娠女性显著降低,Spearman相关系数分析发现胎盘外泌体中miR-22-3p含量与胎盘组织中Netrin-1表达水平呈负相关关系,亦进一步证实两者的靶向调控关系。
综上,本研究发现在GDM 胎盘外泌体中异常高表达的miR-22-3p 可能通过调控Netrin-1 蛋白表达,促进高糖对内皮细胞的增殖及小管形成能力的上调作用,从而参与影响GDM 的发生发展。本研究结果从外泌体方面进一步补充了GDM的发病机制,为miR-22-3p/Netrin-1 轴有望成为GDM 新型临床标志物和治疗靶点提供了理论基础。
- 广西医科大学学报的其它文章
- Effects of silencing NRP-1 on the growth and autophagy of cervical squamous cell carcinoma SiHa cells and the survival of tumorbearing nude mice
- 喜报:我校10项科技成果获2020年度广西科学技术奖
- 基于分子对接和内质网应激探讨老鼠簕生物碱A对小鼠急性肝损伤的作用*
- 黄芪甲苷对特发性胃瘫大鼠c-kit蛋白表达及Cajal间质细胞的影响*
- 杜仲黄酮对糖尿病小鼠胰腺线粒体功能的影响*
- 慢性HIV-1感染者CD8+T细胞活化和耗竭水平与病程的相关性研究*

