应用函数思维探析碱液稀释pH变化
周松根

摘 要:应用函数思维,从水溶液中电解质的电离规律出发,结合电荷守恒、物料守恒等建立强碱、弱碱溶液稀释过程中pH与稀释倍数间的函数关系,将函数输入GeoGwbra图形计算器作图,依据图像进行理论分析,解决学生的困惑,并得出相应变化规律。研究还发现弱碱稀释到一定程度后与强碱溶液行为相似。
关键词:函数;碱液稀释;pH变化
函数的功能就是人类的思维,找出两个变量间互动的因果关系即为一种函数思维[1]。函数关系可用图象来表达。近年高考常以图像的形式来考察学生对于物质在水溶液中行为的综合理解,其中有关酸碱盐溶液稀释过程中pH变化规律问题常见于高考考题。深入挖掘图像背后的函数意义能促进我们对此类问题的理解。
在高三复习教学中,我们发现,有关教育部考试中心2020年版高考试题分析理科综合分册化学例题4(见例题),学生对于选项C的理解有两种看法,看法①为“将两条直线延长会交于一点,此时pH相等,因此C(OH-)相等”;看法②为“无限稀释后溶液均趋于中性,使得两溶液C(OH-)相等”。
例题:浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg的变化如图所示,下列叙述错误的是( )
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度: b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg=2时,若两溶液同时升高温度,则c(M+)/c(R+)增大
有报道从数字实验出发研究此问题,运用Excel软件拟合得出线性回归曲线,利用该曲线模型可预测看法②正确[2]。事实上,学生产生看法①这样的思考,只是分析图像的“表面”情况,并未发现横纵坐标间的化学关系。为帮助学生理解此问题,本文基于函数思想,从电解质溶液中的定量关系出发建立一元碱液稀释过程中pH与稀释倍数对数值间的数学函数,利用GeoGebra图形计算器绘制一元碱液稀释pH变化曲线,从函数图像中获得直观的证据来证实看法②正确。在此基础上本文还基于图像,从微观角度探析碱液稀释过程中的pH变化规律,加深高中学生对电解质溶液离子行为的理解。
一、函数的建立
室温下浓度均为0.1mol/L且体积均为V0的MOH(强碱)和ROH(弱碱)溶液(均视为理想溶液),分别加水稀释至体积为V,令lg =x,则有V=10xV0,令此时溶液pH=y,则有c(H+)=10-y,由水的离子积,则有c(OH-)=10y-14。
对于一元强碱(MOH)溶液,有以下两个电离过程:MOH=M++OH-;H2OH++OH-
稀释至体积为V时,有c(M+)=0.1/10x=10-1-x
稀释过程中溶液始终满足电荷守恒,即有c(H+)+c(M+)=c(OH-)
因此可得函数关系:10-y+10-1-x=10y-14(*)
对于一元弱碱(ROH),有以下两个电离平衡:ROH R++OH-;H2OH++OH-
稀释过程中溶液始终满足物料守恒,即有c(ROH)+c(R+)=0.1/10x=10-1-x
由ROH的电离平衡常数Kb==,得c(R+)=
将其代入电荷守恒c(H+)+c(R+)=c(OH-),得函数关系:(※)
二、依据函数作图及分析
(一)一元强碱(MOH)
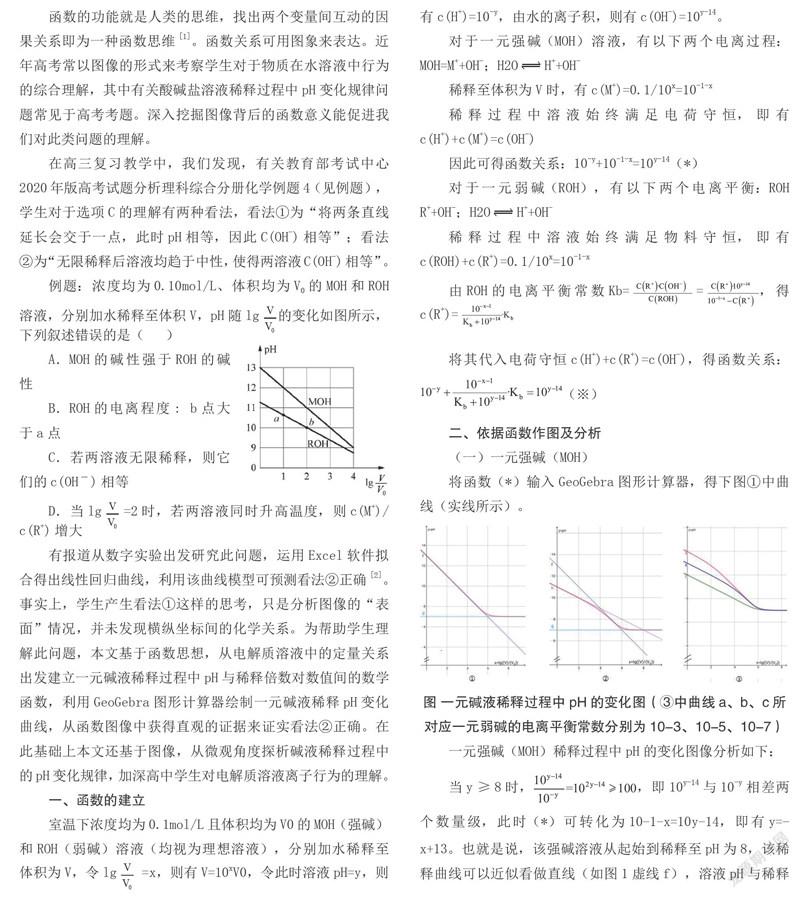
将函数(*)输入GeoGebra图形计算器,得下图①中曲线(实线所示)。
圖 一元碱液稀释过程中pH的变化图(③中曲线a、b、c所对应一元弱碱的电离平衡常数分别为10-3、10-5、10-7)
一元强碱(MOH)稀释过程中pH的变化图像分析如下:
当y≥8时,,即10y-14与10-y相差两个数量级,此时(*)可转化为10-1-x=10y-14,即有y=-x+13。也就是说,该强碱溶液从起始到稀释至pH为8,该稀释曲线可以近似看做直线(如图1虚线f),溶液pH与稀释倍数间为一次函数关系,原因是水的电离被MOH所电离出的OH-强烈抑制,可以忽略水的电离,溶液pH的变化来自于MOH所电离的OH-浓度的变化。
当8>y>7时,将(*)转化为 y=lg,利用GeoGebra图形计算器描点功能,发现此情况下5 当x>8时,由图可知,曲线已接近水平直线,结合 y=lg分析,当x→∞时,y→lg=7,也就是说,此时曲线无限趋近于y=7这条直线(如图1虚线g),这种情况下溶液可近似为纯水。 (二)一元弱碱(ROH) 我们以Kb的数量级为10-5为例,将函数(※)输入GeoGebra图形计算器,得上图②中曲线(实线所示)。 一元弱碱(ROH)稀释过程中pH的变化图像分析如下: 当ROH电离度很小时,忽略其电离,此时c(ROH)=0.1/10x=10-1-x。由电荷守恒c(H+)+c(R+)=c(OH-),当c(OH-)比c(H+)大2个数量级以上时,即pH>8时,可忽略溶液中的c(H+),即有c(R+)=c(OH-)。由Kb=得Kb=,结合水的离子积得pH=-lg,由前文所令pH=y即有函数y=x++3.5。当Kb=10-5时,y=x+11。此种情况下,溶液pH与稀释倍数间近似形成斜率为的一次函数关系,将该函数输入GeoGebra图形计算器得图2中曲线h,h与实线重叠部分即为ROH电离度很小时溶液稀释时的情况。 当加水稀释到ROH电离度较大时,在此基础上继续加水稀释带来的电离度增长率很小,若忽略此时电离度的变化,此时ROH溶液稀释时的离子行为类似于强碱MOH的稀释表现,即此时溶液pH与稀释倍数间近似形成斜率为-1的一次函数关系:y=-x+13,将该函数输入GeoGebra图形计算器得图2中曲线f。f与实线重叠部分即为ROH电离程度较大时溶液继续稀释时的情况。 继续稀释,此时水的电离和ROH的电离均不可忽略,溶液的pH应综合反映水及ROH的电离。由※,当x→∞时,※可转化为,即10-y=10y-14,得y=7,如图2中曲线h所示。也就是说无限稀释时,此溶液近似为纯水。 三、结论与启示 (一)强碱(MOH)和弱碱(ROH)溶液稀释过程中,溶液pH与lg 并非简单的满足一次函数关系。溶液的pH需综合考虑碱的电离及水的电离,在碱的电离主导溶液pH情况下,水的电离才可忽略。强碱和弱碱溶液无限稀释,溶液均将近似于纯水,使得两溶液C(OH-)相等。 (二)改变Kb数值,将相应数值代入※输入GeoGebra图形计算器,得到不同一元弱碱溶液稀释过程中,溶液pH与稀释倍数间关系如上图中③。圖像给我们很多启示,比如纵截距、稀释初始阶段图像的斜率均可反映碱的相对强弱;又比如碱性越强,曲线中斜率近似为-1类似于强碱稀释情况的区域就越大。 (三)本文对一元碱液稀释过程中pH变化图像的分析,深刻渗透化学观念中的“微粒观”、“变化观”与“守恒观”,利用函数生成图像能直观生动的启发学生思考pH变化背后的化学意义,启发学生运用化学知识解决问题。用数学的函数思维来解决化学实际问题,将数学与化学学科思维交叉融合,有利于高中学生学会更本质的认识电解质溶液问题。 (四)本文在回答学生困惑的过程中,直接使用智能手机APP GeoGebra图形计算器作图,相比Excel等软件,该APP作图十分简便,只需输入函数将即可快速生成图像,并可通过描点等功能更深刻的认识图像,对于一线教学和高中学生非常实用。 参考文献 [1]权平建一郎、神原武志.函数在你身边[M].北京:科学出版社.2001:152-158. [2] 马善恒、夏建华、盛恩宏. 利用数学建模促进对化学知识的深度学习——以水溶液中离子浓度关系考查为例[J].化学教学,2019(6): 79-81. 本文为广东省教育科研“十三五”规划2020年度教育科研一般项目:“构建普通高中化学学科思维课堂的教学研究”阶段研究成果,课题批准号:2020YQJK004。

