pH对微波改性薏米蛋白功能特性的影响
张艺玮,任静,张舒,富天昕,冯玉超,王长远*
(1.黑龙江八一农垦大学 食品学院,黑龙江 大庆 163319;2.国家杂粮工程技术研究中心,黑龙江 大庆 163319)
薏米,是一种传统的药食兼用谷物,广泛种植于中国、日本和越南,被誉为“世界禾本科植物之王”[1]。薏米蛋白资源丰富,含18种氨基酸,包括8种人体必需的氨基酸,与FAO/WHO制定的黄金配比相接近[2]。但是对薏米蛋白的研究并不多,对改性薏米蛋白的研究报道更是较少见。在食品中添加改性蛋白可以增强其功能特性,其中物理改性方法具有安全无残留及成本低廉等特点,所以对蛋白改性多采取物理方法,其中微波广泛应用于化学、生物和食品等科学研究[3],微波对蛋白质的破坏效果最强[4-5],所以较常应用于蛋白改性。pH是影响蛋白结构和功能特性的主要因素之一,因此在微波改性蛋白研究中具有重要的参考价值。基于此,本实验选用微波改性的方法,以碱法提取的薏米蛋白进行微波改性,并对其结构及功能特性进行测定,探讨不同pH条件下微波改性后薏米蛋白的结构和功能特性,使其在后期对薏米蛋白的改性提供理论依据,对促进薏米蛋白在食品行业中的应用及薏米产品的开发具有参考意义。
1 材料与方法
1.1 材料与试剂
薏米、玉米色拉油:市售;牛血清蛋白、盐酸、氢氧化钠、磷酸氢二钠、磷酸二氢钠、福林-酚试剂、石油醚(分析纯):购自上海麦克林公司;溴化钾(光谱纯):Sigma 公司。
1.2 仪器与设备
TG16-WS离心机 长沙湘仪离心机仪器有限公司;DELTA320精密pH计 梅特勒-托利多仪器(上海)有限公司;Alpha 1-2LD Plus冷冻干燥机 德国Christ公司;CW-2000超声微波萃取仪 上海新拓分析仪器科技有限公司;HHS-21-6数显恒温水浴锅 上海博迅实业有限公司医疗设备厂;DGG-9140电热恒温鼓风干燥箱 上海森信实验仪器有限公司;A360型紫外-可见分光光度计 翱艺仪器(上海)有限公司;Quintik 224-1CN电子天平 赛多利斯科学仪器(北京)有限公司;FTIR傅里叶红外光谱仪 美国 Thermo Electron公司。
1.3 方法
1.3.1 薏米蛋白的提取
将薏米清洗,去除杂质,于烘箱中烘干至恒重,用粉碎机粉碎后过80目筛,得到薏米粉。称取适量薏米粉于烧杯中与石油醚以1∶5(m/V)的比例混合,搅拌5 h,得到脱脂薏米粉,晾干后置于密封袋中保存备用。采用碱提酸沉法进行薏米蛋白的提取,参照曹向宇等[6]的实验方法并进行适当改动:脱脂薏米粉与蒸馏水按照1∶12(m/V)的比例混合,用1 mol/L的NaOH溶液调节pH值至10.5后,于37 ℃水浴锅中加热,并进行搅拌4 h,之后置于4000 r/min的离心机中离心20 min,取上清液;用1 mol/L的HCl溶液将上清液的pH值调至等电点,静置1 h,之后以4000 r/min离心2 min,弃上清液,取沉淀进行冷冻干燥,于-20 ℃贮存备用。
1.3.2 薏米蛋白的微波改性
于烧杯中称取5 g薏米蛋白粉,添加100 mL蒸馏水,配制成浓度为5%的薏米蛋白水溶液,并用NaOH和HCl溶液(均为0.1 mol/L),分别调节pH值为5.5,6.5,7.5,8.5,9.5,10.5,然后放入超声微波萃取仪中,关闭超声,设置微波功率100 W、温度85 ℃、时间100 s进行改性。改性后的蛋白溶液以4000 r/min离心20 min,取沉淀物进行冷冻干燥,于-20 ℃贮存备用[7]。
1.3.3 溶解性的测定
参照贾聪等[8]的实验方法,并进行适当的改动。称量0.5 g样品,添加100 mL浓度为0.05 mol/L的磷酸缓冲溶液(pH值为7),放入37 ℃的水浴锅中并搅拌30 min,静置取出。于4000 r/min的离心机中离心20 min,取1 mL上清液于试管中,再依次加入1 mL碱性铜溶液和4 mL福林酚溶液,立即摇匀,于55 ℃的水浴中反应5 min,置于冷水浴中10 min,取出后于650 nm处测定其吸光度值,按照下式计算溶解度。

(1)
1.3.4 乳化性、乳化稳定性的测定
用0.1 mol/L的磷酸缓冲溶液(pH 7),配制10 mL质量分数为1%的蛋白溶液,加入2 mL玉米油,然后以10000 r/min的速度高速匀浆1 min,制成乳浊液,用微量注射器于液体底部取50 μL液体,放入预先加入5 mL质量分数为1%十二烷基硫酸钠溶液(SDS)的试管内,制成混合溶液,分别在0,10 min时,在500 nm的波长下检测吸光度值A0、Aφ。乳化性、乳化稳定性的计算公式如下[9]:
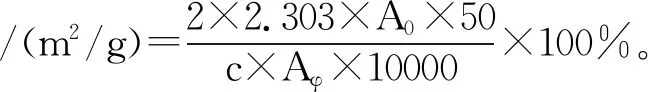
(2)
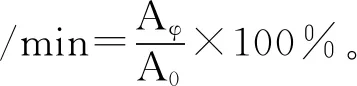
(3)
式中:A0为0 min时混合溶液的吸光度;Aφ为10 min时混合溶液的吸光度。
1.3.5 起泡性、起泡稳定性的测定
参照Agyare等[10]的方法,并根据实验对条件进行适当的改动。取1 g冻干的薏米蛋白粉,添加100 mL浓度为0.05 mol/L的磷酸缓冲溶液(pH 7),配制成质量分数为1%的蛋白溶液,然后以10000 r/min的高速均质机进行搅拌2 min,快速移至100 mL的量筒内,记录泡沫所占体积V0,将该量筒放入30 ℃的水浴锅中静置30 min,然后再次记录泡沫所占体积V1。起泡性、起泡稳定性的计算公式如下:
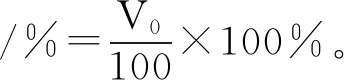
(4)

(5)
式中:V0为0 min时泡沫体积;V1为10 min时的泡沫体积。
1.3.6 红外光谱的测定
参照林素丽[11]的实验方法,并进行适当的调整。利用傅里叶红外光谱分析法对改性后的薏米蛋白进行分析,采用KBr压片法,称取0.0001 g的样品和0.1 g的固体KBr于玛瑙研钵中,研磨成均匀的粉末并压成薄片。用傅里叶红外光谱仪作全波长扫描,波数范围在0~4000 cm-1之间,分辨率在4 cm-1,波数精度在0.01 cm-1,扫描32次。
1.3.7 数据统计分析
实验均进行3次平行,采用Excel 2019软件对数据进行处理分析作图。
2 结果与分析
2.1 溶解性分析
蛋白质在水溶液和盐溶液中被溶解的性质称为溶解性,溶解效果较好的蛋白质通常也具有较好的乳化性、起泡性、持油性和凝胶性等特点。具有良好溶解性的植物蛋白在食品工业中也具有良好的应用前景,尤其是在饮料行业,植物蛋白近年来成为科研与实际生产中的热点,改性后提高溶解性植物蛋白在贮存过程中可以抑制分层和沉淀现象,增强稳定性,改善口感等[12]。
以牛血清蛋白为标准蛋白,绘制标准曲线y=0.8171x+0.0002(R2=0.9983)。不同pH条件下微波改性后薏米蛋白的溶解性见图1。
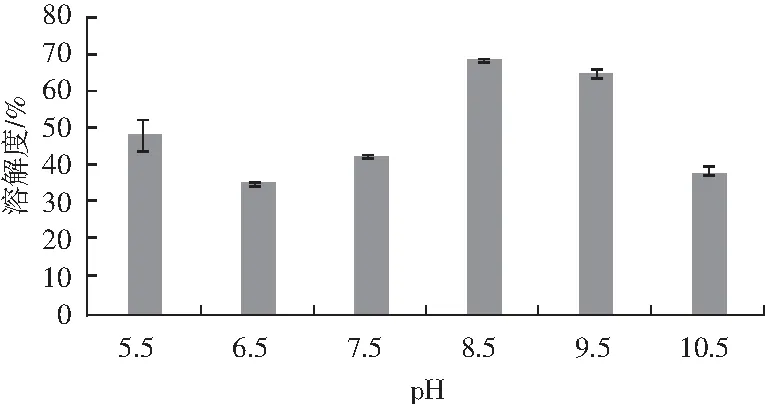
图1 微波改性薏米蛋白的溶解性Fig.1 The solubility of microwave-modified coix seed protein
由图1可知,pH值为5.5时,溶解度为47.7%。pH 6.5时的溶解度最低,仅为34.5%。随着pH值的不断升高,改性蛋白的溶解度也不断增大,pH 7.5时的溶解度为42.2%,pH值为8.5时达到峰值,溶解度为67.7%,较未改性的薏米蛋白高出1.7%。pH 9.5与pH 8.5相差不大,分别为64.4%和67.7%,但随着pH>8.5,溶解度在不断降低,pH 10.5时溶解度为38.0%。
经过微波改性后的蛋白,蛋白分子的二硫键被打破,结构不再紧密,暴露更多亲水基团,增强溶解性。pH值为8.5时溶解度最大,可能是因为较高的pH值导致蛋白质内部因静电排斥而造成分子伸展,蛋白质分子粒径增大,产生了部分可溶的蛋白质聚集体[13],从而使溶解度增大[14]。pH<8.5条件下的改性蛋白溶解度不高,主要因素之一为在等电点附近蛋白沉淀较多,蛋白易借静电力形成较大的聚集体,不利于溶解。随着溶液的环境趋向碱性,蛋白的溶解度均高于中性和弱酸性环境。
2.2 乳化性和乳化稳定性定性分析
互不相溶的两种液体经过机械搅拌形成均一乳化液的性质为乳化性,是蛋白质具有的一种特性。影响此特性的主要因素为蛋白质分子链中的疏水基团和亲水基团,蛋白质的存在决定了其表面活性[15]。
不同pH条件下微波改性对薏米蛋白乳化性的影响见图2。

图2 微波改性薏米蛋白的乳化性Fig.2 The emulsibility of microwave-modified coix seed protein
由图2可知,pH 5.5时乳化性为0.0034 m2/g,在pH 6.5条件下,薏米蛋白的乳化性最低,仅为0.0012 m2/g;pH 7.5时,薏米蛋白的乳化性最佳,达到0.0076 m2/g,高出未改性薏米蛋白0.0016 m2/g。pH>7.5时,薏米蛋白的乳化性不断降低,pH 8.5时乳化性为0.0038 m2/g,pH 9.5为转折点,乳化性为0.0022 m2/g,当pH值继续增大,薏米蛋白的乳化性不再降低,反而升高,pH 10.5时,乳化性升至0.0058 m2/g。
不同pH条件下微波改性后薏米蛋白的乳化稳定性见图3。
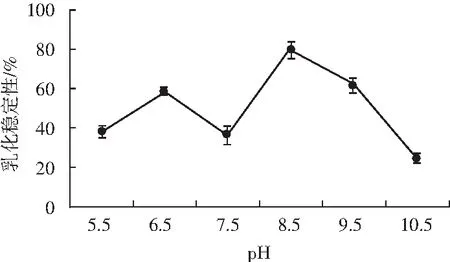
图3 微波改性薏米蛋白的乳化稳定性Fig.3 The emulsifying stability of microwave-modified coix seed protein
由图3可知,pH 5.5和pH 7.5时的乳化稳定性相差不大,分别为36%和37%。pH 6.5时乳化稳定性为58%,其最好的乳化稳定性为pH 8.5条件下的微波改性蛋白,达到79%,比未改性的薏米蛋白高出37%。pH 9.5时改性蛋白的乳化稳定性为61%,随着pH值不断增大,乳化稳定性也不断降低,pH 10.5时改性蛋白的乳化稳定性仅为24%。
图2和图3中乳化性和乳化稳定性的变化趋势呈相反状态。但在等电点附近,其乳化性和乳化稳定性都不高,推断在此pH条件下改性蛋白只能微溶于溶液中,并且缺乏静电排斥力,亲水性降低,所以能够依附在油/水界面上的蛋白质减少,导致乳化性不高。在中性偏碱性的条件下,改性蛋白的乳化性有所提高,主要因素有微波处理后的蛋白分子更加松散,极性基团和疏水基团暴露的增加及柔性的增强[16]。随着pH值的增大,乳化稳定性降低,推测在碱性环境下改性的亲水基团增加,附着在油/水界面上的蛋白质较之前减少,界面厚度减小,从而导致乳化稳定性降低。
2.3 起泡性和泡沫稳定性分析
蛋白质经过机械搅打,在气-液界面可以形成一层坚韧的薄膜并使气体并入且稳定的能力称为起泡性。分散的两相间存有界面张力,蛋白能够吸附在两相之间降低其张力,同时产生一定的流变学特性和稳定作用,并且作用于产生的吸附膜,增加膜的强度、粘度和弹性以对抗不利因素的能力称为泡沫稳定性[17]。
微波改性后的薏米蛋白在不同pH条件下的起泡性见图4。
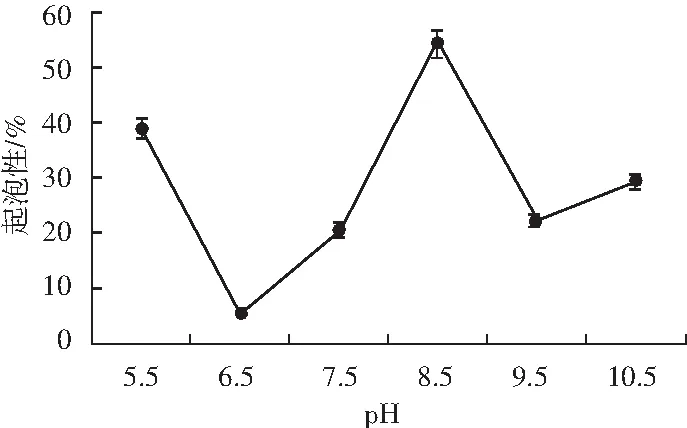
图4 微波改性薏米蛋白的起泡性Fig.4 The foamability of microwave-modified coix seed protein
由图4可知,pH 5.5时,改性蛋白的起泡性为38%,在pH 6.5时起泡性最低,仅为5%。随着pH值的不断增大,改性蛋白的起泡性得到改善,pH 7.5时起泡性为20%,pH 8.5时为最大值,达到54%,未改性薏米蛋白的起泡性为43%。当pH>8.5时,起泡性降低,pH 9.5和pH 10.5时的起泡性分别为22%和29%。
微波改性薏米蛋白在不同pH条件下的泡沫稳定性见图5。
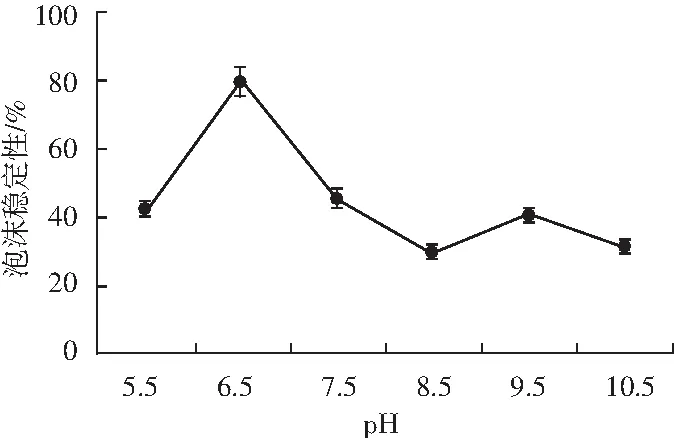
图5 微波改性薏米蛋白的泡沫稳定性Fig.5 The foaming stability of microwave-modified coix seed protein
由图5可知,pH 5.5时,改性蛋白的泡沫稳定性为42%,pH 6.5时泡沫稳定性最佳,稳定性达到80%。随着碱性的增大,泡沫稳定性逐渐下降,pH 8.5时,泡沫稳定性最低,仅为29%,也高出未改性薏米蛋白8%,pH 9.5时略有升高,泡沫稳定性为41%,pH 10.5时为30%。
良好的溶解度是蛋白质呈现良好起泡性的重要条件,pH 8.5时溶解度和起泡性最好[18]。微波改性后的薏米蛋白,受微波作用而被极化,分子内的非亲水基团暴露于分子表面,降低其表面张力,提高其起泡性。pH 6.5时的泡沫稳定性最好而起泡性最差。随着碱性增大,起泡性缓慢增加,泡沫稳定性随之下降,推测在碱性条件下,改性蛋白的溶解性得到改善,起泡部分为溶解部分,即起泡性也得到改善。但在搅打过程中沉淀的蛋白颗粒会通过静电作用与泡沫结合,所形成的泡沫绵密稳定,并且在等电点附近环境下的蛋白之间缺乏静电排斥相互作用,利于在界面蛋白之间相互作用及形成黏稠的膜,所以泡沫稳定性最好,pH增大,泡沫稳定性下降。
2.4 傅里叶红外光谱分析
傅里叶红外光谱分析是一种分析多肽和蛋白质二级结构常用的方法,具有快捷、简单、高效等特点,广泛用于鉴定食品、中草药等混合体[19]。不同的官能团和化学键对红外光谱吸收不同,可以检测到蛋白质二级结构的变化。

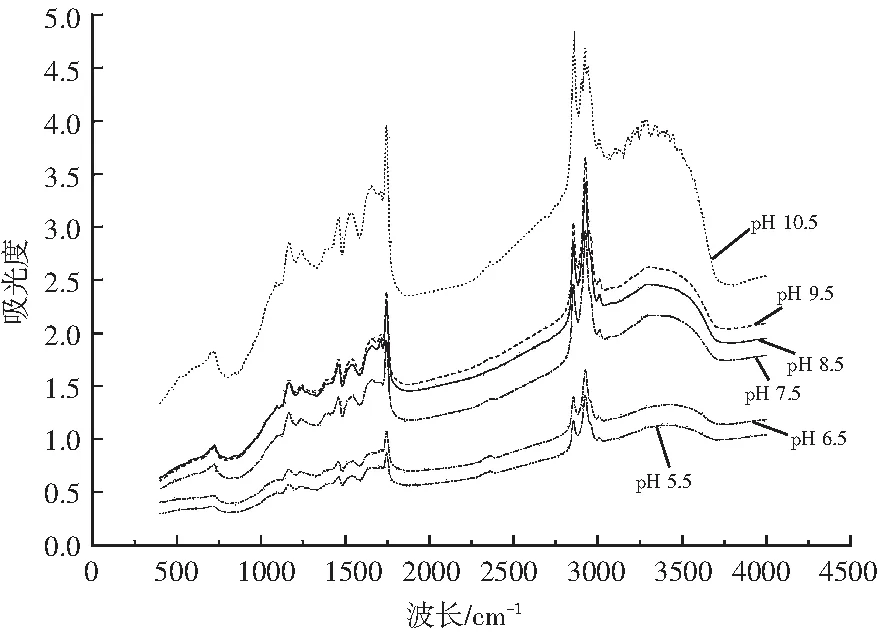
图6 微波改性薏米蛋白的红外光谱图Fig.6 The infrared spectra of microwave-modified coix seed protein
3 结论
本研究通过对薏米蛋白在不同pH值条件下进行微波改性,采用碱提酸沉法提取薏米蛋白并对改性蛋白进行结构和功能性测定,在傅里叶红外光谱分析中发现,pH 8.5条件下改性蛋白的吸收峰与未改性薏米蛋白相差不大,说明结构相似,改性后的薏米蛋白溶解性提高1.7%,乳化性提高0.0016 m2/g,乳化稳定性提高37%,起泡性提高11%,泡沫稳定性提高8%。通过分析说明改性薏米蛋白的结构变化越小,其功能性质越好。磷脂P-H键的伸缩振动可能与改性后的薏米蛋白功能性质改善相关。综上所述,微波改性中,不同pH值对薏米蛋白的结构影响显著。本研究对薏米蛋白的改性研究具有一定的参考意义。

