亚热带4种典型森林植被土壤固碳细菌群落结构及数量特征*
刘 茗,曹林桦,刘彩霞,梁辰飞,秦 华,陈俊辉,邵 帅,徐秋芳,3†
(1.浙江省森林生态系统碳循环与固碳减排重点实验室,浙江农林大学,浙江临安 311300;2.浙江农林大学环境与资源学院,浙江临安311300;3.浙江省竹资源与高效利用协同创新中心,浙江农林大学,浙江临安 311300)
工业飞速发展以及人类活动加剧了全球性温室效应[1],CO2是影响“温室效应”最主要的气体,降低大气CO2浓度有利于缓解温室效应。土壤微生物参与的土壤碳循环与温室气体排放密相关[2],一方面土壤微生物分解有机质和自身呼吸释放CO2,另一方面,自养微生物生长繁殖固定CO2[3]。通过植物或自养微生物将 CO2转化成有机化合物的生物固碳过程、提高生态系统的碳固定和储存能力,是减少大气CO2浓度的有效途径[4-5]。研究证明,自养微生物同化CO2是全球生态系统碳循环中的关键微生物过程,对调节大气中二氧化碳浓度具有极重要作用[6],全球陆地土壤的自养微生物每年可捕获大气 0.5%~4.1%的CO2、总量达0.6~4.9 Gt C[7]。土壤碳同化量主要来自于土壤自养微生物固定[8],自养微生物广泛分布于不同的生态系统中,具有很强的环境适应能力,可以在多种环境条件下如火山口[9]、海洋深处[10]、极地湖泊[11]等植物无法生存的生境中参与CO2的同化固定。迄今为止发现的5条固碳途径中卡尔文循环是自养微生物固定大气 CO2的主要途径,其中1,5-二磷酸核酮糖羧化酶(RubisCO)是其关键酶[12],研究者们将RubisCO I大亚基的编码基因cbbL基因作为固碳微生物标记物,对不同生态系统土壤固碳微生物开展了大量研究,固碳细菌数量及多样性受土地利用方式、海拔梯度、植被类型等影响[13-16]。
综上所述,从整个生物圈的物质、能量流动来看,研究自养微生物的固碳功能具有重要意义,但影响固碳微生物因素却较为复杂。森林是陆地重要的碳汇,全球森林生态系统存储碳量高达650 Gt,其中地下土壤占 45%[17]。中国亚热带森林面积大(2.5×108hm2)、植被类型多样,在全球森林碳汇中发挥着独特作用[18]。因凋落物质量、根系分泌物和养分吸收的差异[19],地上植被种类和多样性的变化能直接或间接影响碳在地下生态系统的分配,并调节影响参与这些过程的土壤微生物[20]。土壤微生物最常利用的碳源是碳水化合物和羧酸,其次是氨基酸,酚酸和聚合物,而胺的利用率最低,土壤微生物群落利用各种碳源的数量及其比例会因植被类型而不同;森林土壤中细菌群落结构与功能多样性与地上植被组成密切相关[21],而土壤固碳细菌占总细菌的0.1%~10%不等[22-23],群落结构和丰度也会受植被类型影响,然而,森林植被类型对土壤固碳微生物影响研究却鲜见报道。
本研究以植物多样性丰富的亚热带不同森林植被类型为对象,选取亚热带典型森林植被毛竹林(Moso banboo groves)、阔叶林(Broad-leaved forest)、杉木林(Chinese fir forest)和马尾松林(Masson pine forest)等4种林分,以卡尔文循环功能基因cbbL为标记基因,利用 qPCR和 Illumina MiSeq高通量测序技术,探明4种林分土壤固碳细菌丰度、多样性和群落结构差异,为揭示亚热带 4种林分对土壤固碳细菌影响机理提供依据。
1 材料与方法
1.1 研究区概况
研究样地位于浙江省杭州市临安区玲珑山(30°14′N,119°42′E),属中亚热带季风气候,热量丰富,雨量丰沛,光照充足,四季分明,具有春多雨、夏湿热、秋气爽、冬干冷的气候特征。多年平均降雨量1 628.6 mm,降水日158 d,全年日照时数1 847 h,无霜期237 d,全年平均气温16.4 °C。土壤为发育于凝灰岩的黄红壤,具有典型的中亚热带的森林生态系统和森林景观,植被主要包括毛竹、阔叶、杉木、马尾松等典型亚热带植被。其中,阔叶林、杉木林和马尾松林下植被均包含丛生灌木,有蕨类植物,毛竹林下植被很少,仅有稀疏的草本植物。
1.2 样品采集与处理
于2017年10月按照生态控制原则,选择同一成土母质的毛竹林(MB)、阔叶林(BL)、杉木林(CF)和马尾松林(MP)。分别于各个林分的下坡位、中坡位、上坡位确定采样区,在采样区周围 10 m2范围内按照三角形确定3个取样点,分别采集表层(0~20 cm)及亚表层(20~40 cm)土壤混匀得到一个土样,每种林分选择 4个重复,4种林分共得32个(4×4×2)土样。新鲜土样去除植物残体和大的石头过筛(2 mm)后装入密封袋,将样品放入冰盒带回实验室。样品共分为 2份,1份测定含水率后鲜土提取土壤细菌总DNA,并冷冻干燥存放于–70 °C冰箱,用于其他分子生物学分析;另一份于室内自然风干,充分研磨过筛后用于土壤基本理化性质的测定。
1.3 分析方法
土壤理化性质分析:分析方法参考文献[24]。土壤 pH 采用酸度计测定,水土比为︰1(m/v);土壤有机碳(SOC)及全氮(TN)使用元素分析仪(ELEMENTAR Vario El Cube)测定;土壤碱解氮(AN)含量采用碱解扩散法测定;有效磷(AP)含量采用盐酸-氟化铵溶液浸提,钼锑抗比色法测定;速效钾(AK)含量采用醋酸铵提取,火焰光度计测定。
土壤总 DNA提取:采用 Power Soil DNA Isolation Kit试剂盒提取土壤总DNA。测定鲜土的含水率后,换算成0.35 g干土重,称取相应的新鲜土样,按试剂盒说明书进行提取。DNA提取成功后经 1%(m/v)的琼脂糖凝胶电泳检测 DNA片段大小,并用微量分光光度计检测其浓度和纯度。提取后的DNA样品保存于–40 ℃冰箱。
实时荧光定量 PCR(Real-time quantitative PCR,qPCR),测定固碳功能菌cbbL基因拷贝数引物对为 K2f(ACCAYCAAGCCSAAGCTSGG),V2r(GCCTTCSAGCTTGCCSACCRC),得到 492bp-495 bp的扩增产物[25]。测定土壤细菌16S rRNA基因拷贝数通用引物对为338F/518R,16S-F(AGA GTTTGATCMTGGCTCAG),16S-R(GCTGCCTC CCGTAGGAGT)[26]。使用 CFX96TMReal-Time System(Bio-Rad,USA)仪器对cbbL基因进行荧光定量PCR扩增。反应体系及程序详见文献[25-26]。
高通量测序:采用同上 K2f/V2r引物对,对土壤DNA进行扩增,将PCR产物纯化后送至上海派森诺公司,采用Illumina MiSeq平台对群落DNA片段进行双端(Paired-end)测序。下机数据选择NCBI(National Center for Biotechnology Information)数据库的氨基酸序列进行对比,进行物种注释得到分类鉴定结果。
1.4 数据处理
利用Microsoft Excel 2010软件对数据进行初处理,采用SPSS 21.0软件对数据进行和双因素方差分析(Two-Way ANOVA)和最小显著差数(LSD)法进行显著性和多重比较(α=0.05),采用皮尔逊(Pearson)进行相关性分析。根据OTU表计算α多样性指数。利用Origin软件绘制基因丰度图和群落结构丰度图。使用Canoco 5.0软件对固碳细菌群落结构与环境因子的相关性进行冗余分析(Redundancy analysis,RDA)。
2 结 果
2.1 不同林分土壤理化性质
4种林分虽然发育于同一母岩,但土壤理化性质却存在差异(表1)。毛竹林和阔叶林表层土壤各项指标总体均较高,而杉木林和马尾松林土壤总体较低,尤其是杉木林土壤除 pH和碱解氮外的其他指标均为最低。亚表层土壤2组林分之间的差异不如表层明显,而杉木林土壤的各项指标(pH除外)仍然为最低。表层土壤碳氮比总体高于亚表层,但没有显著差异,其中毛竹林两层土壤碳氮比均为最低。双因素检验结果表明,林分对5个土壤理化性质均产生显著影响(P<0.05),而对碳氮比和有效磷则无影响;土层对土壤有机碳、全氮、碱解氮、速效钾具有显著影响(P<0.05);林分和土层二者交互作用仅土壤有机质达到显著影响(P<0.05),说明两者对土壤性质的影响可能不同步、甚至相反。
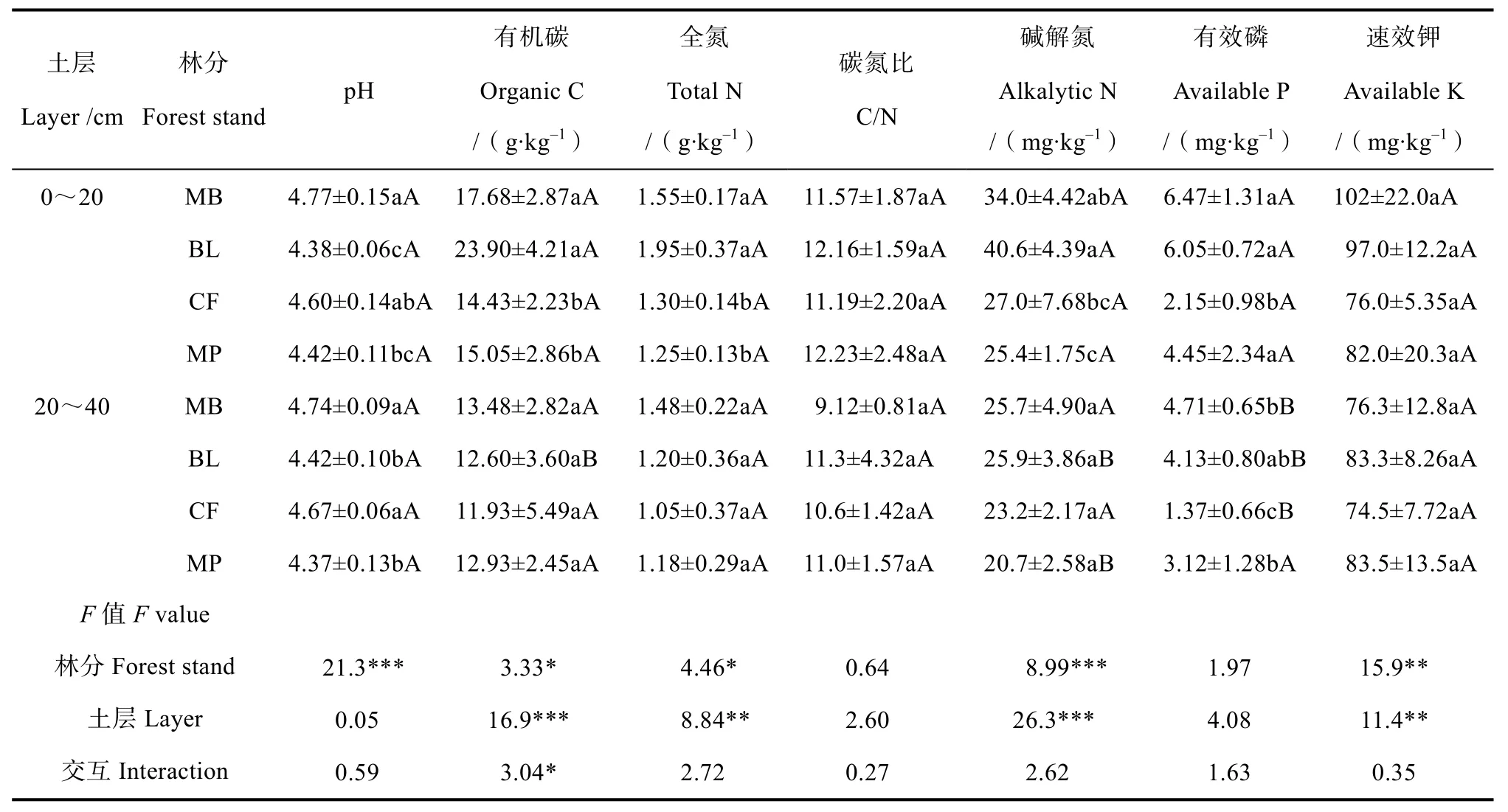
表1 不同林分土壤理化性质(均值±标准差)Table 1 Soil physico-chemical propert ties relative to type of forest(mean ± SD)
2.2 不同林分土壤细菌16S rRNA基因与固碳细菌cbbL基因丰度特征
采用荧光实时定量PCR分析,4种林分土壤细菌16S rRNA基因和固碳细菌cbbL基因丰度结果表明(图1)细菌丰度在 5.40×1010~2.81×1011copies·g–1干土之间(图1a),固碳细菌丰度在 4.55×108~3.53×109copies·g–1干土之间(图1b)。毛竹林土壤 2种基因丰度在表层、亚表层土壤中均位于四种林分之首,且显著高于其他三种林分(P<0.05),而其他三种林分细菌数量无显著差异,固碳细菌马尾松林显著高于其他两种林分(P<0.05)。4种林分土壤cbbL与16S rRNA基因丰度的比值结果为亚表层略高于表层(图1c);两层土壤比值最高的是马尾松林,其次为毛竹林,马尾松林显著高于阔叶林和杉木林(P<0.05)。
随着中西文化交流的日益频繁,文化负载词的翻译对于促进中西方各国之间的友好交流具有重要意义。研究中国文化负载词,尤其是中国文学中的文化负载词的翻译,可以使西方读者更全面地了解中国传统文化,对当代中国人的生活哲学形成更直观的认识。有鉴于此,笔者以Kathy Mok的《盗墓笔记》第一册的英译本Cavern of the Blood Zombies为对象,结合相关理论,着重探讨了文化负载词的翻译方法。
2.3 不同林分土壤固碳细菌基因丰度与理化因子的关系
为揭示土壤理化性质对不同林分土壤细菌 16S rRNA和固碳细菌cbbL基因丰度的影响,分别以林分和土层为单位,将基因丰度与对应土壤理化性质进行相关性分析,结果表明,细菌和固碳细菌丰度与理化性质相关性总体较差(表2)。在不同林分中,只有阔叶林土壤的2种基因丰度与有效磷呈显著正相关(P<0.05),马尾松林土壤的cbbL基因丰度与pH、速效钾呈显著正相关(P<0.05);在不同土层中,表层及亚表层土壤的两种基因丰度均与 pH呈显著正相关(P<0.05)。
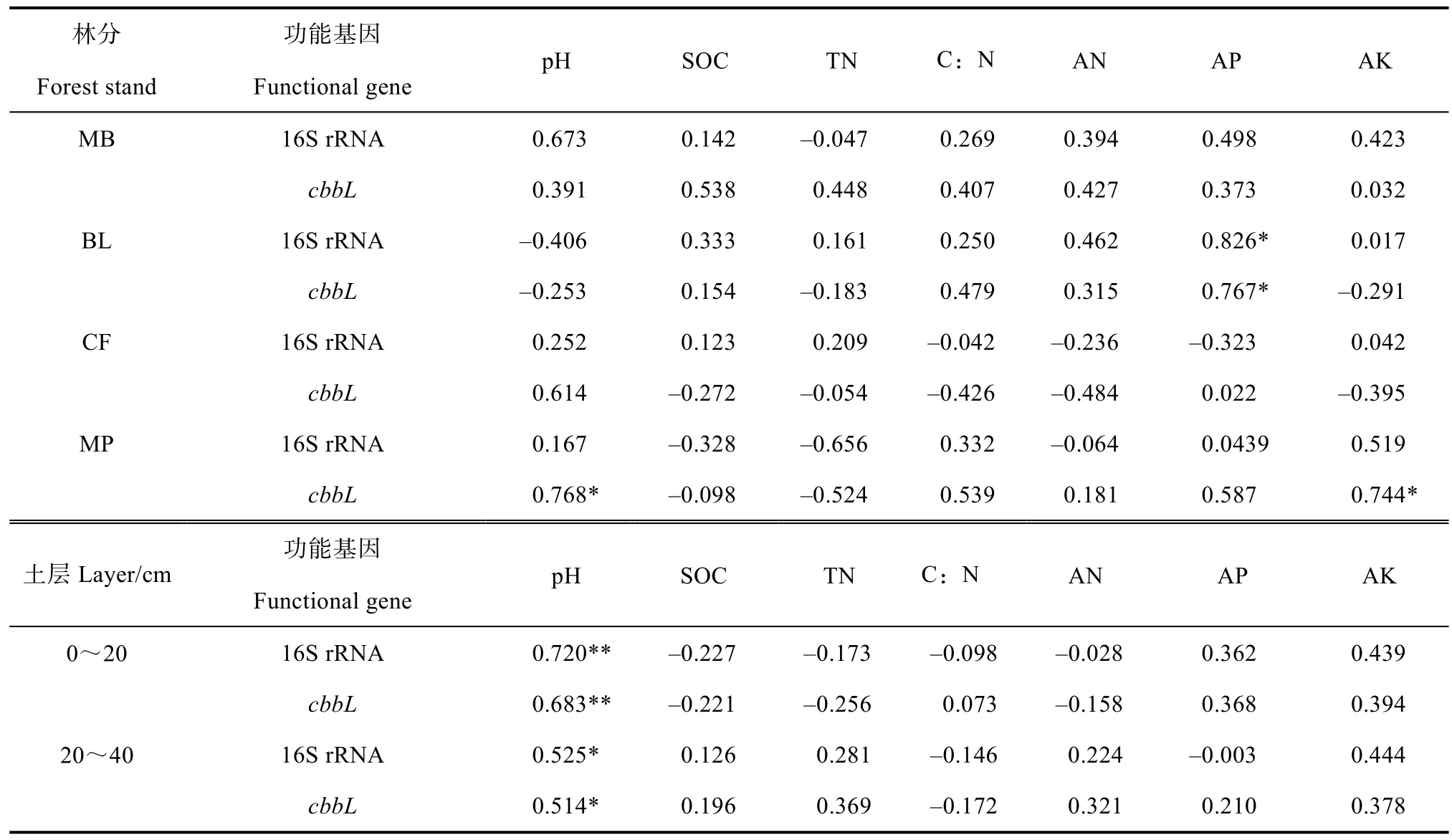
表2 土壤细菌16S rRNA和固碳细菌cbbL基因功能基因与环境参数之间的皮尔逊相关系数Table 2 Pearson’s correlations(r)of 16S rRNA and cbbL genes abundance with environmental parameters
2.4 不同林分土壤固碳微生物α多样性比较
对4种林分土壤固碳细菌进行高通量测序,毛竹林、阔叶林、杉木林和马尾松林表层土壤分别测得36 598、33 599、35 093和35 129条序列,亚表层土壤测得32 552、33 783、30 381和38 502条有效序列,将测序结果在97%相似度下进行聚类得到OTU的代表序列,并与NCBI数据库比对进行物种注释,置信度阈值设为0.8,认为测序深度已经基本覆盖到样品中所有的物种。经比对鉴定得到4个门、6个纲、12个目、20个科、35个属、40个种的土壤固碳细菌群落信息。
基于 OTU的α多样性指数可反应土壤固碳细菌群落结构的多样性。从表层土壤固碳细菌α多样性 4个指标看(表3),杉木林所有指标最低,且均显著低于其他 3种林分(P<0.05),说明杉木林土壤固碳细菌的物种丰富度及多样性极差。亚表层土壤不同林分之间仅香农指数存在差异,其中马尾松林最高、杉木林最低,两者之间存在显著差异(P<0.05)。马尾松林的所有指标值均为最高,说明马尾松林亚表层土壤固碳细菌的物种丰富度及多样性最高。同一林分不同土层之间的差异结果表明,杉木林土壤亚表层的所有指标都显著大于表层(P<0.05),双因素检验结果表明,林分及土层对4种α多样性指标均达到了显著影响(P<0.05),而两因子交互作用仅对香农指数与辛普森指数有显著影响(P<0.05),且数值小于各单因子,说明两个因子对土壤固碳细菌α多样性影响不同步、甚至相反。
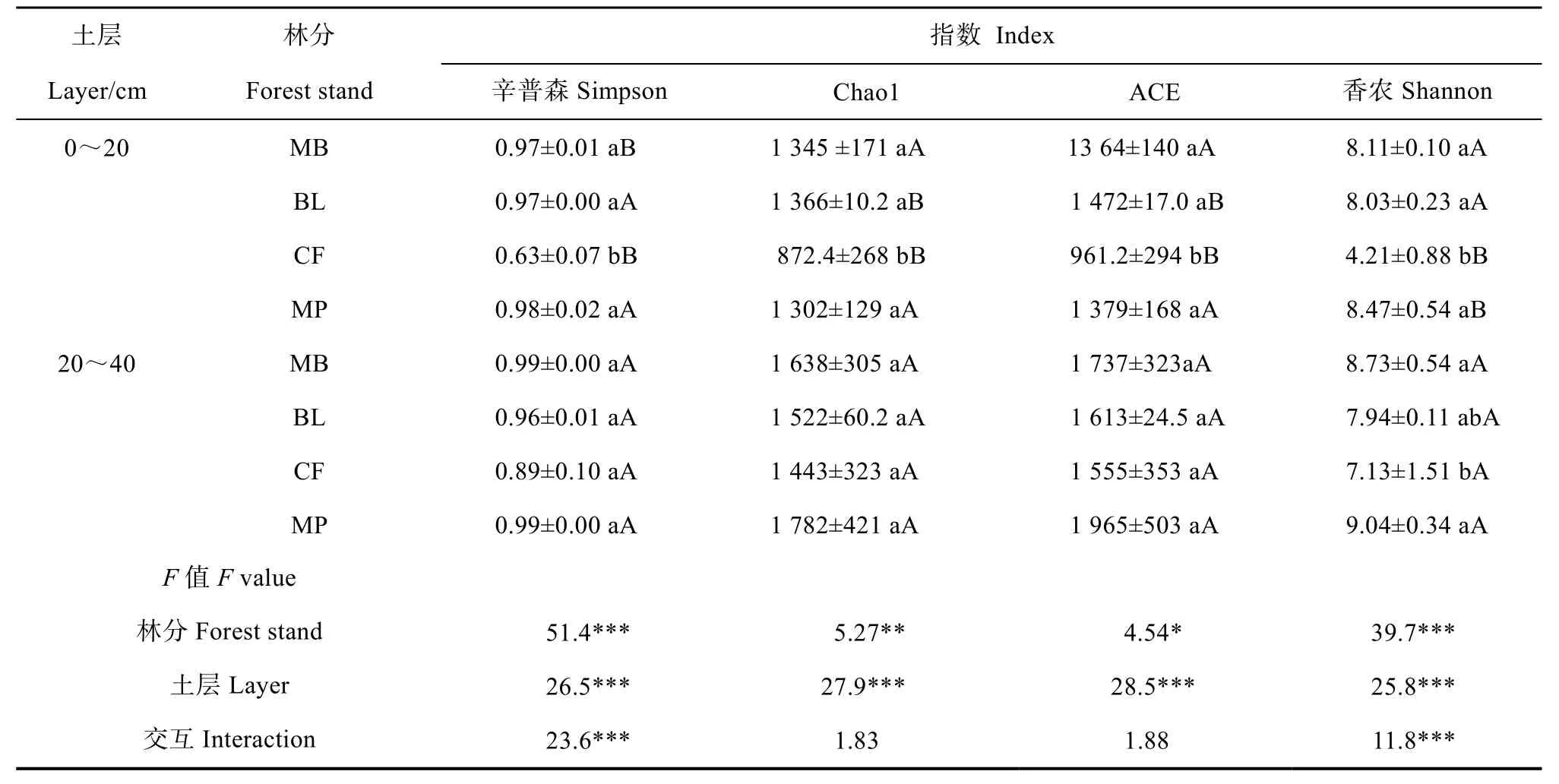
表3 不同林分土壤固碳细菌cbbL基因多样性指数统计表(均值±标准差)Table 3 CbbL gene diversity of carbon sequestrating bacteria relative to forest stand(mean ± SD)
2.5 不同林分土壤固碳细菌群落相似性比较
为分析4种不同林分土壤固碳细菌群落组成的差异,以固碳细菌OTU种类数为依据,对其分组构建韦恩图分析不同处理之间的“相似关系”(图2)。图2a结果表明,天然林(阔叶林和马尾松林)土壤固碳细菌明显高于人工林(毛竹林和杉木林),但毛竹林土壤固碳细菌群落组成特异性强,与其他几种林分的差异最大;4种林分在表层土壤中共有 OTU只有28个,占固碳细菌总OTU比例仅为0.5%,说明不同林分之间固碳细菌结构差异较大。亚表层土壤固碳细菌特有OTU数量明显低于表层土壤,不同林分之间的差异没有表层明显。这一结果与4种林分亚表层高达151个共有OTU、以及高占比(2.8%)结果吻合。综上所述,杉木林表层和亚表层土壤固碳细菌的物种数最低,亚表层土壤固碳细菌特有OTU数量大于表层,但表层土壤特有OTU数量及其占比则明显高于亚表层,尤其是毛竹林和杉木林土壤,说明不同林分表层土壤固碳细菌特异性强。
2.6 不同林分土壤固碳细菌群落物种组成
在属分类水平上(图3),表层土壤中的毛竹林和杉木林,分属于变形菌门(Proteobacteria)的甲基化石油杆菌属(Methylibium)占比分别高达55.1%、70.85%,为绝对优势菌属;分属于放线菌门(Actinobacteria)的诺卡菌属(Nocardia)为次要优势菌属,分别占 21.6%、7.75%;与之相反,阔叶林和马尾松林的诺卡菌属比例高于毛竹林和杉木林,分别占 29.65%、26.25%,而甲基化石油杆菌属分别占28.15%、5.15%;变形菌门的红长命菌属(Rubrivivax)占比仅次于诺卡菌属也是优势菌属。在亚表层土壤中,毛竹林土壤诺卡菌属为优势菌属(33.80%),其次为放线菌门的假诺卡氏菌属(Pseudonocardia)(19.86%);杉木林土壤甲基化石油杆菌仍属优势菌群(38.6%)、其次诺卡菌属(20.1%);阔叶林与马尾松林的诺卡菌属分别占28.86%、28.26%,甲基化石油杆菌占 28.76%、6.16%;4种林分土壤的假诺卡氏菌属均高于表层土壤。结果进一步表明土壤固碳细菌在人工林与天然林上具有较大差异。
2.7 固碳细菌群落结构与环境因子的冗余分析
为分析 4种林分土壤理化因子对土壤固碳细菌群落结构的影响,选取表层及亚表层土壤具有代表性的优势菌属(聚类大于1%)为物种变量、土壤理化性质为环境变量进行冗余分析,根据蒙特卡罗检验,选取影响较大的环境因子分析。结果表明,表层土壤第一排序轴和第二排序轴分别解释了34.4%和20.7%的变异(图4a),4种林分样品分散于坐标的4个象限中,说明4种林分土壤固碳细菌的结构差异明显,分布在第一排序轴左侧的毛竹林和杉木林与右侧的阔叶林和马尾松林之间差异明显。第一排序轴与土壤有效磷呈正相关,与pH和全氮呈负相关;第二排序轴与pH、全氮、有效磷成呈正相关。土壤pH(F=4.152,P=0.048)、全氮(F=9.084,P=0.01)有效磷(F=7.317,P=0.01)对土壤固碳细菌属水平达到显著影响。
根据蒙特卡罗检验,选取亚表层土壤中(图4b)影响较大的3个环境因子分析,结果表明,第一排序轴和第二排序轴分别解释了77.7%和3.7%的变异。第一排序轴上的群落结构与 pH呈正相关,与有机碳、有效磷呈负相关;第二排序轴与 pH呈负相关,与有机碳、有效磷呈负相关;土壤pH(F=2.574,P=0.044)达到显著水平,但有效磷(F=2.558,P=0.0560)、有机碳(F=1.882,P=0.154)未达到显著水平。
3 讨 论
3.1 不同林分土壤细菌与固碳细菌基因丰度差异及其原因分析
通过 qPCR分析亚热带典型森林植被土壤微生物16S rRNA基因与cbbL基因拷贝数得知,亚热带森林土壤中存在相当数量的土壤细菌与固碳细菌,对土壤碳汇贡献较大。本研究中 4种林分土壤 16S rRNA基因与cbbL基因数量普遍高于其他学者在湿地[15]、稻田[22]、旱地[23]、盐沼地[27]的研究结果。一般而言,土壤有机质与细菌的数量呈正相关[28],森林中凋落物的分解、积累与补充速率远高于农田生态系统,森林土壤丰富的有机质为细菌(包括固碳细菌)的生长繁殖提供能量和养分。土壤固碳细菌是一类利用 CO2而非有机碳为碳源的自养微生物[29],土壤固碳细菌以兼性自养微生物为主[30],说明其还可同时利用有机碳作为碳源,有机质分解产生的CO2亦可为其提供底物。4种林分土壤固碳细菌占总细菌的比值(0.91%~2.24%)与相同气候带稻田[22]、旱地[23]相差不大,说明土地利用方式、生态类型、气候区域等对土壤总细菌和固碳细菌丰度影响是同步的。
不同生态系统因为土壤环境因子的巨大差异导致土壤固碳细菌丰度差异[22,27],本研究4种林分土壤发育于同一母质,土壤基础理化性质一致,但由于不同植物对养分的选择性吸收、根系分泌物与凋落物分解差异进而影响土壤性质[16,19]。因此,4种植被长期生长导致其林下土壤性质差异显著(表1)。4种林分之间土壤固碳细菌基因丰度和总细菌丰度存在差异,毛竹林最高、阔叶林最低,毛竹林土壤显著高于其他3种林分,推测毛竹林土壤具有较强的固碳潜力,对土壤碳汇贡献较大。在天目山毛竹入侵阔叶林的研究中同样观察到阔叶林土壤固碳细菌基因丰度显著低于毛竹林的结果[31]。毛竹林地下竹鞭系统极其发达、根系分泌物丰富、老鞭死亡腐烂、凋落物易降解等为土壤提供大量碳源和养分。通常认为,土壤有机碳水平与固碳细菌丰度正相关[13],土壤养分水平高对微生物生长有利[32],本研究中毛竹、杉木与马尾松林均符合此规律;然而,阔叶林表现异常,土壤有机碳含量和养分水平最高、固碳细菌丰度却最低,说明本研究的4种土壤有机质含量不是影响16S rRNA与cbbL基因的最主要因素。虽然土壤固碳基因丰度与有机碳非正相关的结果也有报道,如西北干旱地区不同植被土壤有机质差异显著却并未引起土壤固碳细菌丰度明显差异[23],可能是因其土壤缺水限制其他因子作用,但本研究区降水充沛,为何土壤有机碳和养分含量丰富的阔叶林却出现基因丰度最低现象似乎难以解释。基因丰度与土壤理化性质的相关性分析(表2)表明阔叶林土壤有效磷是影响其基因丰度的重要因子,但尚无法解释阔叶林土壤基因丰度最低的结果;表层及亚表层土壤的两种基因丰度均与 pH呈显著正相关(P<0.05)的结果也许可解释阔叶林的异常现象。大空间尺度下土壤 pH是影响微生物多样性的关键因子,在一定范围内pH与细菌多样性呈正比[19,22]。pH会间接影响有机质分解和养分释放,从而导致对生境变化较敏感的微生物种群丰度发生变化,同时提高某些有害金属元素如铝、锰等活性,对生物造成危害[32];高浓度 H+会抑制细菌生长[33],较低的pH还会改变营养元素的形态等[34]。综观文献报道可知,土壤理化性质对基因丰度的影响比较复杂[30-31],有时候几种因子的作用可能相互抵消从而掩盖某项或几项土壤理化性质与基因丰度的密切关系,尤其是对于土壤理化性质差异不悬殊、且样本数量不大的情况,基因丰度与理化性质之间的相关性更加难以达到显著水平。因此,不同研究者所选择的对象不同,难以获得驱动土壤固碳细菌变化因子的一致规律。
3.2 不同林分土壤固碳细菌群落多样性和结构差异及其环境驱动因子分析
对固碳细菌功能基因cbbL进行高通量测序,全面分析了4森林植被土壤固碳细菌的群落结构与多样性特征。α多样性主要关注局域均匀生境下的物种数目,适合本研究固碳细菌多样性的描述。由 α多样性指数表(表3)可以推测,杉木和毛竹林土壤固碳细菌存在着明显的优势种群,一方面可能与纯林植被多样性低有关;另一方面是杉木林长期种植分泌出的酚类物对土壤理化性质和微生物产生不良影响[35],而毛竹林的特殊性可能也与其发达的地下竹鞭系统有关。4种林分亚表层土壤多样性均高于表层,类似的结果在棉花和花生等农田土壤也有报道[16],可能与亚表层根系密集分布、丰富的根系分泌物和呼吸产生大量CO2有利于固碳细菌生长繁殖有关。
不同林分之间固碳细菌丰度和多样性差异的根本原因是群落结构不同,从韦恩图结果显示的林分之间差异(图3),毛竹林土壤固碳细菌群落组成特异性强、与其他几种林分的差异最大;杉木林土壤固碳细菌丰富度最低;而阔叶和马尾松林土壤虽然OTU总数多,但特有OTU比例却最少,说明两者土壤固碳细菌种类丰富。李永春等[36]利用DGGE对4种林分土壤氨氧化细菌菌群落结构研究发现,林分之间的相似关系与本研究完全不同。虽然固碳细菌和氨氧化细菌均属于细菌,但固碳细菌是指所有自养细菌的总称,种类多,而氨氧化细菌是特殊生理功能的群体,种类少,因此其对环境变化的响应不同。
本研究中4种林分表层土壤占绝对优势的甲基化石油杆菌属,在桂林毛村岩溶的岩溶区农田土壤中为第二优势属[37],甲基化石油杆菌属是杉木林的绝对优势种群,表层土壤中占比高达70.85%,马尾松林则占比最低(38.60%);优势属的明显差异可能受到植物凋落物以及根系分泌物的影响较大。红长命菌属在阔叶林、马尾松林中大量存在,但在毛竹林与杉木林却极少发现,可能该菌与自然林中的某些植物有关。土壤性质对固碳细菌群落结构差异的影响是主要原因[13],从 RDA结果判断驱动土壤固碳细菌变化的因子发现(图4),表层土壤固碳细菌群落结构受有效磷、全氮、pH影响;丰富的氮、磷营养塑造了阔叶林表层土壤固碳细菌群落结构特征,较高的氮素水平和 pH则是形成毛竹林土壤固碳细菌群落结构主要因素,其他林分依次类推。亚表层主要受有机碳、有效磷、pH调控,虽然4种林分在坐标图中的分布区沿逆时针旋转90度,但驱动不同林分土壤固碳细菌群落结构形成的环境与表层土壤基本一致,土壤 pH对毛竹和杉木土壤固碳细菌结构形成密切相关。虽然不同研究者得到的驱动土壤固碳细菌群落结构变化的主要因子不尽相同,但土壤pH是较为一致的驱动因子[14,30]。
4 结 论
毛竹林、阔叶林、杉木林和马尾松林4种森林植被土壤中均存在相当数量的细菌及固碳细菌,其中毛竹林显著高于其他3种林分,阔叶林土壤有效磷以及不同土层的 pH分别与对应的细菌与固碳细菌基因丰度显著相关。杉木土壤固碳细菌多样性显著低于其他3种林分;双因子分析显示,林型、土层之间均存在显著差异。4种林分土壤固碳细菌群落结构与农田、草地和海洋等生态系统有较大差异,甲基化石油杆菌属和诺卡菌属为4种林分共同的优势菌属;毛竹和杉木两种人工林土壤固碳细菌群落结构组成较为相似。RDA结果显示,不同林分土壤pH、有机碳、有效磷、全氮差异是驱动土壤固碳细菌群落特征形成的主要因素。毛竹林土壤肥力最好,固碳细菌丰度最高,不同林分之间土壤微生物对土壤有机质的积累的贡献存在差异,确切定量结论有待进一步研究。

