SIRPα工程化外泌体阻断CD47/SIRPα信号轴研究
关新刚,王明月,穆业腾,郭 冲
(北华大学医学技术学院,吉林 吉林 132013)
免疫检查点(Immune checkpoint)是一类在免疫细胞表面表达的起负性调控作用的受体分子[1].在正常生理状态下,免疫检查点发挥防止免疫过激引发的自身损伤作用.在肿瘤发生发展过程中,肿瘤细胞通过高表达免疫检查点配体分子逃避免疫系统的监视与攻击[2].信号调节蛋白α(signal regulatory protein-α,SIRPα)是表达在巨噬细胞、树突细胞等髓系细胞表面的吞噬信号检查点,CD47分子与其结合后发出“别吃我”信号,阻止巨噬细胞吞噬作用[3].肿瘤细胞通过高表达CD47分子,利用CD47/SIRPα信号轴使肿瘤逃避吞噬及T细胞活化,是造成肿瘤免疫逃逸的重要因素之一[4].
研究[5]显示:CD47分子在多种恶性肿瘤细胞表面高水平表达,与癌症患者的不良预后密切相关,提示靶向干扰CD47/SIRPa信号轴可能成为有前景的治疗策略.目前,CD47单克隆抗体、SIRPa单克隆抗体、SIRPa-Fc融合蛋白等已被批准进入临床实验并初步显示出良好的疗效[6-8].
外泌体是细胞衍生的纳米囊泡,参与细胞间的物质运输与信息传递,具有良好的稳定性、生物相容性、渗透性以及低免疫原性[9].利用基因工程方法对细胞膜蛋白基因改造可以制备表面表达功能性蛋白的外泌体,从而赋予外泌体新的功能[10-11].此外,外泌体还可以作为小分子或核酸药物的递送载体将其递送至特定类型的细胞或组织,以实现靶向药物递送[12-14].本研究中,我们制备分离了表面表达SIRPα受体的外泌体,以探讨SIRPα外泌体的细胞相容性,并分析SIRPα外泌体与B16F10细胞的结合及对CD47/SIRPα信号通路的阻断作用.
1 材料与方法
1.1 细胞系和主要试剂
稳定表达SIRPα-GFP融合蛋白的HEK293T细胞系由北华大学医学技术学院实验室构建;NIH3T3细胞由北华大学医学技术学院实验室保存;蛋白分子量标准品、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)及ECL底物显色试剂盒(上海碧云天生物技术有限公司);凝胶成像系统、蛋白电泳和转膜系统(Bio-Rad公司,美国);倒置荧光显微镜(LifeTechnology公司,美国);全自动多功能酶标仪(TECAN公司,瑞士);纳米粒度及Zeta电位分析仪(Microtrac Nanotrac WaveⅡ,美国).
1.2 外泌体分离
稳定表达SIRPα-GFP融合蛋白的HEK293T细胞系置于含有10%胎牛血清的DMEM培养基中,在37 ℃、5% CO2的培养箱中培养.细胞生长至80%时进行饥饿处理,弃去培养液,PBS清洗两次,加入不含血清的培养基中,饥饿培养48 h后收集上清液,将含有外泌体的培养基依次300 g离心10 min、2 000 g离心10 min和10 000 g离心30 min,以去除细胞碎片和其他细胞成分.通过0.22 mm孔过滤器过滤后,将过滤的上清以35 000 r/min超速离心2 h.将获得的外泌体重悬于含有蛋白酶抑制剂(Roche)的PBS中,并使用BCA蛋白测定试剂盒(Bio-Rad)检测分离的外泌体蛋白质浓度.
1.3 外泌体的表征与鉴定
将外泌体重悬于PBS中,应用纳米粒度及Zeta电位分析仪测定外泌体的粒径;取一滴外泌体,悬液滴加在铜网上,室温静置等待10 min;用滤纸小心吸干铜网边缘多余的液体,再将磷钨酸滴加在铜网的表面,室温静置等待1 min;用双蒸水冲洗过量的染液,等待晾干,透射电子显微镜拍照.
用蛋白裂解液冰上裂解外泌体30 min.取30 μg总蛋白经12% SDS-PAGE凝胶分离,25 V恒压14 min转移到PVDF膜上.PVDF膜用含有5%脱脂奶粉的TBST封闭液室温封闭2 h,与稀释后的SIRPα一抗(1∶1 000稀释)及Na+/K+ATPase一抗(1∶1 000稀释)在4 ℃摇床孵育过夜.过夜后的PVDF膜用TBST清洗3次,每次10 min,再与羊抗鼠二抗(1∶1 000稀释)室温孵育2 h,经TBST洗膜3次,10 min/次.膜置于显影仪曝光板上,将特超敏ECL化学发光试剂盒(BeyoECL Star)中的A液和B液按1∶1混合,覆盖到膜上,曝光30 s,拍摄图像,若在相对分子质量83 000附近有清晰条带出现则提示分离的外泌体上存在SIRPα-GFP融合蛋白的表达.
1.4 细胞相容性分析
将NIH3T3细胞以每孔5×103个细胞接种于96孔板中过夜培养后,向每孔内加100 μL不同浓度的SIRPα外泌体(终浓度为5、10、20、50、75和100 μg/mL),继续孵育48 h;每孔加入20 μL MTT,在培养箱中孵育4 h后,去孔内液体,再向每孔加入150 μL DMSO,然后将96孔板放置于振荡器中振荡,待沉淀完全溶解后,使用酶标仪测490 nm处的吸光度值,每组实验设置5个平行孔.通过软件GraphPad Prism 5作图,确定各组的相对细胞存活率,进而评估外泌体的细胞相容性.
1.5 细胞内吞研究
将圆形玻璃片用蒸馏水清洗干净,在无水乙醇浸泡过夜后,用蒸馏水再次清洗,高压灭菌后置于24孔板底部,每孔加入500 μL细胞培养基(含10% FBS的DMEM培养基),将B16F10细胞以6×104个/孔接种于孔板内,在培养箱中培养12 h,弃去培养基后每孔加入用基础培养基稀释的浓度为100 μg/mL的外泌体(DIO染色)、SIRPα外泌体各300 μL,在细胞培养箱中培养4 h.4 h后弃去培养基后用PBS洗3次,加300 μL 4%多聚甲醛,37 ℃固定20 min;弃去孔内液体并清洗后,加入300 μL DAPI(终浓度为1 μg/mL)染色液对细胞核进行染色,37 ℃染色10 min;再用PBS洗3次后,取洁净的载玻片,滴加少量抗荧光淬灭封片剂,将细胞爬片覆盖在载玻片上,并用指甲油封片,避光保存,荧光显微镜(LifeTechnology)进行成像分析.
1.6 巨噬细胞吞噬实验
分离骨髓来源的巨噬细胞(Bone marrow-derived macrophages,BMDM),将C57BL/6小鼠断颈处死后在75%酒精中浸泡5 min,将皮肤剥离至足部,用剪刀分离股骨与胫骨并置于无菌PBS中,继续去除骨外组织.将剥离干净的股骨与胫骨置于75%酒精中浸泡1 min,用无菌PBS冲洗5次.剪断骨两端,用注射器吸取基础培养基,冲洗骨髓,直至骨头发白,用枪吹打悬液,使细胞尽量匀散,用75 μm滤网过滤3次.1 500 r/min 10 min离心后弃除上清,再在沉淀中加入3倍沉淀体积的红细胞裂解液,室温裂解5 min.1 200 r/min 5 min离心获得骨髓细胞沉淀,用BMEM培养基(终浓度50 ng/mL M-CSF的完全培养基)重悬,以6×106个/mL浓度接种细胞,培养3 d后更换培养基,继续培养4 d再次更换新的培养基.
将上述所制备BMDM用Calcein AM染色,37 ℃ 30 min后用PBS清洗5次;经DiI染色消化后的B16F10细胞用PBS清洗5次,去除残留染料.将染色后的B16F10细胞分别与CD47单抗(终浓度100 μg/mL)、SIRPα外泌体(终浓度100 μg/mL)及巨噬细胞在无血清培养基中共培养,在37 ℃下孵育4 h后,应用胰蛋白酶消化5 min,除去未结合的B16F10细胞,通过共聚焦显微镜观察其吞噬作用.
2 结 果
2.1 SIRPα外泌体的制备
本实验室前期制备了稳定表达SIRPα-GFP的HEK293T细胞系[15],在此基础上通过差异超速离心外泌体,研究外泌体的粒径及形貌特征.动态光散射结果见图 1,外泌体粒径为30~100 nm;透射电镜结果见图2,外泌体在镜下呈现为圆形或椭圆形结构,与文献[16]报道的外泌体特征一致.

图1 SIRPα外泌体的尺寸大小表征Fig.1Size characterization of SIRPα exosomes

图2 SIRPα外泌体的形貌表征(标尺100 nm)Fig.2Structural characterization of SIRPα exosomes
我们随后利用SIRPα单克隆抗体进行了Western blot实验,验证外泌体表达SIRPα分子的情况.结果见图3.SIRPα-GFP稳定表达细胞上清液中的外泌体泳道发现清晰单一的条带,与预计分子量大小一致,而转染空载体的HEK293T细胞培养上清液中制备的外泌体未检测到对应的蛋白条带,提示成功制备了表达SIRPα分子的外泌体.

1.空白外泌体;2.SIRPα外泌体.图3 Western blotting检测外泌体中SIRPα-GFP的表达Fig.3Western blotting analysis of SIRPα-GFP expression in exosomes
2.2 SIRPα外泌体的细胞相容性分析
为了检测SIRPα外泌体的细胞相容性,我们利用MTT法检测不同蛋白浓度的SIRPα外泌体对NIH3T3细胞增殖能力的影响.结果见图4.加入外泌体培养48 h后各浓度外泌体处理组细胞存活率接近或超过100%,说明SIRPα外泌体具有良好的细胞相容性.
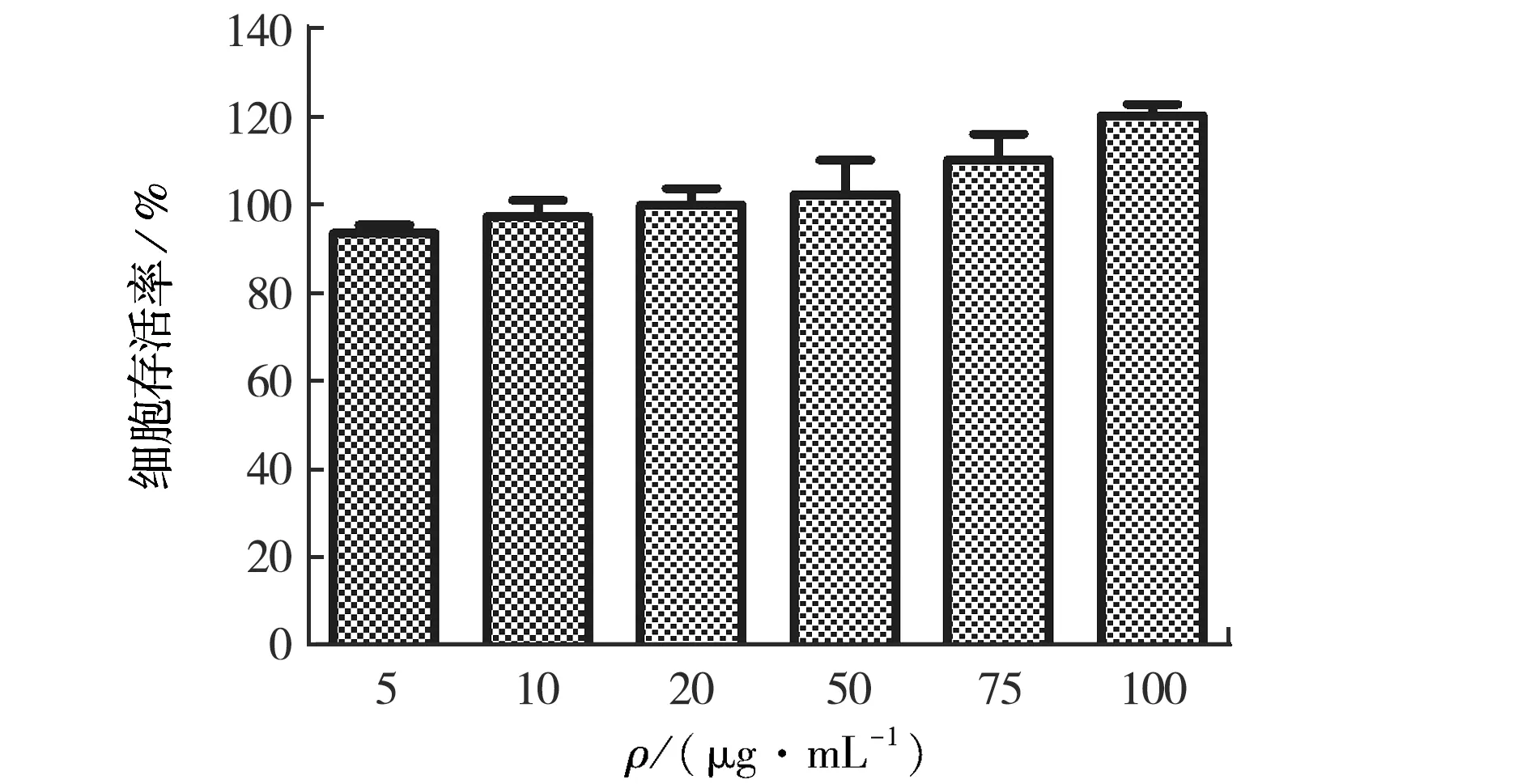
图4 SIRPα外泌体的细胞相容性Fig.4Biocompatibility of SIRPα exosomes
2.3 SIRPα外泌体的细胞内吞
为了研究SIRPα外泌体能否被黑色素瘤细胞内吞,我们利用SIRPα-GFP的绿色荧光检测了外泌体与黑色素瘤细胞孵育后的荧光分布.为了研究SIRPα外泌体与不表达SIRPα的外泌体在细胞分布中的区别,我们使用DiO标记的空白外泌体作为对照.结果见图5.SIRPα外泌体与B16F10细胞共孵育4 h后,在黑色素瘤细胞的胞质区域观察到了亮绿色的荧光,而不表达SIRPα外泌体只有少量荧光分布,且荧光强度显著低于SIRPα外泌体处理组,提示SIRPα外泌体较空白外泌体具有更高的黑色素瘤细胞内吞效率,这可能是由于SIRPα与肿瘤细胞表面的CD47分子结合所介导的结果.
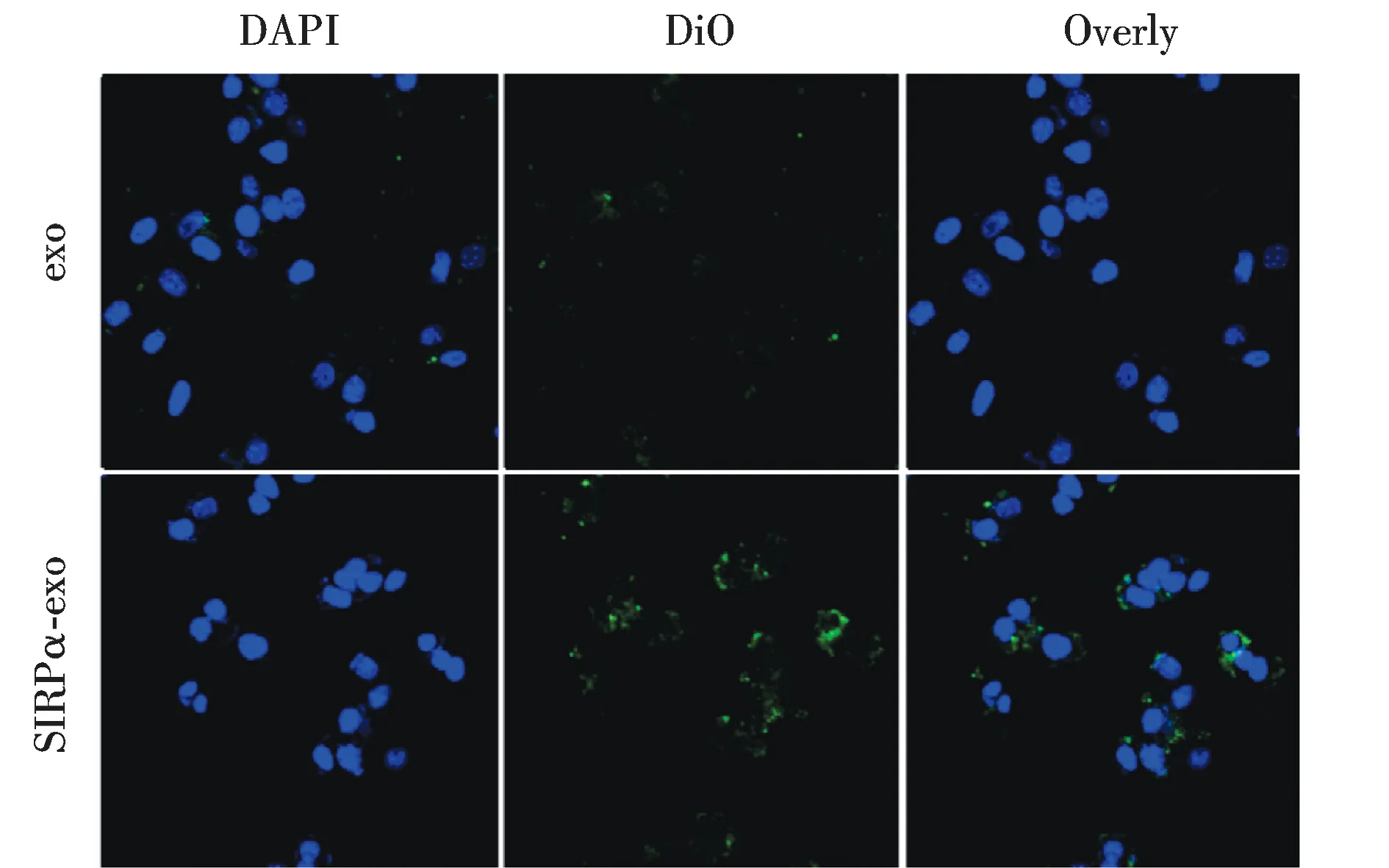
图5 SIRPα外泌体的黑色素瘤细胞内吞Fig.5Cellular uptake of SIRPα exosomes by B16F10 cells
2.4 SIRPα外泌体促进肿瘤细胞吞噬
为了研究SIRPα外泌体与肿瘤细胞表面的CD47结合后能否阻断“别吃我”信号,增强巨噬细胞吞噬肿瘤能力,我们以CD47单抗作为阳性对照检测了SIRPα外泌体对巨噬细胞吞噬肿瘤的影响.将SIRPα外泌体加入BMDM细胞与黑色素瘤细胞B16F10共培养,B16F10细胞和BMDM细胞分别用DiI(红色)和CalceinAM染色(绿色)共培养,分别加入SIRPα外泌体或CD47单抗.结果见图6.阴性对照组只检测到绿色荧光,说明肿瘤细胞未被巨噬细胞吞噬;而SIRPα外泌体与CD47抗体处理组细胞均检测到了红色和绿色荧光共定位产生的黄色荧光,提示SIRPα外泌体与CD47抗体均能够与肿瘤细胞上的CD47分子结合,阻断CD47/SIRPα信号通路介导的“别吃我”信号,促进了巨噬细胞吞噬肿瘤.
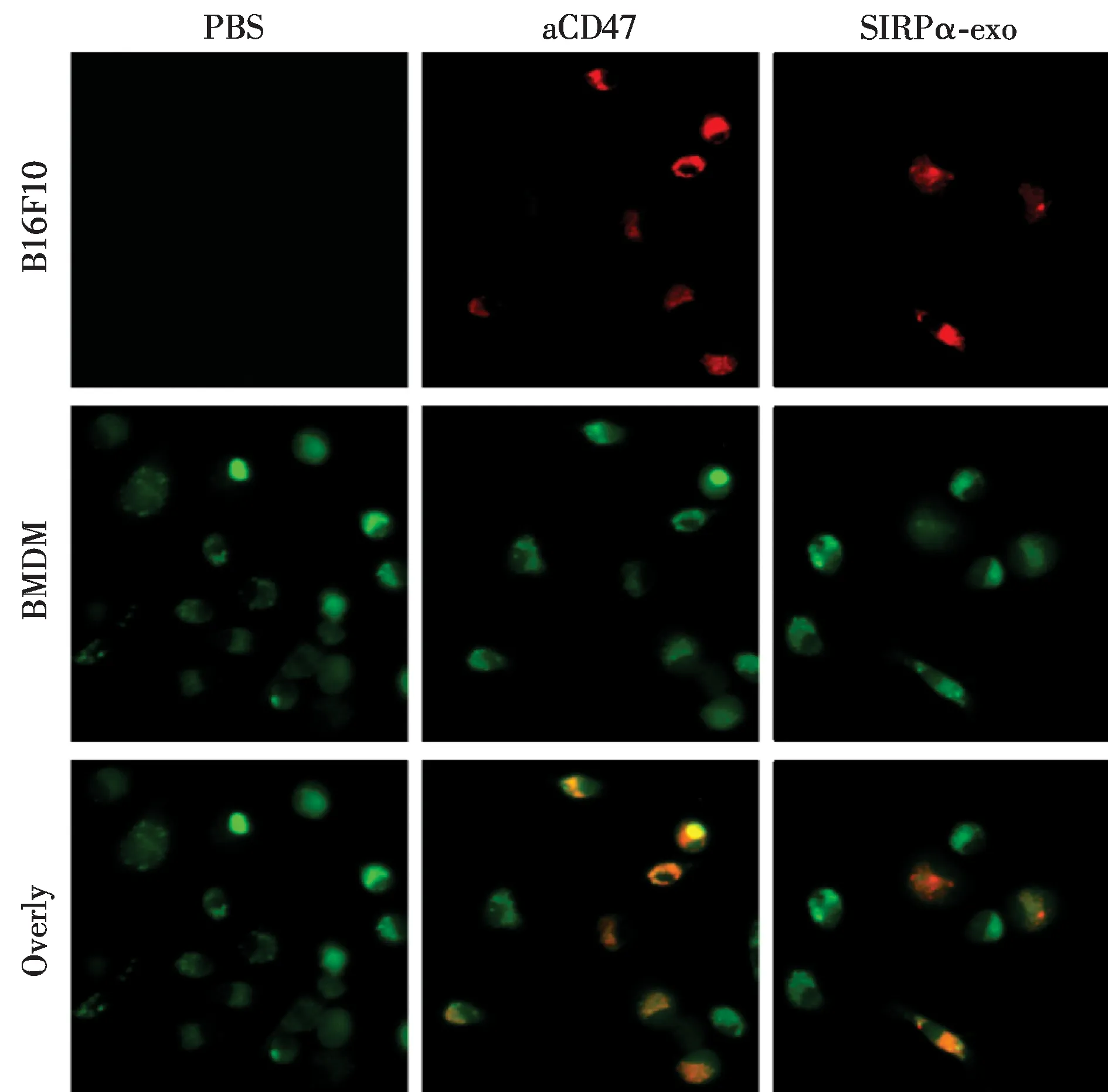
绿:巨噬细胞;红:黑色素瘤细胞.图6 SIRPα外泌体激活巨噬细胞吞噬肿瘤 Fig.6Phagocytosis of tumor cells by macrophage mediated by SIRPα exosomes
3 讨 论
靶向巨噬细胞的癌症免疫治疗已成为一种有前景的治疗策略[17].然而,高效激活巨噬细胞增强机体抗肿瘤免疫应答存在两个关键问题:首先,癌细胞的CD47分子通过与巨噬细胞上SIRPα特异性结合,发出“别吃我”信号,防止巨噬细胞的吞噬作用[18];其次,癌细胞分泌的集落刺激因子等能促使肿瘤相关的巨噬细胞(tumor-associated macrophage,TAM)极化成致瘤性M2表型[19].针对CD47/SIRPα信号轴阻断的单克隆抗体、重组蛋白等药物已经初步显示出良好的效果,开发新型CD47/SIRPα信号轴阻断药物对癌症免疫治疗具有重要意义[20].
外泌体作为细胞自身生成的内源性囊泡近年来在生物医学领域正引起越来越多的关注[21-22].生物工程改造策略为拓展外泌体功能应用奠定了基础[23].在本研究中,我们制备分离表达SIRPα分子的外泌体,其通过破坏CD47/SIRPα信号轴来增强巨噬细胞吞噬肿瘤、激活肿瘤抗原呈递及T细胞活化.SIRPα外泌体不仅具有CD47抗体的肿瘤“别吃我”信号阻断功能,还具有外泌体本身优势,因此,我们预期SIRPα外泌体可能具有较CD47抗体更强的肿瘤抑制效果.
综上所述,本研究成功制备分离了表达SIRPα蛋白的外泌体,SIRPα外泌体具有良好的生物相容性,并且可以被黑色素瘤B16F10高效内吞并分散在细胞质中,SIRPα外泌体能够阻断CD47/SIRPα信号通路,激活巨噬细胞的肿瘤吞噬功能,有望在未来作为新型CD47/SIRPα信号通路阻断剂用于临床癌症治疗.

