乳腺癌类器官共培养技术的建立和优化
周天浩,辛肇晨,杜少倩,曹 源,许静轩,劳曾红,王红霞#
1.上海交通大学附属第一人民医院肿瘤中心,上海 201600;2.复旦大学附属中山医院普外科,上海 200030;3.浙江省德清县人民医院肿瘤科,德清 313216
乳腺癌是女性恶性肿瘤死亡的主要原因,发病率高居女性恶性肿瘤之首,死亡率居第五位。乳腺癌在中国的新发病例占全世界的12.2%,死亡病例占全世界的9.6%,严重危害女性生命健康[1]。乳腺癌是一种具有高度异质性的疾病,具有不同组织类型、分化程度和分子亚型等;同一肿瘤内部又由异质性细胞亚群组成,导致临床预后及治疗反应性差异显著[2]。目前对于乳腺癌的研究主要依赖已建立的可无限传代细胞系,但其难以反映乳腺癌原发灶的真实生物学特征、异质性状态以及肿瘤微环境[3]。人源性肿瘤异体移植模型对解决乳腺癌的生物学复杂性具有一定意义,但其成功率低、成本高、动物饲养周期长,限制了其广泛临床应用[4]。近年来,患者来源类器官(patient-derived organoids,PDO)模型的建立为肿瘤生物学研究提供了方便、可靠的途径[5]。PDO可以维持原发肿瘤细胞的生物学特性及组织异质性,在验证药物敏感性、鉴定原代细胞基因及染色体突变、构建异种移植动物模型等方面发挥重要作用[6]。但包括乳腺癌在内的实体肿瘤PDO培养还存在培养成功率不高、传代效率低、培养基和培养体系尚需优化等问题。既往研究[7]报道的乳腺癌PDO培养成功率约为60%。Sachs等[8]成功建立了包含100余例乳腺癌的PDO库,培养成功率可达80%,且可传代20代,但其培养和传代方法烦琐,培养成本高,限制了其推广和应用。乳腺癌纤维组织含量高,难以彻底消化,细胞回收率低,消化过久又会损伤细胞活性。既往研究[9-10]报道,乳腺癌组织消化大多采用Ⅰ型、Ⅲ型和Ⅳ型胶原酶,究竟哪种消化效果更优目前尚无定论。如何进一步改进培养方法、提高培养效率和降低培养成本是目前乳腺癌PDO培养亟需解决的问题。
肿瘤相关成纤维细胞(cancer associated fibroblasts,CAFs)在乳腺癌发生、发展和耐药中发挥重要调控作用[11]。肿瘤上皮细胞和成纤维细胞体外共培养模型的探索也备受重视。Truong等[12]使用微流体培养系统共培养患者来源CAFs和乳腺癌细胞系,研究CAFs对肿瘤细胞侵袭和迁移的影响;Nayak等[13]利用生物可降解多聚内酯的3D支架培养CAFs,并研究原代培养的乳腺癌细胞与CAFs释放的细胞外基质的交互作用。然而以上模型培养体系复杂,日常操作不易实现,且均未见PDO和患者来源CAFs的直接共同培养。既往报道的乳腺癌PDO的培养模型几乎不含成纤维细胞,也无法真实反映肿瘤内微环境的复杂状态及相互调控[14]。因此在PDO培养中引入CAFs,可以更好地还原真实肿瘤内环境,为研究肿瘤和间质细胞的相互作用提供便利。
基于此,本研究根据乳腺癌组织的纤维化特征,选用不同种类胶原酶消化处理组织标本,改进组织处理方法;优化PDO培养基成分和传代方法,建立CAFs和PDO共培养体系,以期为乳腺癌基础及转化研究提供良好的体外模型。
1 材料与方法
1.1 组织标本、主要试剂及仪器
1.1.1 组织标本 58例乳腺癌患者组织标本均来自上海交通大学附属第一人民医院。患者均签署知情同意书。研究获得上海交通大学附属第一人民医院伦理委员会批准(#2018KY153)。
1.1.2 主要试剂 细胞培养添加剂B27、p38抑制剂SB-202190、Ⅰ型胶原酶、Ⅲ型胶原酶、Ⅳ型胶原酶购自美国Sigma,4%多聚甲醛、DNA酶Ⅰ、CCK8试剂购自碧云天,胎牛血清(fetal bovine serum,FBS)购自巴西Gibco,磷酸盐缓冲液(phosphate buffer solution,PBS)、改进型DMEM/F12细胞培养基、DMEM高糖细胞培养基、牛血清白蛋白(bovine serum albumin,BSA)、胰蛋白酶、TrypLE消化酶、谷氨酰胺、细胞恢复液、青霉素-链霉素溶液(双抗)购自美国Gibco,rho相关卷曲螺旋形成蛋白激酶(rho-associated coiled-coil forming kinase,ROCK)抑制剂Y-27632购自美国Abmole,R-脊椎蛋白1(R-spondin-1)重组蛋白、noggin重组蛋白由本实验室自制,神经调节蛋白1(neuregulin 1,NRG1)重组蛋白、成纤维细胞生长因子7(fibroblast growth factor 7,FGF7)、FGF10、表皮生长因子(epidermal growth factor,EGF)购自美国Peprotech,转化生长因子β(transforming growth factorβ,TGF-β)抑制剂A83-01购自英国Tocris,N-乙酰半胱氨酸、烟酰胺、4-羟乙基哌嗪乙磺酸(HEPES)缓冲液、原代细胞抗生素购自美国Invitrogen,免疫组织化学试剂盒购自中杉金桥,多色免疫荧光试剂盒购自美国Akoya,基质胶购自美国R&D。钙黏蛋白1(cadherin 1,CDH1)抗体、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体、角蛋白18(cytokeratin 18,CK18)抗体、成纤维细胞活化蛋白α(fibroblast activating proteinα,FAP-α)抗体购自美国Abcam(货号ab76055、ab52218、ab133263、ab207178),肿瘤相关钙信号换能分子2(tumor associated calcium signal transducer 2,TROP2)抗体购自美国EMZO(货号ENZO-ABS-380),雌激素受体(estrogen receptor,ER)抗体、孕激素受体(progesterone receptor,PR)抗体、人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)抗体、上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM/TROP1)抗体购自中国Proteintech(货 号21244-1-AP、25871-1-AP、18299-1-AP、21050-1-AP)。
1.1.3 主要仪器 光学显微镜(Nikon,日本),荧光显微镜(ZEISS,德国),低温高速离心机(Eppendorf,德国),CytoFLEX流式细胞仪(Beckman Coulter,美国),石蜡切片机、CO2培养箱、超净工作台(Thermo Scientific,美国)。
1.2 实验方法
1.2.1 PDO的处理和培养 将手术切除的乳腺癌组织剪碎至直径小于1 mm;加入PDO消化液(改进型DMEM/F12+1 mg/mL胶原酶+300µg/mL DNA酶Ⅰ+2µmol/L Y-27632+双抗),37℃摇床消化,转速50 r/min;20 min后取出振荡至组织散开,再放回37℃摇床消化20 min;加洗涤液(改进型DMEM/F12+2µmol/L Y-27632+0.5%BSA+双抗)终止消化,用力振荡,70µm滤网过滤细胞悬液,弃胶原残余,细胞悬液4℃、400×g离心5 min;洗涤液重悬,4℃、400×g离心5 min,重复2次,计数,每1×104个细胞加30µL基质胶和30µL PDO培养基。乳腺癌PDO培养基成分如下:谷氨酰胺添加剂glutamax 2 mmol/L,HEPES缓冲液10 mmol/L,双抗100 U/mL,N-乙酰半胱氨酸1.25 mmol/L,EGF 5 ng/mL;noggin重组蛋白50倍稀释使用,R-spondin-1重组蛋白20倍稀释使用,A83-01(0.5 nmol/L)、Y-27632 (5 µmol/L)、SB202190(500 nmol/L)、B27添加剂50倍稀释使用。
对同一患者(n=5)来源的PDO分别采用不同FGF7和FGF10含量的培养基进行培养。首先考察不同FGF7和FGF10的含量对PDO培养的影响,将细胞分为3组:高浓度组(5 ng/mL和20 ng/mL)、低浓度组(2.5 ng/mL和10 ng/mL)和未添加组。进一步比较EGF含量对PDO培养的影响,实验分为高浓度组(5 ng/mL)、低浓度组(2.5 ng/mL)和未添加组。
1.2.2 细胞活性检测 收集不同胶原酶处理的乳腺癌细胞,计数。取5×104个细胞,离心,弃上清液,100µL PBS重悬,按1∶1 000加入4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI),4℃避光孵育30 min,离心,弃上清液,加入500µL PBS重悬,离心,重复2次。200µL PBS重悬,流式细胞仪分析DAPI阳性率和阴性率。
1.2.3 PDO传代 选择2种传代方法。方法①:4℃、400×g离心5 min;细胞恢复液重悬,冰上消化30 min;4℃、400×g离心5 min,弃上清液;加入洗涤液重悬,4℃、400×g离心5 min;加入TrypLE消化酶,反复吹吸,37℃消化5~10 min,每2~3 min取出摇匀,放回37℃继续消化,并在显微镜下观察,细胞消化成絮状或者单个为止,一般不超过10 min。方法②:4℃,使用较高转速900×g,离心5 min;弃上清液,并吸去上层基质胶,加入TrypLE消化酶,反复吹吸,后续过程同方法①。上述2种传代方法分别完成后,按照以下步骤处理:4℃、400×g离心5 min;加入洗涤液,重悬;4℃、400×g离心5 min;将PDO培养基和基质胶1∶1混合,重悬细胞铺板,37℃、5%CO2培养箱孵育10~15 min。基质胶混合物凝固后加入PDO培养基。
1.2.4 免疫组织化学检测 取500~1 000个PDO三维球体,500×g离心5 min,弃上清液,加入4%多聚甲醛,室温固定过夜。之后梯度浓度乙醇脱水,二甲苯透明1 h,石蜡(温度<50℃)浸泡2次,每次1 h;包埋后连续切片,厚度3µm。对于新鲜标本组织,手术离体后直接取乳腺癌组织块浸泡于甲醛溶液中,进行固定、脱水、包埋和切片。将PDO切片和肿瘤原发灶切片置于65℃烘箱烤30 min,二甲苯脱蜡、梯度浓度乙醇水化,柠檬酸钠抗原修复液高压修复5 min,自然冷却至室温。室温封闭15 min,弃封闭液,一抗4℃孵育过夜。次日弃一抗,分别室温孵育3%过氧化氢、二抗和辣根酶标记链霉卵白素15 min,孵育间隙均用PBS洗涤3次,每次3 min。DAB辣根过氧化物酶显色后,苏木精染核,随后梯度浓度乙醇脱水,二甲苯透明,封片后显微镜下观察。观察指标主要包括阳性细胞内定位、阳性细胞数量和阳性程度。利用Image pro plus软件检测阳性细胞数目,200倍镜下随机取5个视野,采用自动测量的方法,选取阳性染色像素信息,系统自动识别阳性细胞个数,再选取细胞核染色像素信息,系统自动识别细胞总数。阳性率=(阳性细胞个数/细胞总数)×100%。
1.2.5 多色免疫组织化学鉴定 将PDO切片和肿瘤原发灶切片置于65℃烘箱烤30 min,二甲苯脱蜡、梯度浓度乙醇水化,用柠檬酸钠抗原修复液高压修复5 min,自然冷却至室温。室温封闭15 min,弃封闭液,CK18抗体室温孵育15 min,弃一抗,分别孵育二抗和绿色荧光染料,孵育间隙洗涤2次,每次5 min。微波炉抗原修复15 min,自然冷却到室温,封闭,分别孵育α-SMA一抗、二抗、红色荧光染料和DAPI,封片观察。
1.2.6 CAFs的分离和培养 将新鲜乳腺癌组织用剪刀分成体积1~3 mm3的组织块,用CAFs消化液(DMEM+0.1 mg/mL胶原酶Ⅳ+2%双抗)37℃消化过夜,次日加入含有10%FBS的DMEM终止消化,离心,用含有20%FBS的DMEM重悬,铺板。3 d后CAFs可从组织中爬出并贴壁。细胞充分爬出后,用胰酶消化细胞1∶2进行传代。传至第3代,细胞长成形态均一的CAFs。
1.2.7 CAFs的免疫荧光鉴定 将处于生长对数期的CAFs铺在装有细胞爬片的24孔板中。待细胞贴壁后12 h,弃培养基,4%多聚甲醛室温固定30 min;PBS浸洗2次,每次5 min,室温封闭10 min,加入α-SMA、FAP-α一抗,4℃过夜孵育;弃一抗,PBS浸洗3次,每次5 min,加入荧光二抗,室温避光孵育30 min;弃二抗,PBS洗涤2次,每次5 min,擦干玻片后滴加封片剂,倒置于干净的载玻片上。
1.2.8 PDO与CAFs共培养 将处于对数生长期的CAFs用胰酶消化,用含有10%FBS的DMEM终止消化,离心,弃上清液,用PDO培养基重悬,细胞计数;将PDO消化成单细胞后,再次细胞计数,取CAFs和PDO细胞,1∶1混合,离心,用1∶1制备的基质胶和PDO培养基混合液重悬,37℃培养箱放置10 min后,加入乳腺癌PDO培养基培养。
1.2.9 CCK8实验 分别设置PDO单独培养组和PDO+CAFs共培养组,每孔种植5 000个CAFs和PDO细胞,设置3个复孔,分别培养1、2、4、6和8 d。每次小心吸取3D培养的PDO,离心,弃上清液和基质胶,用450µL新鲜PDO培养基和50µL CCK8重悬,37℃培养2 h后用分光光度计测量450 nm处的吸光度值[D(450 nm)]。
1.3 统计学分析
采用GraphPad Prism 8.0软件进行统计分析。定量资料用±s表示,2组间差异比较采用非配对t检验。P<0.05认为差异有统计学意义。
2 结果
2.1 乳腺癌组织单细胞处理体系的改进
根据既往研究[15-17]报道以及乳腺癌自身胶原蛋白的性质,分别选用3种不同胶原酶比较细胞回收效率与细胞活性。收集5例乳腺癌新鲜肿瘤组织,分别以100µLⅠ型、Ⅲ型和Ⅳ胶原酶处理。结果显示,Ⅳ胶原酶在消化40 min后可将乳腺癌组织消化成絮状,而Ⅰ型、Ⅲ型胶原酶处理组均有明显组织剩余。过滤离心后细胞计数,Ⅳ型胶原酶消化得到的细胞数明显多于Ⅰ型和Ⅲ型胶原酶处理组,差异有统计学意义(P=0.045,P=0.017;图1A)。过滤收集单细胞悬液,通过流式细胞仪检测细胞活性,Ⅳ型胶原酶处理组的细胞存活率明显高于Ⅰ型、Ⅲ型胶原酶处理组(图1B、C),差异有统计学意义(P=0.005,P=0.048)。综上,在同等条件下Ⅳ型胶原酶对乳腺癌组织的消化效率最高,对细胞活性保护最好。

图1 不同种类的胶原酶对乳腺癌组织的消化效率和对细胞损伤的对比Fig 1 Comparison of digestion efficiency and cell damageof different types of collagenase in breast cancer tissues
2.2 PDO培养基和传代方式的优化
对同一患者(n=5)来源的PDO,采用不同FGF7和FGF10含量的培养基进行培养,每日观察3组PDO形成数量和直径大小,并在培养的第5日和第10日拍照(图2A)。结果发现,培养第10日FGF7和FGF10添加与否对PDO生成数量(P=0.556,P=0.842)以及三维球体大小(P=0.842,P=0.800)均无显著影响(图2A)。进一步比较不同EGF含量对PDO培养的影响,结果(图2B)发现EGF高浓度组和低浓度组中PDO形成数量和球体直径差异无统计学意义(P=0.225,P=0.719);而与EGF高浓度组和低浓度组相比,EGF未添加组PDO培养成功率明显降低,三维球体生成数量明显减少(P=0.000),且球体直径明显减小(P=0.000)。
为简化PDO细胞传代步骤,提高传代效率,我们基于基质胶和PDO密度不同的原理,采用梯度离心法分离基质胶与PDO的混合物;结果发现,转速在900×g时,基质胶和PDO可以完全分层。吸去基质胶后再用消化酶消化的方法,相比于传统用细胞恢复液消化基质胶和直接用消化酶消化基质胶与PDO的混合物的方法,消化时间缩短,对PDO保护作用更好,传代效率更高。改良传代方法后,PDO仍保持良好状态,且可传代20代以上(图2C)。对58例乳腺癌组织的处理结果显示,采用本研究改进的PDO培养和传代体系,培养成功率达79.3%(46/58)。

图2 PDO培养和传代条件的优化和改进Fig 2 Optimization and improvement of PDO culture and passage conditions
2.3 优化培养后的PDO的鉴定与验证
采用免疫组织化学法检测乳腺癌PDO和原发灶中ER、PR和HER2蛋白的表达情况;结果显示,优化培养后获得的乳腺癌PDO中ER、PR和HER2的表达水平与乳腺癌原发灶基本一致(图3A);定量分析结果显示,各分子表达水平在PDO和原发灶之间的差异无统计学意义(均P>0.05,图3B)。进一步采用免疫组织化学法比较上皮间质转化和乳腺癌干细胞相关指标CDH1、TROP1和TROP2在乳腺癌原发灶及相应PDO中的表达水平;结果显示,同一患者来源PDO和原发灶的CDH1、TROP1和TROP2蛋白表达水平差异无统计学意义(图3C、D)。

图3 PDO的表面分子表达情况和组织学特点Fig 3 Molecular expression and histological characteristics of PDO
2.4 CAFs和PDO共培养体系的构建
PDO三维球体悬浮生长,而CAFs贴壁生长。基于此,本研究将源自同一乳腺癌患者的CAFs和PDO分别培养,待两者体外稳定生长之后,对其进行鉴定,再进行共培养。结果显示,PDO细胞表达腺上皮标志物CK18而不表达成纤维细胞标志物α-SMA(图4A),表明其组成成分主要为乳腺癌肿瘤细胞;而经分离并稳定传代培养的CAFs表达FAP-α和α-SMA,证实了CAFs的存在(图4B)。后续按照1∶1比例将CAFs与PDO混合,发现两者可在同一培养体系中稳定生长,并可传代培养(图4C)。在PDO和CAFs稳定共培养之后,镜下观察PDO的形态,发现与CAFs共同培养的PDO形态更加丰富多样(图4D)。高倍镜下观察PDO具体形态,发现与CAFs共同培养的PDO外形相对不规则,内部可长出多个囊腔(图4E)。
为了探究CAFs对PDO生长状态是否产生影响,本研究比较单独培养的PDO和与CAFs共同培养的PDO的生长速度差别。CCK8实验结果显示,相比较于单独培养的PDO,与CAFs共同培养的PDO细胞生长速度更快,差异有统计学意义(图4F)。
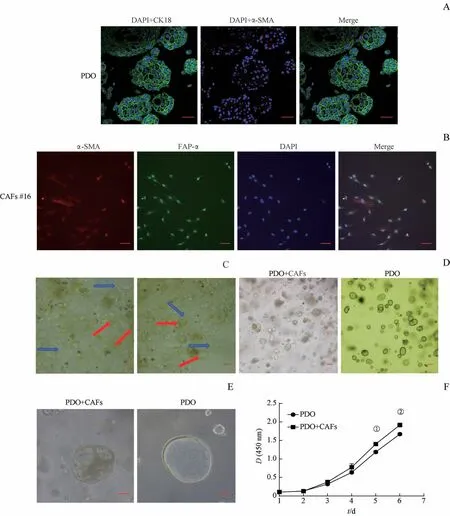
图4 CAFs和PDO共培养体系构建和CAFs对PDO形态异质性以及生长速度的影响Fig 4 Construction of CAFs and PDO co-culture system and influence of CAFs on morphological heterogeneity and growth rate of PDO
3 讨论
随着乳腺癌PDO培养体系的建立,发现其具有细胞系无法替代的功能,在新药研发[18]、基因编辑[19-20]、指定个体化学治疗(化疗)方案制定[21]等方面具有广阔的应用前景。大多数乳腺癌的纤维化程度非常严重,组织质硬,难以彻底消化成单个细胞,而组织未完全消化导致细胞损失较多。乳腺癌的胶原纤维主要由Ⅰ、Ⅲ和Ⅳ型胶原蛋白组成[22],Ⅰ、Ⅲ、Ⅳ型胶原酶也已经公开用于乳腺癌PDO标本的培养处理;但采用何种胶原酶对组织进行处理所得结果更优目前尚未达成共识[23-24]。我们通过对比不同类型的胶原酶对乳腺癌组织的消化效率,发现相同酶浓度下,Ⅳ型胶原酶具有良好的消化效率,并且对细胞活性损伤较小。在此优化的标本处理条件下,体积较小的肿瘤或者穿刺肿瘤样本PDO培养的成功率有望提高。
PDO的培养基成分复杂、价格昂贵,在应对大规模培养和临床广泛推广时成本高。因此,在保证获得较高培养成功率的前提下,培养体系的优化显得尤为重要。现有PDO培养体系中R-spondin-1、noggin的主要作用为维持细胞干性状态;A83-01、Y-27632、SB202190分别为TGF-β、ROCK、p38靶向抑制剂,抑制细胞分化[25]。FGF7、FGF10和EGF是促进乳腺上皮细胞增殖的因子,三者在上皮细胞或者间质细胞中均可通过自分泌或者旁分泌的方式发挥作用。本研究发现,在PDO的培养中FGF7和FGF10并非必需添加因子,而EGF剂量减半仍可维持较好PDO体外生长效率;后续扩大培养后,培养成功率为79.3%(46/58)。此外,在本研究培养体系下,PDO可以稳定传代20代以上。免疫组织化学分析结果显示,构建成功的PDO模型与原发灶在ER、PR、HER2、CDH1、TROP1、TROP2表达上基本一致,表明该PDO模型在简化培养体系、减小培养工作量的同时很好地保持了原发灶的特征和分子生物学特点,能够满足后续药物筛选、功能验证等实验应用的需求。
近年来的研究证明,CAFs在肿瘤发生、发展、耐药和免疫微环境抑制中的作用越来越重要。CAFs可以通过分泌细胞因子或者释放外泌体促进肿瘤细胞生长和血管生成[9],也可以参与肿瘤化疗耐药的调节[26]。此外,CAFs在肿瘤免疫的调节过程中也起重要作用[27]。因此,向待研究的肿瘤体系引入CAFs至关重要。对于乳腺癌PDO和同一患者来源原代CAFs动态共培养未见相关报道。本研究发现,通过乳腺癌CAFs和PDO共培养体系的建立,可以提高PDO细胞的增殖速度且促使PDO形态更加多样,使其呈现更强的异质性。
本研究优化了类器官标本处理、培养、传代等一系列操作步骤,使得类器官培养成本降低,培养时间缩短,有助于日后大规模培养扩增PDO。引入同一患者来源的CAFs和PDO动态共培养体系,之前在乳腺癌中尚未有相关报道。该培养方法简便易行,可用于CAFs和乳腺癌细胞交互作用的动态研究,并为后续研究CAFs和PDO共同培养后CAFs和PDO的基因表达谱变化、培养体系中分泌蛋白变化以及药物的筛选等打下坚实基础。
参·考·文·献
[1] Januškevičienė I,Petrikaitė V. Heterogeneity of breast cancer:the importance of interaction between different tumor cell populations[J].Life Sci,2019,239:117009.
[2] Gooding AJ,Zhang B,Gunawardane L,et al.The lncRNA BORG facilitates the survival and chemoresistance of triple-negative breast cancers[J].Oncogene,2019,38(12):2020-2041.
[3] Testa U,Castelli G,Pelosi E.Breast cancer:a molecularly heterogenousdisease needing subtype-specific treatments[J].Med Sci(Basel),2020,8(1):E18.
[4] Murayama T,Gotoh N.Patient-derived xenograft models of breast cancer and their application[J].Cells,2019,8(6):E621.
[5] Ishiguro T,Ohata H,Sato A,et al.Tumor-derived spheroids:relevanceto cancer stem cellsand clinical applications[J].Cancer Sci,2017,108(3):283-289.
[6] Rosenbluth JM,Schackmann RCJ,Kenneth Gray G,et al.Organoid cultures from normal and cancer-prone human breast tissues preserve complex epithelial lineages[J].Nat Commun,2020,11:1711.
[7] Drost J,Clevers H.Organoids in cancer research[J].Nat Rev Cancer,2018,18(7):407-418.
[8] Sachs N,de Ligt J,Kopper O,et al.Aliving biobank of breast cancer organoids captures diseaseheterogeneity[J].Cell,2018,172(1/2):373-386.e10.
[9] Calar K,Plesselova S,Bhattacharya S,et al.Human plasma-derived 3D cultures model breast cancer treatment responses and predict clinically effectivedrug treatment concentrations[J].Cancers,2020,12(7):1722.
[10] Zhang L,Adileh M,Martin ML,et al.Establishing estrogen-responsive mouse mammary organoids from single Lgr5+cells[J].Cell Signal,2017,29:41-51.
[11] Houthuijzen JM,Jonkers J.Cancer-associated fibroblasts as key regulators of the breast cancer tumor microenvironment[J].Cancer Metastasis Rev,2018,37(4):577-597.
[12] Truong DD,Kratz A,Park JG,et al.A human organotypic microfluidic tumor model permits investigation of the interplay between patient-derived fibroblastsand breast cancer cells[J].Cancer Res,2019,79(12):3139-3151.
[13] Nayak B,Balachander GM,Manjunath S,et al.Tissue mimetic 3D scaffold for breast tumor-derived organoid culture toward personalized chemotherapy[J].Colloids Surf B Biointerfaces,2019,180:334-343.
[14] Richards Z,McCray T,Marsili J,et al.Prostate stromaincreases theviability and maintains the branching phenotype of human prostate organoids[J].iScience,2019,12:304-317.
[15] Liu J,Shen JX,Wu HT,et al.Collagen 1A1(COL1A1)promotes metastasis of breast cancer and is a potential therapeutic target[J].Discov Med,2018,25(139):211-223.
[16] Kauppila S,Stenbäck F,Risteli J,et al.Aberrant typeⅠand typeⅢcollagen gene expression in human breast cancerin vivo[J].J Pathol,1998,186(3):262-268.
[17] Zhu YY,Chen C,Li JJ,et al.The prognostic value of quantitative analysis of CCL5 and collagenⅣin luminal B(HER2-)subtype breast cancer by quantum-dot-based molecular imaging[J].Int J Nanomedicine,2018,13:3795-3803.
[18] Carranza-Rosales P,Guzmán-Delgado NE,Carranza-Torres IE,et al.Breast organotypic cancer models[J].Curr Top Microbiol Immunol,2018.DOI:10.1007/82_2018_86.
[19] Drost J,van Boxtel R,Blokzijl F,et al.Use of CRISPR-modified human stem cell organoids to study the origin of mutational signatures in cancer[J].Science,2017,358(6360):234-238.
[20] Duarte AA,Gogola E,Sachs N,et al.BRCA-deficient mousemammary tumor organoids to study cancer-drug resistance[J].Nat Methods,2018,15(2):134-140.
[21] Kondo J,Inoue M.Application of cancer organoid model for drug screening and personalized therapy[J].Cells,2019,8(5):E470.
[22] Bager CL,Willumsen N,Leeming DJ,et al.Collagen degradation products measured in serum can separate ovarian and breast cancer patients from healthy controls:a preliminary study[J].Cancer Biomark,2015,15(6):783-788.
[23] Rios AC,Clevers H.Imaging organoids:a bright future ahead[J].Nat Methods,2018,15(1):24-26.
[24] Mazzucchelli S,Piccotti F,Allevi R,et al.Establishment and morphological characterization of patient-derived organoids from breast cancer[J].Biol Proced Online,2019,21:12.
[25] Yu J,Huang W.The progress and clinical application of breast cancer organoids[J].Int JStem Cells,2020,13(3):295-304.
[26] Su SC,Chen JN,Yao HR,et al.CD10+GPR77+cancer-associated fibroblasts promote cancer formation and chemoresistance by sustaining cancer stemness[J].Cell,2018,172(4):841-856.e16.
[27] Costa A,Kieffer Y,Scholer-Dahirel A,et al.Fibroblast heterogeneity and immunosuppressive environment in human breast cancer[J].Cancer Cell,2018,33(3):463-479.e10.

