不同光温条件对烟株叶片活性氧代谢的影响研究
魏晓玲,柯玉琴,李文卿,钟月仙,何华勤
(1.福建农林大学 生命科学学院,福建 福州 350002;2.福建省烟草专卖局 烟草科学研究所,福建 福州 350013)
在作物生长发育与品质形成的过程中,光照与温度发挥着重要的作用[1-7]。当植物吸收的光能过多,不能及时有效利用或耗散时就会遭受强光胁迫,引起光合效率降低而发生光抑制[8]。烟草是喜光作物,光强充足的条件能够促进烟草的生长发育和烟叶品质的形成[9],但是过强的光照不利于烟株的生长[10]。特别是在烟草生长后期,高温常常伴随着强光,使得光抑制的程度进一步加深。当烟株处于高温和强光环境条件下时,首先发生变化的是其内在的生理过程。在植物生存的环境中,高温高强光等都能促使各类活性氧物质(ROS)产生,相应的抗氧化物酶,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)的活性便会发生相应的变化,帮助机体渡过逆境.因此,抗过氧化物酶的活性可作为植物耐受高温、强光胁迫能力或恢复能力的标准[11]。目前,多数研究主要集中在温度或光强的单一胁迫对烤烟生育前期生长发育、光合生理特性等方面的影响上,而关于高温、强光交互胁迫对成熟期烤烟活性氧代谢和次生物代谢影响的研究鲜见报道。福建地处东南,是我国重要的烟叶产地,主要种植春烟,烟叶一般在5~7月成熟采收,中上部烟叶成熟采收时常常遇高温强光天气,导致烤烟出现“高温逼熟”现象,严重影响烟叶品质。本研究通过设置不同光温处理,探讨了高温、强光对成熟期烟叶活性氧代谢的影响,旨在为制定合理的烟草种植技术措施提供参考。
1 材料与方法
1.1 材料
供试烟草品种为翠碧一号,由福建省烟草专卖局烟草农业科学研究所提供。试验于2018年在福建省烟草专卖局烟草农业科学研究所宦溪科研基地进行。
1.2 试验处理
试验共设4个处理:T1处理,25 ℃+遮光;T2处理,25 ℃+强光;T3处理,35 ℃+遮光;T4处理,35 ℃+强光。强光处理下的光照强度均为1600.0 μmol/(m2·s)。用硫酸纸遮住烟草植株倒2、倒3叶的半片叶片(硫酸纸的遮光率为30%),作为T1与T3处理的遮光处理;不用硫酸纸遮光作为T2和T4处理的强光处理。试验采用盆栽方式,花盆上口内径28 cm,下底内径22 cm,内高25 cm,每盆装15.0 kg土。试验用土壤pH值为5.11,碱解氮含量为102.4 mg/kg,速效磷含量为16.8 mg/kg,速效钾含量为94.8 mg/kg,有机质含量为16.2 g/kg。每盆施烟草专用肥20 g(N∶P2O5∶K2O=12∶7∶22)。每处理种植4盆烤烟。选择七叶一心烟苗移栽到花盆,然后将花盆放置在室外自然温光条件下。于烟株打顶后第7天,将花盆移入植物生长箱(由武汉瑞华仪器设备有限责任公司生产)进行高温和强光处理,处理时间为48 h。
1.3 测定指标及方法
将同一处理的倒2和倒3叶的半片叶剪下、混匀,冷冻保存于-80 ℃冰箱,用于各项生理指标的测定。其中叶片膜透性的测定采用新鲜叶片电导仪法。
酶液的提取:取0.5 g烟草叶片,置于预冷的研钵中,加入2.0 mL冰冷的0.05 mol/L磷酸缓冲液(pH 7.8)及少量石英砂,再加入3.0 mL缓冲液,研磨均匀后,将匀浆液置于4 ℃下,以10000 r/min离心10 min,所得上清液即为酶液,可供超氧化物歧化酶SOD活性、过氧化物酶POD活性、过氧化氢酶CAT活性及丙二醛MDA含量的测定。
SOD、POD活性的测定参照张志良[12]的方法,其中SOD的活性以光照下超氧化物歧化酶抑制氮蓝四唑的还原作用强度来表示,以每分钟A470变化0.01作为POD的1个酶活性单位。
CAT活性的测定采用硫代硫酸钠滴定法,将酶提取液与0.1 mol/L过氧化氢混合,然后加入3.6 mol/L硫酸终止反应;加入2%碘化钾和钼酸铵以及1%淀粉作为显色剂,用0.02 mol/L硫代硫酸钠滴定,直到溶液褪色;用煮沸的酶液作为对照组,减少的硫代硫酸钠滴定量表示酶活性大小。
MDA含量的测定采用硫代巴比妥酸比色法,分别在450、532、600 nm波长下测定吸光度。
内源激素IAA、ABA、SA、JA含量的测定采用ELISA(酶联免疫)法(试剂盒由上海通蔚实业有限公司提供),将烟叶样品置于预冷研钵中,用80%甲醇研磨成匀浆,然后离心,取上清液过C18胶柱,去除亲酯色素后用于不同激素含量的测定。
1.4 数据分析
使用Microsoft Office Excel 2007和DPS 7.05软件进行试验数据处理和统计分析。
2 结果与分析
2.1 不同处理对烟株叶片膜透性的影响
植物细胞质膜是细胞与外界环境间的一道屏障,对维持细胞的微环境和正常代谢起着重要作用。从图1可见,T1、T2、T3和T4处理烟叶的细胞膜透性分别为12.88%、15.21%、14.89%和20.51%。在相同温度条件下,遮光处理叶片的细胞膜透性显著低于强光处理的;在相同光强处理条件下,35 ℃高温处理叶片的细胞膜透性显著高于25 ℃处理的。说明高温和强光均会对烟株叶片的细胞膜造成显著伤害,导致细胞膜透性增加,细胞内部分电解质外渗,影响其正常的生理代谢。
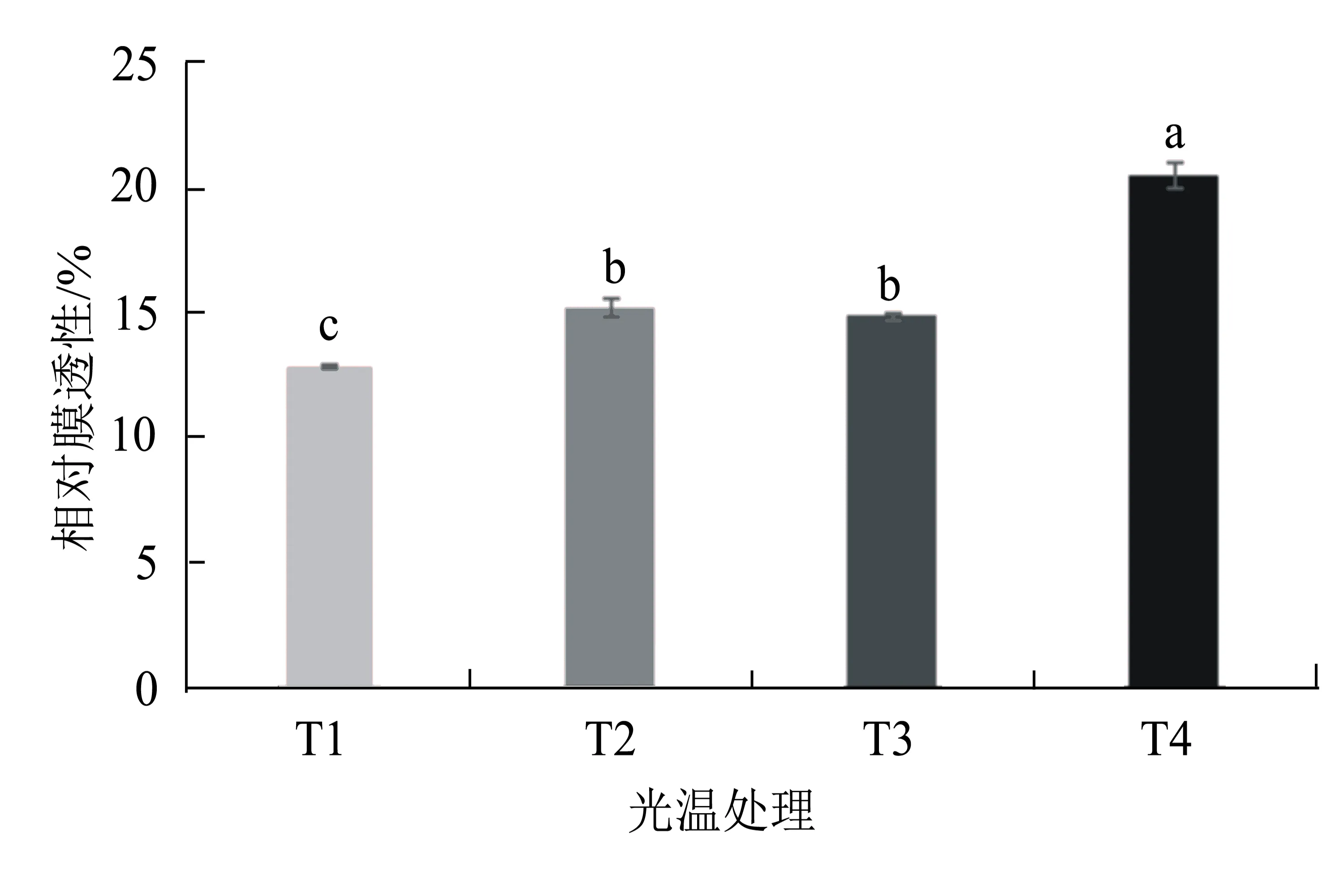
图中数据为均值±标准差;不同小写字母表示差异显著(P<0.05),下同。
2.2 不同处理对烟株活性氧代谢的影响
2.2.1 不同处理对烟株叶片H2O2与MDA含量的影响 从图2A可见,在25 ℃条件下,无论遮光与否,叶片的H2O2含量均较低,均显著低于35 ℃温度条件下的,即T1、T2处理烟叶的H2O2含量均显著低于T3、T4处理的;当温度为35 ℃时,遮光处理可以显著降低叶片的H2O2含量,即T3处理的H2O2含量显著低于T4处理的。在25 ℃条件下,烟株生长受强光照的影响较小,T1处理下的H2O2含量为6.699 mmol/mg,T2处理下的H2O2含量为6.825 mmol/mg;当温度上升到35 ℃时,叶片中H2O2含量即显著增加,当光照强度进一步增强时,H2O2含量再进一步显著增加,在T4处理下的H2O2含量达到最大值23.139 mmol/mg,表明在T4处理下烟株叶片受伤害最大。
从图2B可见,在T4的高温强光处理条件下叶片中MDA含量最高,达到4.774 μmol/g,显著高于T1和T3处理的。无论在高温还是在低温下,强光处理烟株叶片的MDA含量均高于遮光处理的,且在两个强光处理下烟株叶片的MDA含量差异未达5%显著水平。在25 ℃遮光处理下烟株叶片的MDA含量显著高于35 ℃遮光处理的,表明强光比高温更能诱导烟株叶片MDA含量的增加。
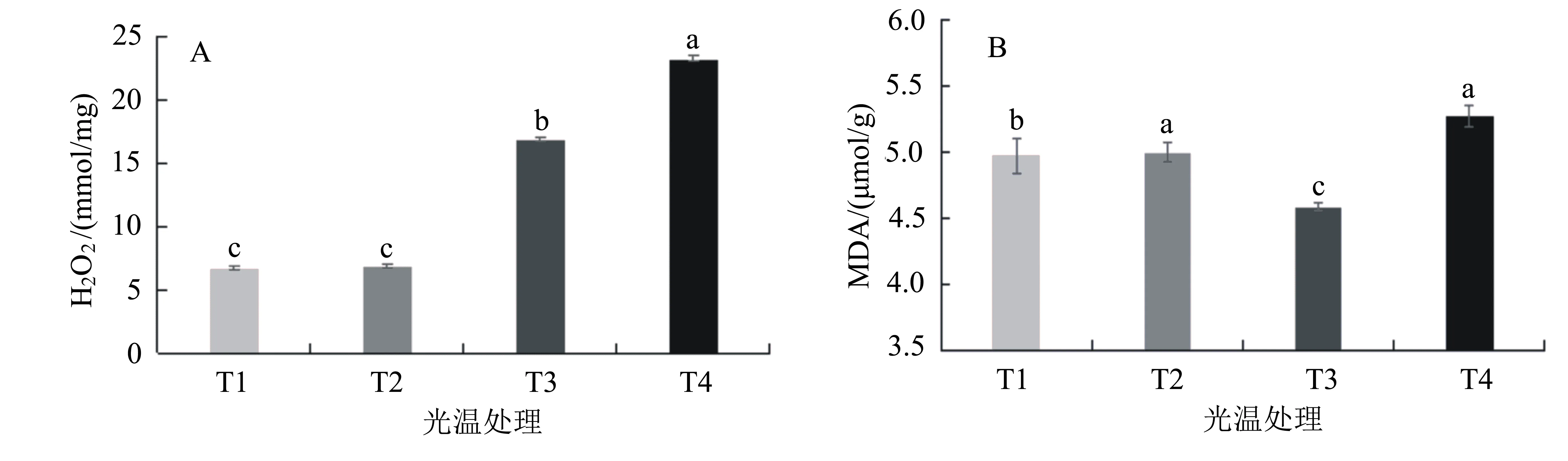
图2 不同处理对烟株叶片H2O2与MDA含量的影响
2.2.2 不同处理对烟株叶片保护酶活性的影响 过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)是植物活性氧代谢中的3个关键酶,其中SOD催化超氧化物通过歧化反应转为O2和H2O2,CAT能将细胞内有害的H2O2转化为H2O和O2。由图3A可见,T3处理烟叶的SOD活性最高,达1.263 U/(mg·min),分别比T1、T2和T4处理高6.42%、6.84%和5.68%,但处理差异不显著。由图3B可见,CAT活性以T2处理最高,达1.289 mg/(mg·min),显著高于其它3个处理的,且在其它3个处理间CAT活性差异不显著。在相同温度下,强光处理的烟株的CAT活性都高于遮光处理的,其中T2处理显著高于T1处理的;T4高于T3处理的,但差异未达到显著水平,说明在强光下烟株会通过提高CAT的活性来清除体内产生的过量H202。
从图3C可见,T3处理烟叶的POD活性最高,达1.674 U/(mg·min),显著高于其它3个处理的,分别比T1、T2和T4处理高17.99%、31.09%和17.06%;在后面3个处理间POD活性差异不显著。说明在高温条件下,遮光处理对促进POD活性的提高具有显著作用,而在25 ℃条件下,遮光处理虽然对POD活性的增加也有促进作用,但效果不显著。
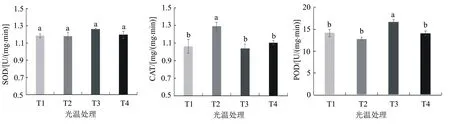
图3 不同处理对烟株叶片SOD、CAT和POD活性的影响
2.3 不同处理对叶片内源激素含量的影响
由表1可见:在相同温度下,强光处理下的烟株体内的生长素IAA含量高于遮光处理的;在遮光、不同温度处理下的烟株IAA含量未出现显著差异;T2处理下的IAA含量最高,达1.314 ng/g,显著高于T4处理的,表明在相同温度下强光诱导烟株叶片产生更多的IAA,而在遮光条件下低温处理反而诱导更多的IAA。在T2处理下烟叶的ABA含量最高,达7.183 ng/g;在相同温度下强光处理的烟叶ABA含量显著高于遮光处理的,其中T2处理下的ABA含量比T1处理提高了20.6%,T4处理下的ABA含量比T3处理提高了32.8%;在相同光强下,35 ℃下的烟叶ABA含量显著低于25 ℃下,其中T3处理的ABA含量比T1处理降低了35.4%,T4处理比T2处理降低了28.9%。这与IAA含量的表现一致。
从表1还可以看出,温度处理对烟株叶片SA含量的影响比光照处理显著,在35 ℃高温处理下烟叶SA含量均显著高于在25 ℃温度处理下的,但光强对烟叶SA含量的影响不显著。此外,25 ℃遮光、25 ℃强光和35 ℃遮光处理下烟叶JA含量均显著高于35 ℃强光处理下的,且在前三者间差异不显著,表明35 ℃强光显著降低了烟叶的JA含量。
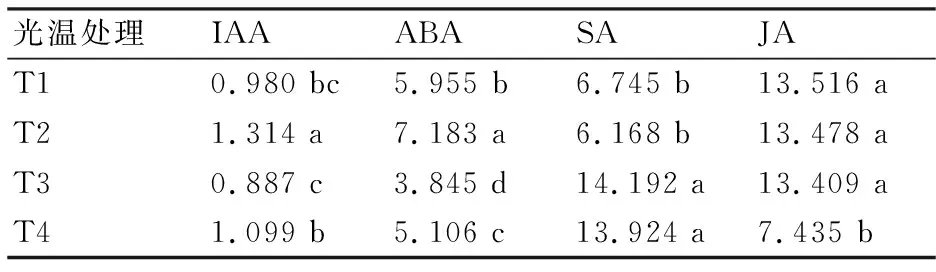
表1 不同处理下烟叶的内源激素含量 ng/g
3 讨论
植物细胞质膜对维持细胞的微环境和正常的代谢起着重要作用。当植物处于逆境时,植物细胞膜透性增加,使得细胞内部分电解质外渗,影响其正常的生理代谢[13]。在本研究的相同温度条件下,强光处理烟株叶片的细胞膜透性显著高于遮光处理的;在高温处理下烟株叶片的细胞膜透性也显著高于低温处理的,说明高温和强光均使烟叶细胞膜透性增加。
逆境造成植物生理功能紊乱与植物细胞内活性氧的代谢不平衡息息相关[14]。本研究结果表明,在高温强光胁迫下烟株叶片的H2O2含量显著上升,而H2O2是细胞清除O2-时的中间产物,说明在胁迫下活性氧增加、叶片碳同化过程受阻,破坏了活性氧的产生和消除之间的动态平衡,引发了膜脂过氧化反应[15],这也可从本文研究发现强光诱导超量MDA产生的结果得到验证。活性氧的增加反过来促使烟株叶片启动抗氧化反应,强光处理的烟株的CAT、POD活性都高于遮光处理。而高温遮光处理下烟株的SOD活性反而高于高温强光处理,这可能是因为在强光处理下,细胞结构遭到了严重破坏,对O2·-的清除能力降低,导致烟叶膜脂过氧化加剧[16,17],同时也导致高温强光处理下烟株叶片的MDA含量最高,这与张建光等[17]在苹果上的研究结果一致。
植物往往通过调节内源激素的含量建立新的激素平衡来适应逆境胁迫。在逆境胁迫下,脱落酸含量大量增加,以加快离层的形成,促进植物组织的脱落,加强植物的抗逆性等[18]。本研究发现在强光下烟株叶片内的ABA含量显著增加,有可能是因为逆境胁迫促使植物体内ABA的积累,大量的ABA积累可减少植物体内水分运输途径,增加共质体途径的水流,促进水分吸收和气孔开放,抑制气孔关闭,以抵抗逆境胁迫。但在高温条件下,ABA的含量反而下降。高夕全等[19]研究发现,水稻幼胚经高温处理后ABA含量出现先降后升的趋势;杨长琴等[20]的研究结果显示在高温胁迫下棉花叶片中ABA含量随着处理时间的延长呈先升后降的趋势[21]。说明植物不一定总是通过提高ABA水平来抵抗高温胁迫,植物的ABA水平对逆境的响应还与不同作物、逆境处理时间等有关。在高温条件下烟株的水杨酸(SA)含量明显上升,说明烟株可能通过提高SA的含量来提高抗氧化酶SOD等的活性,调节抗逆基因的表达水平,从而提高烟株对高温胁迫的抵御能力,这也可从本研究高温提高SOD活性的结果得到验证。生长素是一类含有一个不饱和芳香族环和一个乙酸侧链的内源激素,主要指吲哚乙酸,具有调节茎的生长速率、抑制侧芽、促进生根等作用[22]。在本试验的相同温度、强光处理下,烟株体内的生长素IAA含量显著高于遮光处理,说明在强光下烟株通过提高IAA含量来延缓叶片衰老、延长叶片同化作用的时间[23],这与Teale W D等[24]在紫花苜蓿上的研究结果一致。茉莉酸(JA)作为介导植物应答环境信号和内源信号物质的关键激素,参与了植物各个阶段的生长发育及胁迫防御反应[26];当植物处于干旱、盐碱等逆境条件下时,茉莉酸含量上升,诱导植物气孔关闭。JA调控气孔运动的作用机制可能与对K+通道的调控有关。JA的前体物亚麻酸(LA)通过调控保卫细胞质膜K+通道,激活质膜H+-ATPase,进而影响气孔运动[27]。本试验研究发现,在高温强光处理下烟株叶片内的JA含量显著下降,可能是因为在高温强光下,植物通过降低JA含量来调控K+通道,抑制气孔关闭,从而提高呼吸与光合速率,以延缓烟株早衰。
4 结论
在高温、强光胁迫下,烟株细胞膜内电解质外渗,细胞膜透性增加,同时H202大量累积,MDA含量维持在较高水平,烟株膜脂过氧化程度加剧。高温胁迫使得烟株SOD活性提高,清除O2·-的能力增强,是其应对高温胁迫的积极保护机制;而在强光处理下,细胞结构破坏严重,SOD活性下降,对O2·-的清除能力降低;在强光处理下烟株通过提高CAT、POD的活性来降低H2O2的积累,减少类囊体膜的过氧化。但在高光强下温度的提高会造成CAT活性的降低。在高温、强光胁迫下烟叶内源激素的含量也发生了明显变化,以减缓叶片衰老。在强光下烟株叶片内的ABA和IAA含量显著增加,但在高温处理下ABA和JA含量降低,SA的含量升高,几种激素协同作用,促使抗氧化酶SOD等的活性提高,以抵御高温胁迫。

