不同采收期对“贵长”猕猴桃后熟品质和酶活性的影响
曹 森,瞿光凡,高芙蓉,刘亚非,黄亚欣,罗 雪,王国立,王 瑞,*
(1.贵阳学院食品与制药工程学院,贵州 贵阳 550005;2.湘西土家族苗族自治州农产品质量检验检测中心,湖南 吉首 416000;3.修文县农业农村局,贵州 贵阳 550200)
“贵长”猕猴桃(Actinidia deliciosa cv. Guichang)由于果实酸甜适中、营养价值高等优点深受消费者喜欢[1-2]。2019 年,修文县“贵长”猕猴桃种植面积达到1×104hm2,成为当地主要的经济来源。“贵长”猕猴桃为典型的呼吸跃变型果实[3],果实成熟度是影响果实后熟品质和耐贮藏性的关键因素,采收成熟度影响果实耐藏性,同时也影响冷藏后果实的后熟品质。研究表明,适宜的采收期有利于保证果实的品质,减少贮藏期间果实出现冷害、腐烂等劣变现象,维持果实良好的风味[4-6]。目前,关于“贵长”猕猴桃成熟度报道的研究比较少,张承等[7]研究猕猴桃适宜采摘期及其贮藏性能表明,过早采收或过晚采收以及10 mg/L 氯吡脲浸果处理均可加快“贵长”猕猴桃果实的软化速度,降低果实品质。而针对不同采收期“贵长”猕猴桃后熟品质的研究还尚未见相关报道。Stec 等[8]报道了当猕猴桃硬度为0.5 ~1.5 kg/cm2时,果实食用口感较好。因此,本文通过探究两种“贵长”猕猴桃后熟途径下其品质的变化,从而明确适宜的“贵长”猕猴桃采收期,以期为“贵长”猕猴桃的贮藏保鲜提供可靠的理论依据和技术支撑。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
“贵长”猕猴桃:采收于贵州省贵阳市鹏盛通农业有限公司基地;聚乙烯(PE)保鲜膜(厚度20 μm):由国家农产品保鲜工程技术研究中心(天津)提供;其他化学试剂均为分析纯。
1.1.2 仪器与设备
TA.XT.Plus 质构仪,英国SMS 公司;TGL-16A台式高速冷冻离心机,长沙平凡仪器仪表有限公司;PAL-1型迷你数显折射计,日本ATAGO 公司;UV-2550 紫外分光光度计,日本Shimazhu 公司。
1.2 方法
1.2.1 处理方法
供试品种为“贵长”猕猴桃,分4 个采收期进行采收,详见表1。
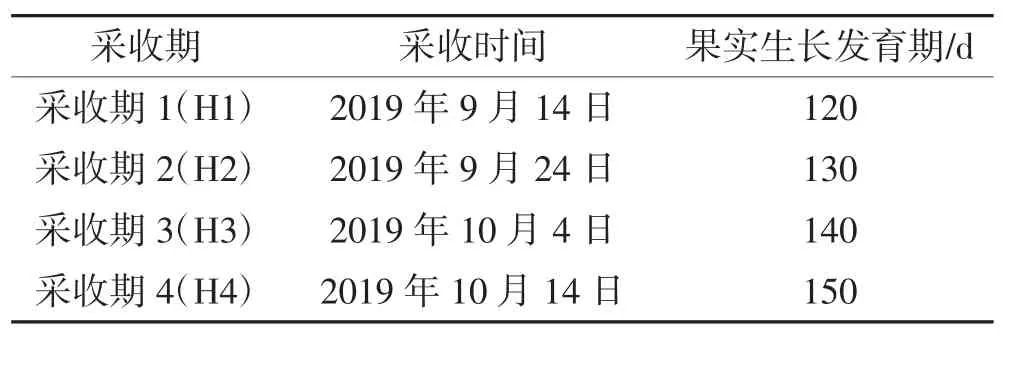
表1 “贵长”猕猴桃采收期Table 1 Harvest time of ‘Guichang’kiwi fruits
采摘后的“贵长”猕猴桃立即运回至果蔬贮藏保鲜实验室。选择大小基本一致、无病虫害、无机械损伤的果实。一部分果实采收后直接用于货架期试验,另一部分果实采收后经过预冷放入衬有PE20 保鲜膜的果筐内扎袋,冷藏90 d 后再进行货架期试验。其中,冷藏期温度为(1±0.5)℃,货架期温度为(20±1)℃。具体果实测定分析时间如表2 所示。采收期H1、H2、H3和H4 的样品直接进行货架期试验的处理分别记为S1、S2、S3 和S4;采收后冷藏90 d 再进行货架期试验的处理分别记为C1、C2、C3 和C4。当果实硬度达到1.0~1.5 kg/cm2为第1 次后熟阶段(第Ⅱ阶段检测期),当果实硬度达到0.5~1.0 kg/cm2为第2 次后熟阶段(第Ⅲ阶段检测期)。

表2 “贵长”猕猴桃指标测定时间Table 2 Determination periods of ‘Guichang’kiwi fruits
1.2.2 测定项目与方法
1.2.2.1 硬度
使用TA.XT.Plus 质构仪(P/2N 探头)测定,测试硬度参数如下:测前速度2 mm/s,测中速度1 mm/s,测后速度2 mm/s,穿刺深度10 mm,触发力5.0 g,各处理重复测定12 次,结果取其平均值。
1.2.2.2 可溶性固形物含量
使用迷你数显折射仪测定。
1.2.2.3 淀粉含量
采用Burdon 等[9]的方法测定。
1.2.2.4 可滴定酸含量
参照GB/T 12456—2008[10]中的方法测定。
1.2.2.5 VC 含量
采用钼蓝比色法[11]测定。
1.2.2.6 超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)、脂氧合酶(LOX)和过氧化物酶(POD)活性
均采用曹建康等[12]的方法测定。
1.2.3 数据处理
采用Excel 2003 统计处理数据,采用SPSS22.0进行差异显著性分析。
2 结果与分析
2.1 不同成熟度“贵长”猕猴桃可溶性固形物含量的变化
由图1 可见,随着猕猴桃采收期的延后,果实可溶性固形物含量呈现上升的趋势。在第Ⅰ阶段,S1组、S2 组、S3 组和S4 组果实的可溶性固形物含量分别为4.92%、6.42%、7.34%和10.45%,S4 组可溶性固形物含量显著高于S1 组、S2 组、S3 组(P<0.05);第Ⅰ阶段,C1 组、C2 组、C3 组和C4 组果实的可溶性固形物含量分别为8.68%、10.21%、12.85%和14.25%,各处理间均有显著差异(P<0.05)。在第Ⅱ阶段,S2 组和S3 组果实的可溶性固形物含量显著高于S1 组和S4组(P<0.05),C2 组和C3 组的可溶性固形物含量也显著高于C1 组和C4 组(P<0.05)。第Ⅱ阶段到第Ⅲ阶段,不同组果实的可溶性固形物含量变化均无显著差异。在第Ⅲ阶段,直接货架试验的不同处理组的果实可溶性固形物含量大小关系为S2 组>S3 组>S4组>S1 组,冷藏90 d 后货架试验的不同处理组的果实可溶性固形物含量大小关系为C2 组>C3 组>C4组>C1 组。因此,不同采收期均影响“贵长”猕猴桃果实可溶性固形物含量的变化,其中在第Ⅱ阶段和在第Ⅲ阶段采收的果实在后熟期间能保持较高的可溶性固形物含量。
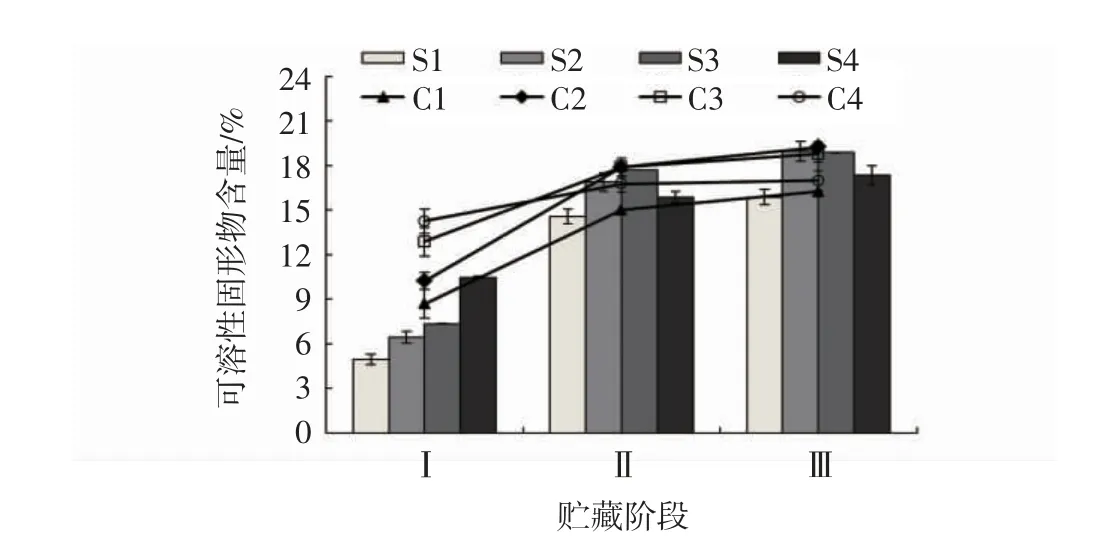
图1 不同成熟度“贵长”猕猴桃果实可溶性固形物含量的变化Fig.1 Changes of soluble solid contents in kiwi fruits with different maturities
2.2 不同成熟度“贵长”猕猴桃淀粉含量的变化
由图2 可见,在第Ⅰ阶段,S1 组和S2 组猕猴桃的淀粉含量显著高于S3 组和S4 组(P<0.05),说明采收期过晚,猕猴桃淀粉含量积累较少;C2 组和C3组的淀粉含量显著高于C1 组和C4 组(P<0.05),说明C1 组的果实在贮藏90 d 内,淀粉较快地转化为糖。在第Ⅱ阶段和第Ⅲ阶段,不同处理的淀粉含量均无显著差异,说明随着果实后熟,果实中的淀粉逐渐转化为糖,导致后熟的猕猴桃淀粉含量差异不大。因此,不同采收期均影响采收时“贵长”猕猴桃果实的淀粉含量,猕猴桃采收期过早,淀粉含量积累不够,猕猴桃采收期过晚,淀粉含量由于后熟而降低,其中C2组和C3 组的果实在冷藏期90 d 后仍保持较高的淀粉含量。
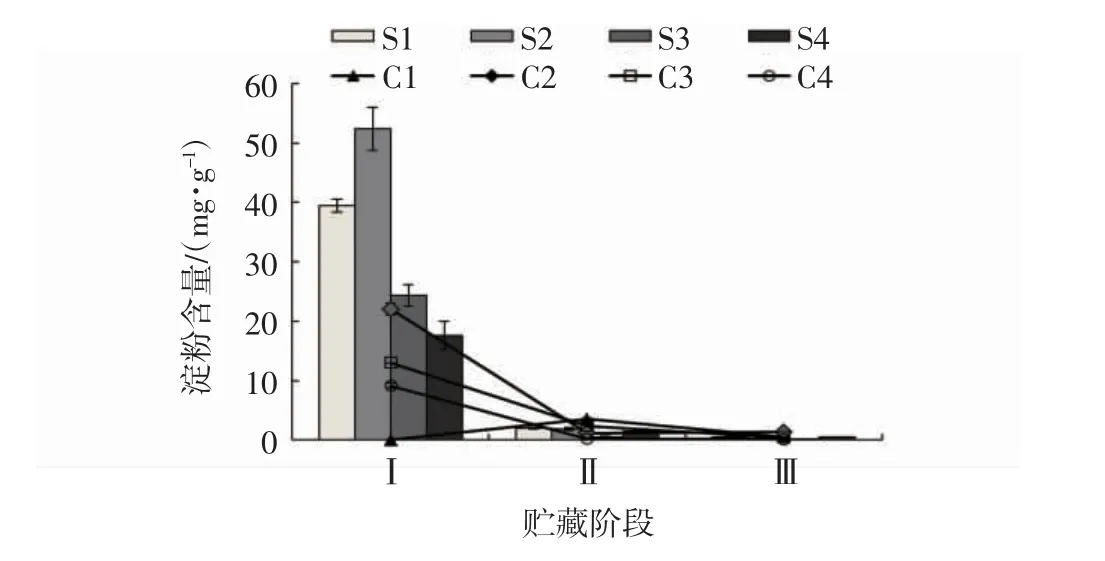
图2 不同成熟度“贵长”猕猴桃果实淀粉含量的变化Fig.2 Changes of starch contents in kiwi fruits with different maturities
2.3 不同成熟度“贵长”猕猴桃可滴定酸含量的变化
由图3 可见,在第Ⅰ阶段,S1 组、S2 组、S3 组和S4 组的“贵长”猕猴桃果实的可滴定酸含量分别为1.32%、1.21%、1.18%和1.31%,并且4 组间无显著差异;冷藏90 d 后的果实可滴定酸含量大小关系为C2组>C3 组>C4 组>C1 组。在第Ⅱ阶段和第Ⅲ阶段,采收后直接进行货架试验的果实和冷藏90 d 再进行货架试验和果实的可滴定酸含量变化均无显著差异,其中S3 组的果实可滴定酸含量高于S1 组、S2 组和S4 组,C2 组和C3 组果实的可滴定酸含量均高于C1组和C4 组。综上所述,不同采收期的猕猴桃果实可滴定酸含量无显著差异,但采收期S3 组和C3 组能够保持果实后熟期间较高的可滴定酸含量。

图3 不同成熟度猕猴桃果实可滴定酸含量的变化Fig.3 Changes of titratable acids contents in kiwi fruits with different maturities
2.4 不同成熟度“贵长”猕猴桃VC 含量的变化
由图4 可见,在第Ⅰ阶段,不同采收期“贵长”猕猴桃果实的VC 含量大小关系为S4 组>S1 组>S2组>S3 组,而贮藏90 d 后的不同采收期果实VC 含量大小关系为C3 组>C4 组>C2 组>C1 组。在第Ⅱ阶段和第Ⅲ阶段,S2 组的果实VC 含量显著高于S1 组、S3 组和S4 组(P<0.05),并且C2 组的果实VC 含量也高于C1 组、C3 组和C4 组,但没有显著差异。因此,不同采收期均影响猕猴桃果实的VC 含量,其中S2 组在不同的后熟阶段均表现较高的VC含量。
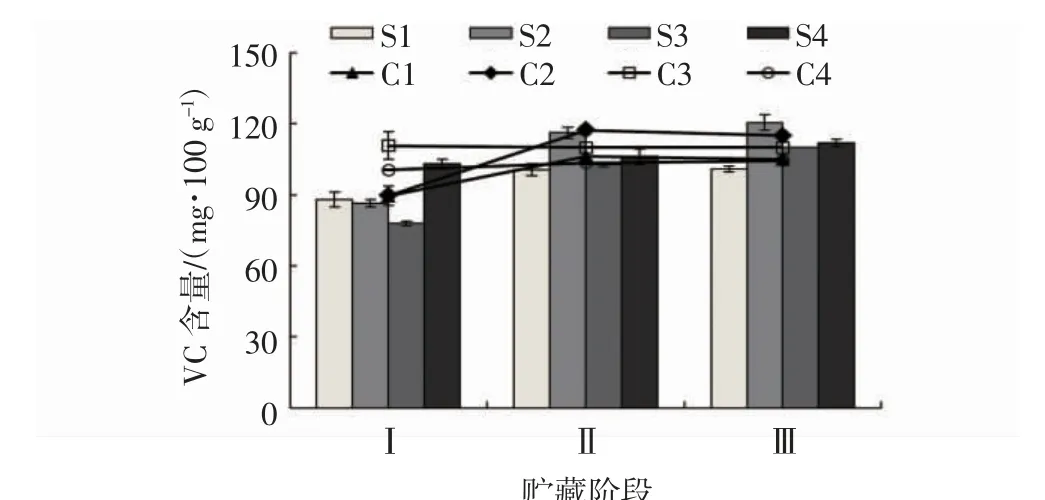
图4 不同成熟度猕猴桃果实VC 含量的变化Fig.4 Changes of VC contents in kiwi fruits with different maturities
2.5 不同成熟度“贵长”猕猴桃SOD 活性的变化
由图5 可见,在第Ⅰ阶段,不同成熟度刚采收的“贵长”猕猴桃SOD 活性大小关系为S2 组>S3 组>S1 组>S4 组,冷藏90 d 时不同成熟度的猕猴桃SOD活性大小关系为C2 组>C4 组>C3 组>C1 组。在第Ⅱ阶段,S1 组、S2 组和S3 组的猕猴桃SOD 活性均显著高于S4 组(P<0.05),C2 组、C3 组和C4 组的猕猴桃SOD 活性均显著高于C1 组(P<0.05)。在第Ⅲ阶段,S1 组、S2 组、S3 组和S4 组的猕猴桃SOD 活性分别为1 203.47、1 277.29、1 213.28、1 202.99 U·g-1,C1组、C2 组、C3 组和C4 组的猕猴桃SOD 活性分别为910.46、950.58、1 054.73、747.43 U·g-1。因此,不同采收期均影响猕猴桃果实的SOD 活性,其中采收后直接进行货架期的果实后熟时SOD 活性最高的为S2组,而冷藏90 d 后再进行货架期的果实后熟时SOD活性最高的为C3 组。

图5 不同成熟度猕猴桃果实SOD 活性的变化Fig.5 Changes of SOD activities in kiwi fruits with different maturities
2.6 不同成熟度“贵长”猕猴桃APX 活性和CAT 活性的变化
由图6A 可见,在第Ⅰ阶段,刚采收的S2 组“贵长”猕猴桃果实的APX 活性显著高于S1 组、S3 组和S4 组(P<0.05),冷藏90 d 时C2 组猕猴桃APX 活性显著高于C1 组、C3 组和C4 组(P<0.05)。在第Ⅱ阶段和第Ⅲ阶段,S2 组的猕猴桃APX 活性均显著高于S1 组、S3 组和S4 组(P<0.05)。在第Ⅱ阶段,C2 组猕猴桃APX 活性显著高于C1 组、C3 和C4 组(P<0.05),在第Ⅲ阶段,C1 组、C2 组、C3 猕猴桃APX 活性显著高于C4 组(P<0.05)。由图6B 可见,在第Ⅰ阶段,不同采收期的猕猴桃果实CAT 活性大小关系为S2组>S3 组>S1 组>S4 组,冷藏90 d 时不同采收期的猕猴桃果实CAT 活性大小关系为C3 组>C2 组>C4 组>C1 组。在第Ⅱ阶段,S1 组、S2 组、S3 组和S4组的猕猴桃CAT 活性相互间比较均无显著差异,C1 组、C2 组、C3 组和C4 组的猕猴桃CAT 活性相互间比较也均无显著差异。在第Ⅲ阶段,S2 组的CAT活性显著高于S3 组、S1 组和S4 组(P<0.05),C2 组猕猴桃CAT 活性显著高于C3 组、C1 组和C4 组(P<0.05)。因此,不同采收期均影响“贵长”猕猴桃果实APX 活性和CAT 活性,其中S2 和C2 组均能够在不同的货架期分别保持果实后熟时较高的APX 活性和CAT 活性。
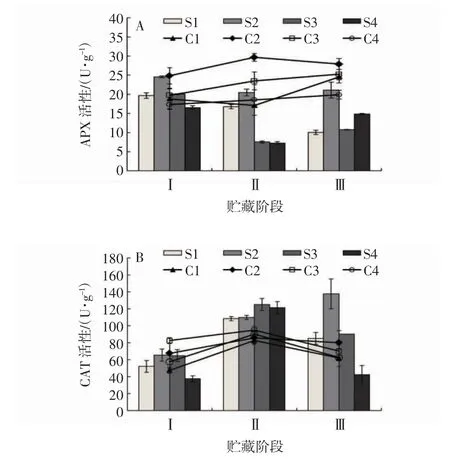
图6 不同成熟度猕猴桃果实APX 活性(A)和CAT 活性(B)的变化Fig.6 Changes of APX(A)and CAT(B)activities in kiwi fruits with different maturities
2.7 不同成熟度“贵长”猕猴桃LOX 活性和POD 活性的变化
由图7A 可见,在第Ⅰ阶段,刚采收的“贵长”猕猴桃果实S2 组的LOX 活性显著低于于S1 组、S3 组和S4 组(P<0.05),冷藏90 d 时C1 组和C2 组猕猴桃LOX 活性显著低于C3 组和C4 组(P<0.05)。在第Ⅱ阶段,直接货架试验的不同采收期猕猴桃果实LOX 活性大小关系为S4 组>S1 组>S3 组>S2 组,冷藏90 d 后货架试验的不同采收期的果实LOX 活性大小关系为C4 组>C3 组>C1 组>C2 组。在第Ⅲ阶段,S2 组的果实LOX 活性分别比S1 组、S3 组和S4 组低3.40、3.13、7.63 U·g-1,C2 组的果实LOX 活性分别比C1 组、C3 组和C4 组低5.22、2.91、6.52 U·g-1。由图7B 可见,在第Ⅰ阶段,刚采收的猕猴桃果实S1组的POD 活性显著高于于S2 组、S3 组和S4 组(P<0.05),冷藏90 d 时C1 组、C2 组、C3 组和C4 组的果实POD 活性均无显著差异。在第Ⅲ阶段,S2 组猕猴桃POD 活性均显著高于S1 组、S3 组和S4 组(P<0.05),C2 和C3 的猕猴桃POD 活性均高于C1组和C3 组,但无显著差异。因此,不同采收期均影响“贵长”猕猴桃果实LOX 活性和POD 活性,其中S2、S3 和C2、C3 组均能够在不同的货架期保持果实后熟时较低LOX 活性和较高的POD 活性。
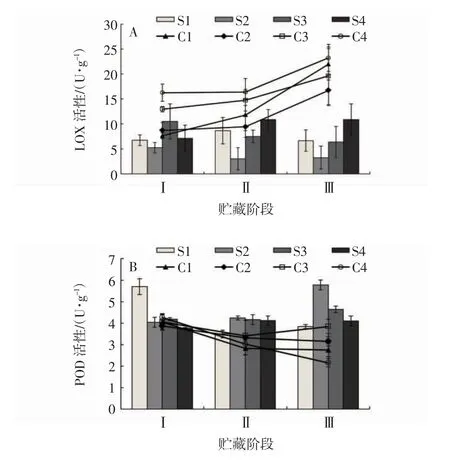
图7 不同成熟度猕猴桃果实LOX 活性(A)和POD 活性(B)的变化Fig.7 Changes of LOX(A)and POD(B)activities in kiwi fruits with different maturities
3 结论
本文研究了不同采收期对“贵长”猕猴桃后熟品质的作用效果,结果表明,适宜的采收期有利于保持猕猴桃果实的营养品质和酶活性。果实采收后直接进行货架期研究表明,S2 组和S3 组可较好地抑制果实可溶性固形物含量、可滴定酸含量、VC 含量和SOD活性的下降,维持果实APX、CAT 和POD 的活性,降低果实的LOX 活性。果实采收冷藏90 d 后进行货架期研究表明,C2 组和C3 组也较好地延缓了果实生理代谢。综合比较,采收期H2 和采收期H3 能够更好地抑制果实的衰老进程,保持果实较好的后熟品质。因此,建议“贵长”猕猴桃生长发育期130~140 d 时对果实进行采收为宜,有利于果实长期贮藏。

