乳腺浸润性微乳头状癌与导管癌的预后比较—基于倾向性评分匹配的分析
陈园园, 叶 欣, 汤永喆, 王 杰, 何 奇
(上海交通大学医学院附属国际和平妇幼保健院乳腺科 上海市胚胎源性疾病重点实验室,上海 200030)
乳腺浸润性微乳头状癌 (invasive micropapillary carcinoma,IMPC)是一种少见的特殊类型乳腺癌,占乳腺浸润性癌的 2%~8%[1]。 2003版世界卫生组织乳腺肿瘤组织分类首次将IMPC归为一种独立的乳腺癌病理类型。IMPC常与其他类型乳腺癌混合发生,其中以浸润性导管癌 (invasive ductal carcinoma,IDC)最常见。与IDC相比,IMPC的生物学行为侵袭性更强,即具有更高的淋巴结转移率及淋巴管浸润发生率。本研究回顾性分析上海交通大学乳腺癌数据库中IPMC与IDC病人的临床病理特征及治疗方案,采用倾向性评分匹配法(propensity score matching,PSM)均衡组间混杂因素,以进一步了解两组的预后差异及预后影响因素。
资料与方法
一、一般资料
收集2011年1月至2017年12月上海交通大学乳腺癌数据库中国际和平妇幼保健院乳腺科和瑞金医院乳腺疾病诊治中心的乳腺IMPC与IDC女性病例资料。共2 976例,IMPC组111例,IDC组2 865 例,平均年龄分别为(56.0±1.4)(26~84)岁、(55.4±17.7)(23~92)岁。均经病理确诊为IMPC或IDC;病灶单发;接受根治性手术治疗,临床病理及随访资料完整。排除免疫组织化学检测人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)++且未行FISH检测的病人,排除初诊时有肺、骨、肝等任一远处转移或其他恶性肿瘤的病人,排除术后1个月内死亡的病人。
分析IPMC组和IDC组病人的年龄、肿瘤大小、组织学分级、淋巴结、雌激素受体(estrogen receptor,ER)、 孕激 素受体 (progesterone receptor,PR)、HER2、Ki67 表达、分子分型、TNM 分期、治疗、无乳腺癌生存 (breast cancer-free interval,BCFI)及总生存(overall survival,OS)。
二、肿瘤分期及免疫组织化学评判标准
肿瘤TNM分期参照第8版美国癌症协会乳腺癌分期系统。免疫组织化学和FISH检测采用当时的结果。所有标本均先采用免疫组织化学检测HER2,2015年1月1日前入院病人的免疫组织化学操作及评判标准参照乳腺癌HER2检测指南(2009版)[2];此后入院病人的免疫组织化学操作及评判标准参照乳腺癌HER2检测指南(2014版)[3]。HER2结果为++时,进一步做FISH检测。HER2阳性标准为FISH检测示HER2基因扩增,或免疫组织化学检测HER2结果为+++。ER、PR阳性标准为≥1%的细胞核强染色。PR和Ki67表达高低的判定界值分别为 20%和 14%[4-5]。
三、分子分型标准
分子分型参照 2013年乳腺癌专家共识[4]。Luminal A型:ER阳性、PR高表达、HER2阴性且Ki67低表达。Luminal B型:HER2阳性时,ER阳性,PR和Ki67任何状态;或HER2阴性时,ER阳性,PR低表达或Ki67高表达。HER2过表达型:ER和PR均阴性、HER2阳性。三阴性:ER、PR、HER2均阴性。
四、随访
病人手术日期为随访起始,随访截止日期为2019年10月31日。术后2年内每3~4个月随访1次,术后 2~5年每 6个月随访 1次,术后 5年后每12个月随访1次。随访采用病历、门诊或电话方式。BCFI时间为从手术至首次出现疾病复发、转移、第2原发乳腺癌或因原发乳腺癌致死。OS时间为从手术到任何原因死亡。
五、倾向性评分匹配法
应用R(Version 4.0.4)软件中的MatchIt部分,基于Logistic回归的距离度量进行匹配,对所有病人进行1∶1最邻近匹配,匹配容差为0.01。匹配变量包括连续变量的年龄、肿瘤直径、淋巴结转移数及分类变量的乳房手术方式(保留或切除)、是否综合治疗(化疗、放疗、靶向治疗和内分泌治疗)、组织学分级、Ki67、ER、PR和HER2。两组基线资料的均衡性评价采用标准化差值法。
六、统计学方法
采用IBM SPSS 23.0软件进行分析。计数资料用频数、构成比等描述,组间比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线,组间生存曲线比较采用Log-Rank检验。采用Cox比例风险回归模型行多因素生存分析,结果用风险比 (hazard ratio,HR)以及 95%可信区间(confidence interval,CI)表示。双侧P<0.05为差异有统计学意义。
结 果
一、匹配前、后两组临床病理特征相关指标的比较
匹配前,IMPC和IDC两组间ER、HER2、淋巴结转移数、TNM分期及分子分型的差异均有统计学意义(均 P<0.05)(见表 1)。IMPC 组 ER、HER2 阳性率明显高于IDC组,分别为82.0%比71.9%、28.8%比20.8%。IMPC组淋巴结转移率58.6%(65/111)高于IDC组的37.4%(1 072/2 865)。IMPC组与IDC组中淋巴结转移数(1~3 枚)、(4~9枚)、(≥10 枚)的比例分别为 27.1%比 24.2%、17.1%比 8.2%、14.4%比5.0%。IMPC组TNM的Ⅰ期病人比例明显低于IDC组(27.6%比40.1%),而IMPC组Ⅲ期病人比例高于IDC组(31.6%比15.7%)。两组间的年龄、肿瘤直径、组织学分级、Ki67表达及PR的差异均无统计学意义(均 P>0.05)(见表 1)。
经PSM匹配成功109对IMPC、IDC病人。匹配后两组病人的年龄、肿瘤直径、组织学分级、淋巴结状态、Ki67表达、TNM分期、分子分型、ER、PR及HER2表达10个临床病理指标的差异均无统计学意义(均 P>0.05)(见表 1)。
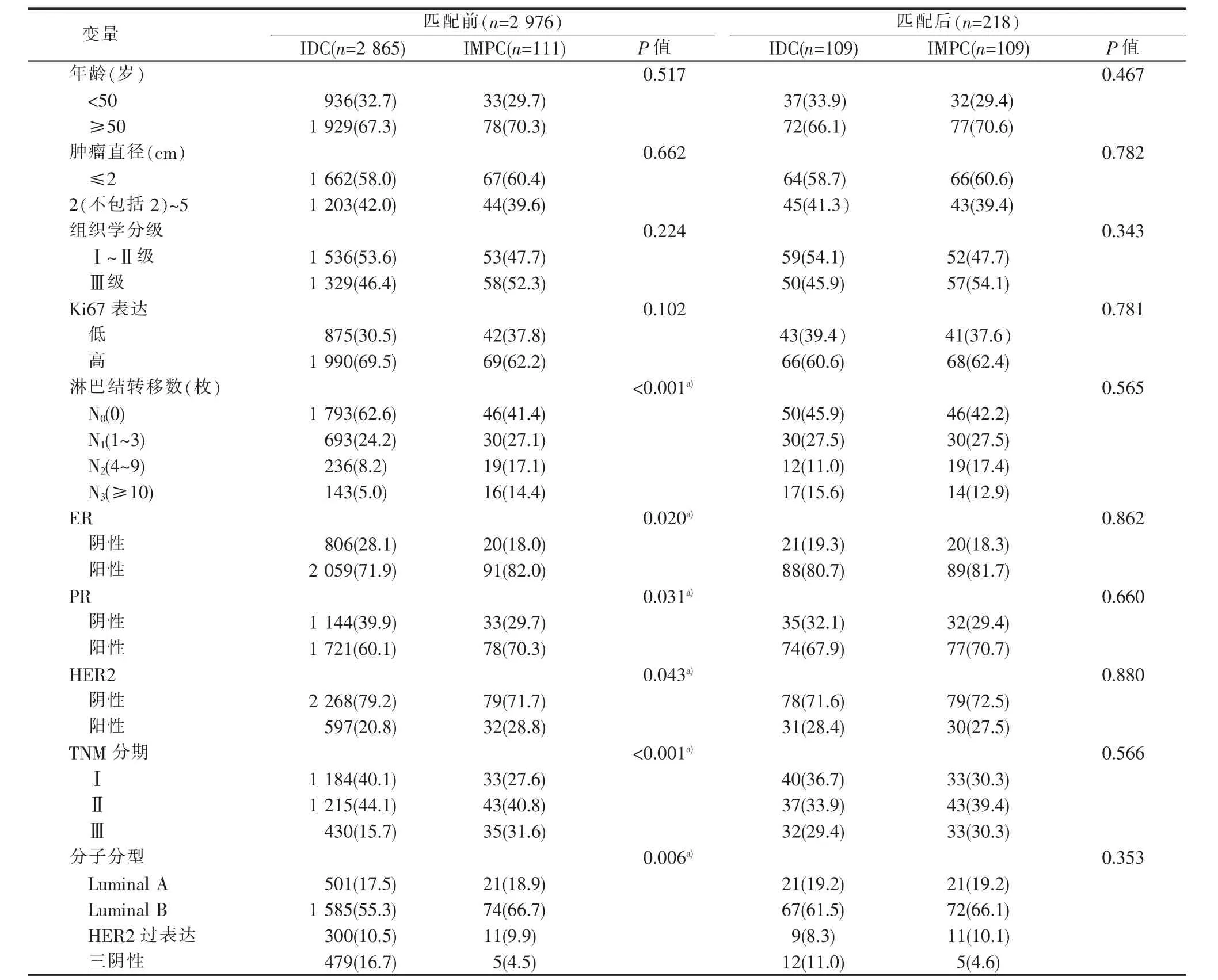
表1 IMPC与IDC组临床病理特征匹配前后比较[n(%)]
二、匹配前、后两组病人治疗情况
匹配前,IMPC组乳房切除率及术后接受内分泌治疗的比例分别为82.0%、81.1%,显著高于IDC组的63.8%、69.7%(均P<0.05)。两组间术后接受辅助化疗、放疗、靶向治疗的比例差异无统计学意义(均 P>0.05)(见表 2)。
匹配后,两组间各治疗方案的比例差异均无统计学意义(均 P>0.05)(见表 2)。
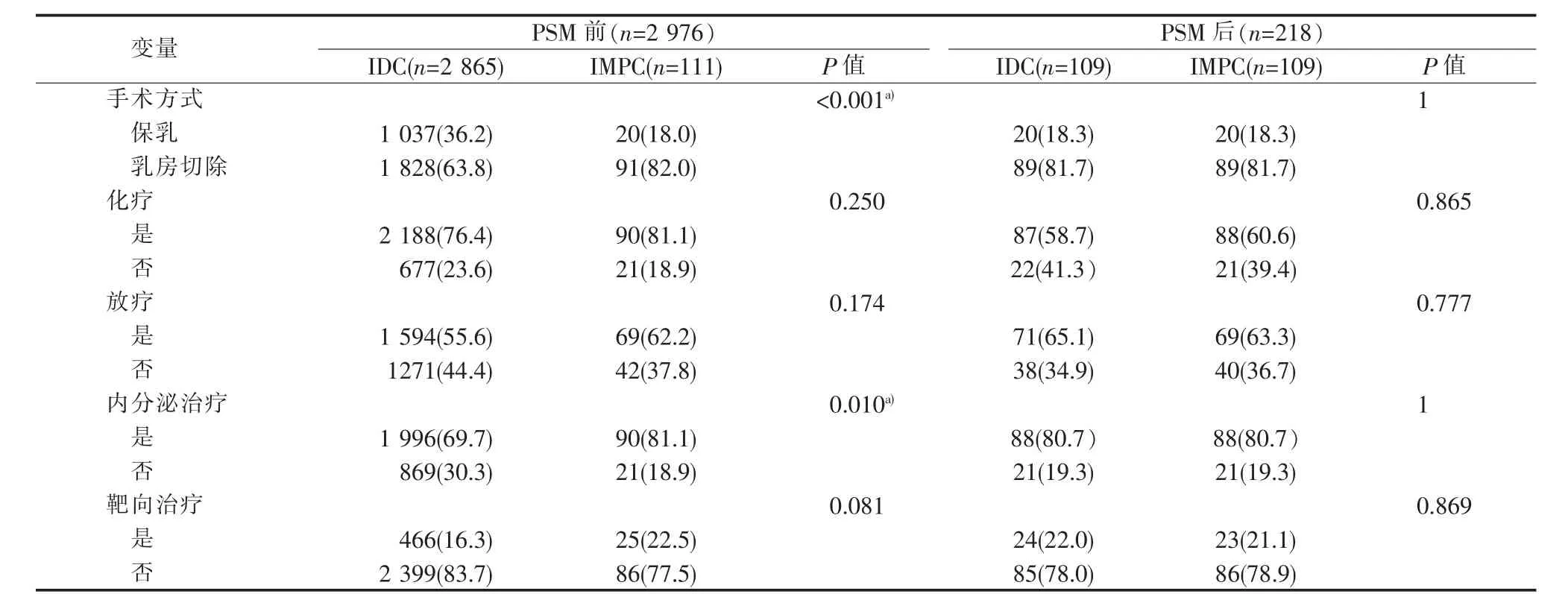
表2 IMPC与IDC组治疗方案匹配前、后比较[n(%)]
三、匹配均衡性检验结果
匹配前研究对象的整体标准化差值为0.577 9,匹配后整体标准化差值为0.009 9,整体均衡性提升98.3%。匹配后两组的临床病理及治疗方案等基线参数标准化差值绝对值均<0.1,组间变量均衡性较好(见图1)。
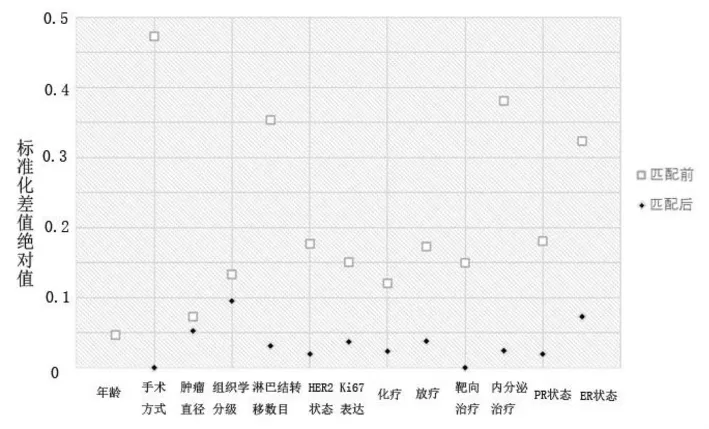
图1 匹配前、后各参数标准化差值绝对值
四、生存分析
匹配前,两组病人中位随访时间为55(9~105)个月。IMPC组BCFI率明显低于IDC组(P=0.022)(见图2A)。两组OS率差异无统计学意义(P=0.268)(见图2B)。匹配后,两组病人BCFI中位时间为44(5~105)个月,OS中位时间为46(13~105)个月,两组的BCFI及OS率差异均无统计学意义(均 P>0.05)(见图 3A、B)。
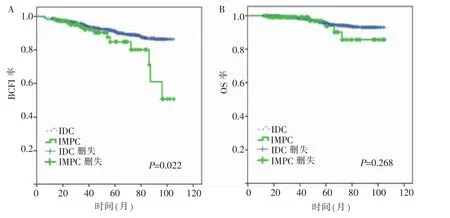
图2 匹配前Kaplan-Meier法绘制的生存曲线
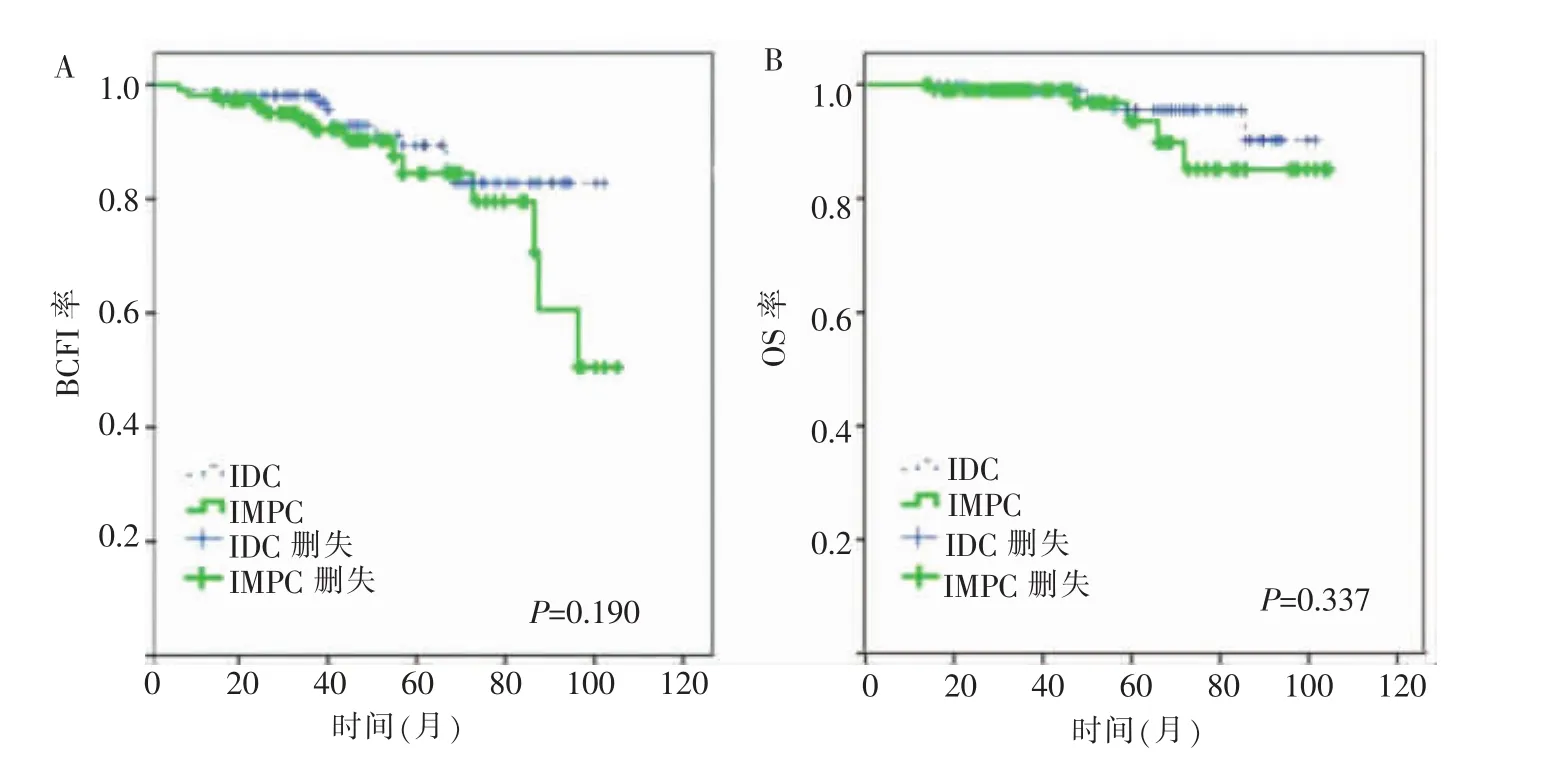
图3 匹配后Kaplan-Meier法绘制的生存曲线
对匹配后队列进行单因素分析的结果显示,IMPC与IDC的联合组ER和HER2、分子分型、组织学分级、淋巴结转移数、TNM分期、放疗、内分泌治疗是 BCFI的影响因素(均 P<0.05);IMPC组年龄、HER2及淋巴结转移数是BCFI的影响因素(均P<0.05);而IDC组BCFI的影响因素为ER、分子分型、肿瘤直径、淋巴结转移数、TNM分期、放疗及内分泌治疗(均 P<0.05)(见表3)。
表3 单因素分析临床病理特征及治疗方案与BCFI的关系
将单因素分析P<0.1的指标及病理类型纳入Cox比例风险模型行多因素分析(见表3)。因分子分型里包含HR、HER2、Ki67相关信息,TNM分期中包含肿瘤直径、淋巴结转移数,故未将分子分型和TNM分期纳入多因素分析。多因素分析结果显示,ER阴性是联合组及IDC组中BCFI的独立危险因素,年龄<50岁是IMPC组BCFI的独立危险因素,而3组BCFI的共同独立危险因素是淋巴结转移>3 枚(见表 4)。
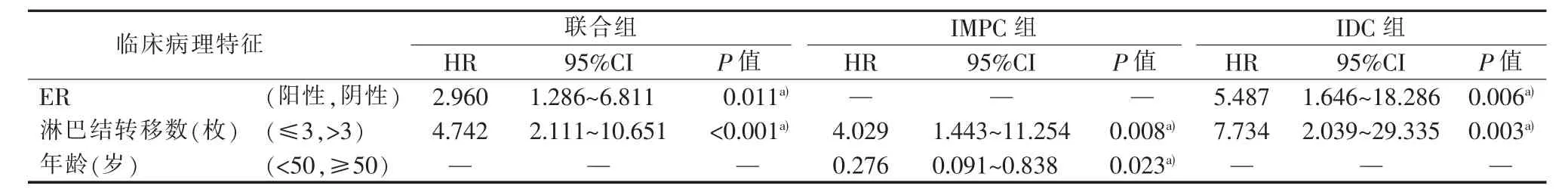
表4 多因素分析临床病理特征与BCFI的关系
讨 论
2020年全球最新癌症数据显示,乳腺癌已成为全球发病率第1的癌症。全球乳腺癌死亡人数占女性癌症死亡首位,严重威胁女性的身心健康[6]。乳腺癌是一种高度异质性疾病,不同的病理亚型具有不同的生物学行为。IMPC典型的组织学形态特征是成簇的肿瘤细胞聚集成大小不等的微乳头状结构(癌巢),且微乳头状结构内无纤维血管轴心,癌细胞簇与周围间质存在间隙[7],EMA染色显示肿瘤细胞呈现“细胞极性翻转”及“内面朝外”的生长模式[8]。关于IMPC的预后尚存争议。因IMPC罕见,既往大多数研究中,IMPC组与IDC组样本数量悬殊,两组间临床病理特征差异明显,难以排除混杂因素对结果的影响。世界卫生组织将IMPC定义为乳腺癌的一种特殊亚型,但对于IMPC诊断中微乳头状结构所占癌灶比例未提出要求。单纯型IMPC很少见。与其他类型乳腺癌相伴发生的混合型IMPC常见,以伴发IDC最常见。既往研究发现IMPC成分是淋巴结转移的预测因素[9-10],而IMPC成分占比的多少与肿瘤的临床病理特征无关[11-12]。付丽等[13]研究发现,伴 IMPC成分与不伴IMPC成分的乳腺癌相比,其侵袭性明显增强。因此,主张只要癌巢中发现IMPC成分就应诊断为IMPC。Marchiò等[14]研究发现,伴 IDC 的混合型 IMPC 与单纯型IMPC的基因组特征及表型相似。因此,本研究采用“有IMPC即诊断”的标准,将单纯型IMPC和伴有IDC的混合型IMPC统一归为IMPC组。
既往研究结果提示,与IDC相比,IMPC的淋巴结转移率、ER 阳性率较高[15-16]。本研究结果显示,匹配前111例IMPC病人中淋巴结转移率、ER阳性率分别为58.6%、82.0%,高于IDC组的37.4%、71.9%,与文献报道一致。IMPC的侵袭性及ER阳性可能与其固有基因特征有关。郑霞等[17]研究发现,极性蛋白 β1 integrin、Rac1、RhoA 在 IMPC 组织中过表达率显著高于IDC。IMPC组织中β1 integrin、Rac1、RhoA表达与淋巴结转移呈正相关;RhoA表达与 ER 正相关。 Marchiò等[14,18]通过组织微阵列分析发现,与ER状态相同的IDC相比,IMPC中细胞周期蛋白D1表达及基因MYC扩增明显升高。
目前国内、外研究关于乳腺IMPC与IDC预后差异的观点尚不统一[15-16,19-23]。 Shi等[20]回顾分析188例IMPC和1 289例IDC病人预后发现,IMPC组病人的乳腺癌特异性生存率及无复发生存率显著低于IDC组。Chen等[16]分析SEER数据库636例IMPC和297 735例IDC病人资料发现,两组病人的5年乳腺癌特异性生存及OS率差异无统计学意义。这些研究大多数是基于病例资料的回顾性分析,两组样本数量悬殊,组间均衡性不足,难以排除混杂因素对结果造成的影响。近年来PSM被广泛应用于非随机对照研究中,其可调整研究对象的基线特征,提高组间变量的均衡性,降低混杂效应,消除选择偏倚,使研究结果接近随机对照研究的效果[24]。Hao等[25]通过PSM 均衡病人年龄、肿瘤大小、淋巴结转移数、激素受体及HER2等混杂因素后,分析324对IMPC及IDC病人的临床病理及预后,发现IMPC不是影响无病生存及OS的独立因素,两组无病生存及OS相似。已有研究结果提示Ki67表达[26-27]、组织 学 分 级[12]及放 疗[16,28]是预后影响因素。本研究发现匹配前IMPC组和IDC组的乳房手术方式(乳房切除或保留)的差异有显著统计学意义(P<0.001)。故将Ki67、组织学分级及治疗方案也纳入匹配的预测变量,进一步均衡混杂因素。通过PSM匹配成功109对,匹配后结果提示两组BCFI率及OS率差异无统计学意义。与既往研究的报道相符:条件匹配情况下,IMPC及IDC病人生存预后相似[12,25,29-30]。对匹配后病例预后影响因素的分析结果显示,病理类型不是预后的独立影响因素,而淋巴结转移>3枚是BCFI的独立危险因素。张世超等[28]回顾分析246例IMPC病理资料发现,淋巴结转移>3枚是IMPC病人无病生存的独立危险因素。Lewis等[31]回顾分析2 660例 IMPC病人病理资料发现,IMPC预后的危险因素包括淋巴结阳性≥4枚及ER阴性。本研究IMPC组ER不是BCFI的影响因素。这可能与研究中ER阴性病人少 (18.3%)、BCFI事件少有关。
本研究有以下不足:①匹配后队列中的死亡病例数较少,暂不能行影响OS因素的分析。本研究将对入组病例进行长期随访。②因IMPC罕见,样本量较少,随访时间较短,未来尚需大规模、更长随访时间的临床研究进一步探究IMPC的预后影响因素。
综上所述:①与IDC相比,IMPC淋巴结转移率及ER阳性率高;②淋巴结转移>3枚是IMPC和IDC预后的独立危险因素。在条件匹配的情况下,两者生存预后相似。
致谢:衷心感谢上海交通大学医学院附属瑞金医院乳腺疾病诊治中心的“上海交通大学乳腺癌数据库”为本研究提供的相关病例资料。

