结肠直肠癌B7S1表达与免疫浸润的关系
王常刚, 刘 坤, 冯浩然, 蒋奕玫, 施毅卿, 陈献则,宋子甲, 李 军, 李 佑, 蔡东莉,赵 任,2
[1.上海交通大学医学院附属瑞金医院(北部院区)普外科,上海 201800;2.上海交通大学医学院附属瑞金医院外科,上海 200025;3.同济大学附属上海市第一妇婴保健院临床转化医学研究中心,上海 200011]
据《全球癌症统计报告》统计,2018年全球新增结肠直肠癌 (colorectal cancer,CRC)病例超过180万例,死亡88.1万例[1]。其死亡率分别列于中国和美国恶性肿瘤死亡率第5位和第2位[2]。得益于术后辅助化疗/新辅助治疗和手术技术的改进,CRC病人的预后在过去几十年中有所改善,但生存率仍不高。转移性CRC病人的5年生存率仅为14%[3]。
B7S1是B7超家族成员之一,B7S1 mRNA(又称VTCN1)在绝大多数人恶性肿瘤中异常表达。多种实体肿瘤中B7S1表达与肿瘤表型相关,如淋巴结转移、肿瘤分期、肿瘤分化程度、复发转移,并与肿瘤浸润淋巴细胞(tumor-infiltrating lymphocyte,TIL)浸润强度相关。利用公共数据库分析VTCN1在CRC的表达及其与CRC临床特征、免疫细胞浸润以及预后的相关性,通过免疫荧光技术检测B7S1在CRC的表达特征,为CRC免疫治疗靶点选择提供依据。
资料与方法
一、公共数据库检索
本研究在6个数据库:①Oncomine肿瘤芯片数 据 库 (https://www.oncomine.org/resource/login.html,查询参数为:P<0.05,fold-change>2以及gene ranking in ALL); ②TIMER 数据库(https://cistrome.shinyapps.io/timer/,肿瘤浸润免疫细胞综合分析);③Kaplan-Meier Plotter 数 据 库 (https://kmplot.com/analysis/,基于荟萃分析的生存生物标志物的发现和验证);④UALCAN 数据库(http://ualcan.path.uab.edu/index.html,利用交互式网络资源用于分析癌症组学数据);⑤LinkedOmics数据库(http://www.linkedomics.org/login.php,来自32种癌症类型和10个临床蛋白质组学肿瘤分析联盟癌症队列的多组学数据);⑥人类蛋白质图谱数据库(https://www.proteinatlas.org/,human protein atlas database,利用各种组学技术绘制细胞、组织和器官中的所有人类蛋白质图谱),筛选评估VTCN1表达水平及其与CRC临床病理特征和病人预后的关系。
二、标本收集
收集2019年1月至12月间,在上海交通大学医学院附属瑞金医院 (北部院区)CRC根治手术病人的肿瘤组织和距肿瘤组织边缘>5 cm正常组织标本,共24例,其中男14例(结肠癌9例,直肠癌5例),平均年龄(61.4±4.0)岁,女 10例(结肠癌5例,直肠癌 5例),平均年龄(66.6±2.9)岁,术后病理诊断均为腺癌。标本于4%多聚甲醛固定保存。病人为首次确诊、未行放化疗以及无远处转移。研究经上海交通大学医学院附属瑞金医院北部院区伦理委员会批准。
三、免疫荧光染色
①石蜡切片制备:每例取一小块肿瘤组织及正常组织分别固定于4%多聚甲醛中,用石蜡包埋。用组织切片机切下2片厚度5~6 μm的组织,分别贴于阳离子防脱玻片上,37℃烘箱过夜干燥。②将切片置于玻片盒,二甲苯中脱蜡、乙醇中脱水。漂洗后甩去切片上多余水分,注意防止组织过度干燥。③抗原修复:将切片置于1×抗原修复液中,95~100℃保温20 min后,置于室温,待抗原修复液自然冷却至室温。④1×PBS漂洗后用含10%驴血清的1×PBS室温封闭30 min。⑤甩干封闭液后,加适量5%驴血清抗体稀释液配制的一抗 (anti-human B7S1:Biolegend 公司,Cat#358101;anti-human CD45:Abcam 公司,Cat#ab10559)混合液4℃封闭过夜。⑥1×PBS漂洗,加1%驴血清适量抗体稀释液配制的二抗[AffiniPure F(ab’)2 Fragment donkey anti-rabbit/mouse/goat immunoglobulin]混合液室温 30 min。 ⑦1×PBS漂洗,用含DAPI的封片剂封片。⑧用Zeiss(LSM780)倒置荧光显微成像系统采集图像信息。⑨使用ImageJ软件进行定量分析。
四、统计学分析
使用Prism 6.0软件(GraphPad)进行统计学分析。所有值用均数±标准差表示。P<0.05为差异有统计学意义。
结 果
一、B7S1 mRNA在CRC中的表达水平
Oncomine数据库检索分析显示,与正常组织相比,CRC的VTCN1表达在6个数据集中均增加。此外,VTCN1在宫颈癌、食管癌、肝癌、肺癌、淋巴瘤、卵巢癌中也升高,而在乳腺癌、肾癌、黑色素瘤、胰腺癌、前列腺癌中的表达较低(见图1A)。为进一步评估CRC中VTCN1表达水平差异,使用TIMER数据库分析TCGA RNA测序数据验证VTCN1的表达(见图1B)。结果显示CRC组织中VTCN1的表达明显高于正常肠道组织。
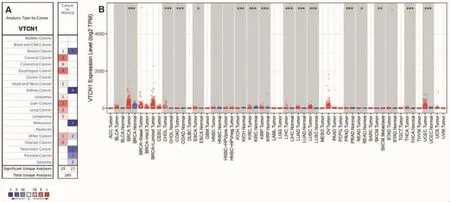
图1 VTCN1在不同肿瘤类型中的表达
与正常组织相比,VTCN1在多种CRC亚型中高表达,包括结肠腺癌(P=1.34×10-9)、结肠黏液腺癌(P=6.91×10-7)、盲肠腺癌(P=7.40×10-7)、直肠腺癌(P=4.56×10-10)、直肠黏液腺癌(P=0.001)、直肠乙状结肠腺癌(P=0.019)(见表1、图2)。
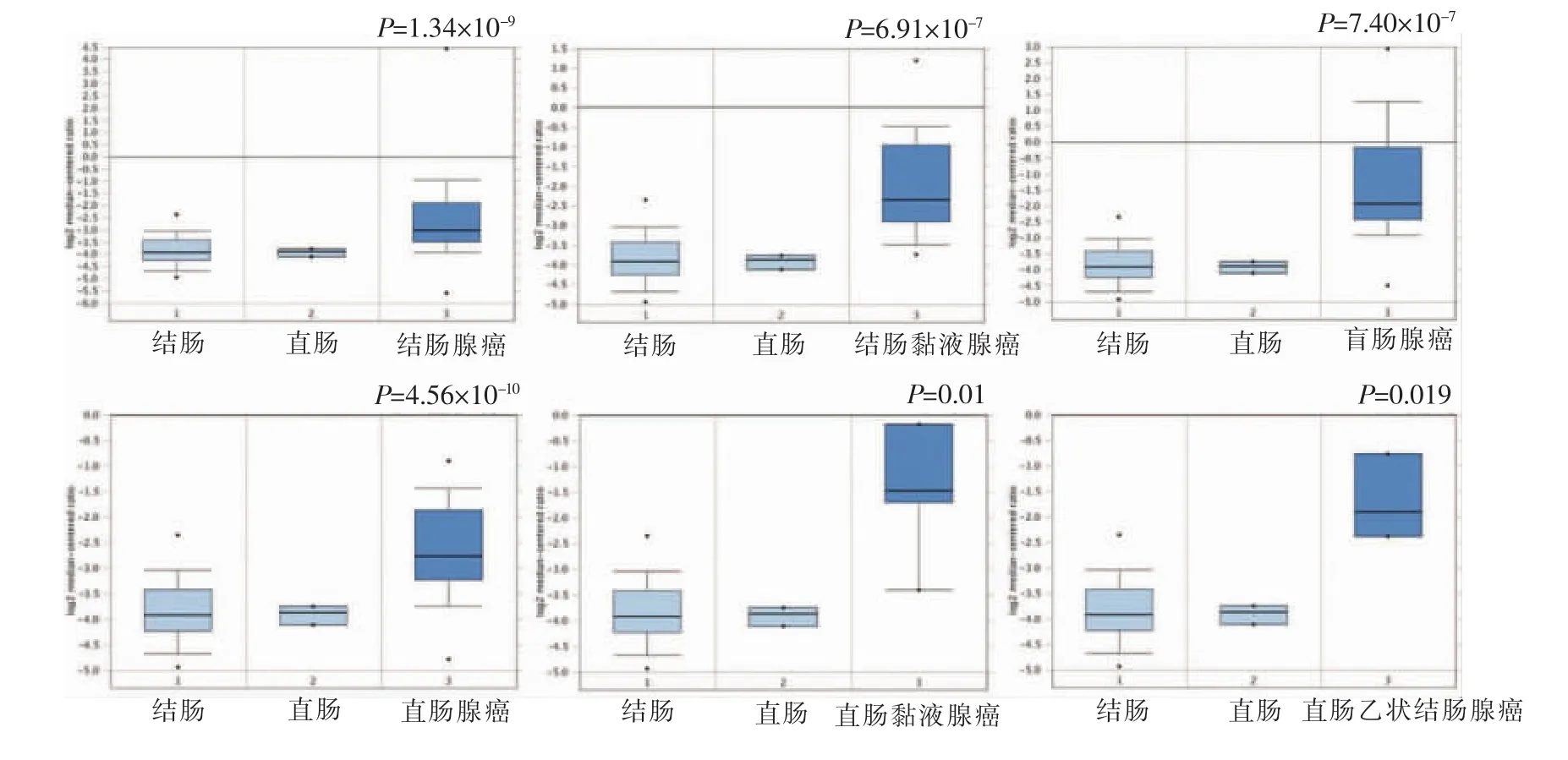
图2 Oncomine数据库分析CRC组织和正常组织VTCN1的表达
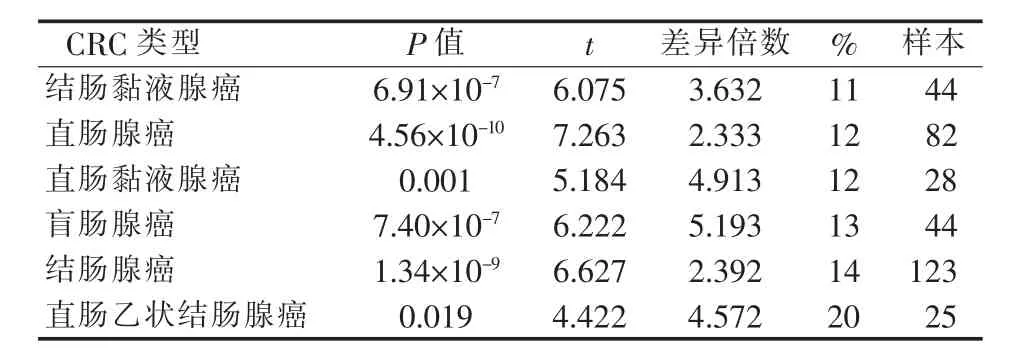
表1 B7S1 mRNA在不同类型CRC中的表达水平差异(Oncomine数据库)
二、B7S1 mRNA与CRC临床病理特征的关系
从UALCAN数据库中的TCGA数据进一步研究VTCN1与CRC临床病理特征间的关系。结果发现除Ⅱ期直肠癌(P=1.65×10-1),其余不同分期的结肠直肠癌组织与正常组织中的VTCN1表达水平均存在显著差异。分别为Ⅰ期结肠癌(P=7.38×10-4)、Ⅱ期结肠癌(P=1.17×10-4)、Ⅲ期结肠癌(P=1.86×10-3)、Ⅳ期结肠癌(P=4.85×10-2),Ⅰ期直肠癌(P=4.06×10-2)、Ⅱ期直肠癌 (P=1.65×10-1)、Ⅲ期直肠癌(P=1.06×10-2)、 Ⅳ期直肠癌 (P=1.46×10-2)(见图3)。在淋巴结转移方面,亦存在一定差异。除直肠癌N0(P=1.14×10-1),其余差异均有统计学意义。分别为结肠癌 N0(P=1.42×10-6)、N1(P=3.58×10-4)、N2(P=6.50×10-3),直肠癌 N1(P=4.69×10-3)、N2(P=1.59×10-2)(见图 3)。
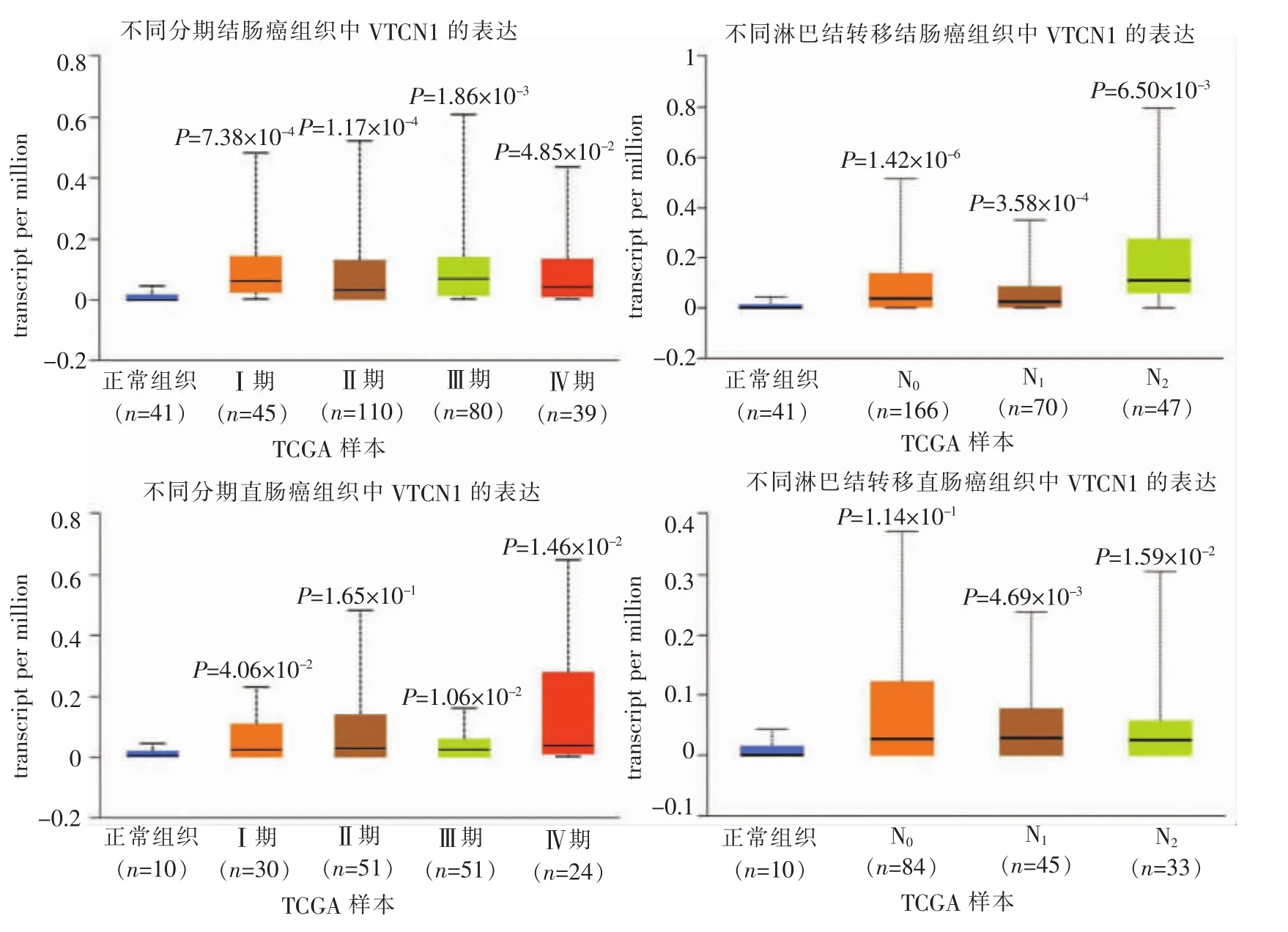
图3 UALCAN数据库查询VTCN1与CRC不同分期及淋巴结转移的关系
同时,通过LinkedOmics数据库分析TCGA数据,发现VTCN1与CRC的M分期存在一定的相关性。主要为有远处转移的病人VTCN1表达水平显著高于未转移的病人,M1与M0差异有统计学意义(P=4.98×10-2)。在CRC的错配修复(mismatch repair,MMR)方面,VTCN1与其具有一定的相关性,表现为微卫星高度不稳定(microsatellite instability-high,MSI-H)较微卫星稳定(microsatellitestable,MSS)的VTCN1表达水平显著升高(P=1.55×10-6)(见图 4)。
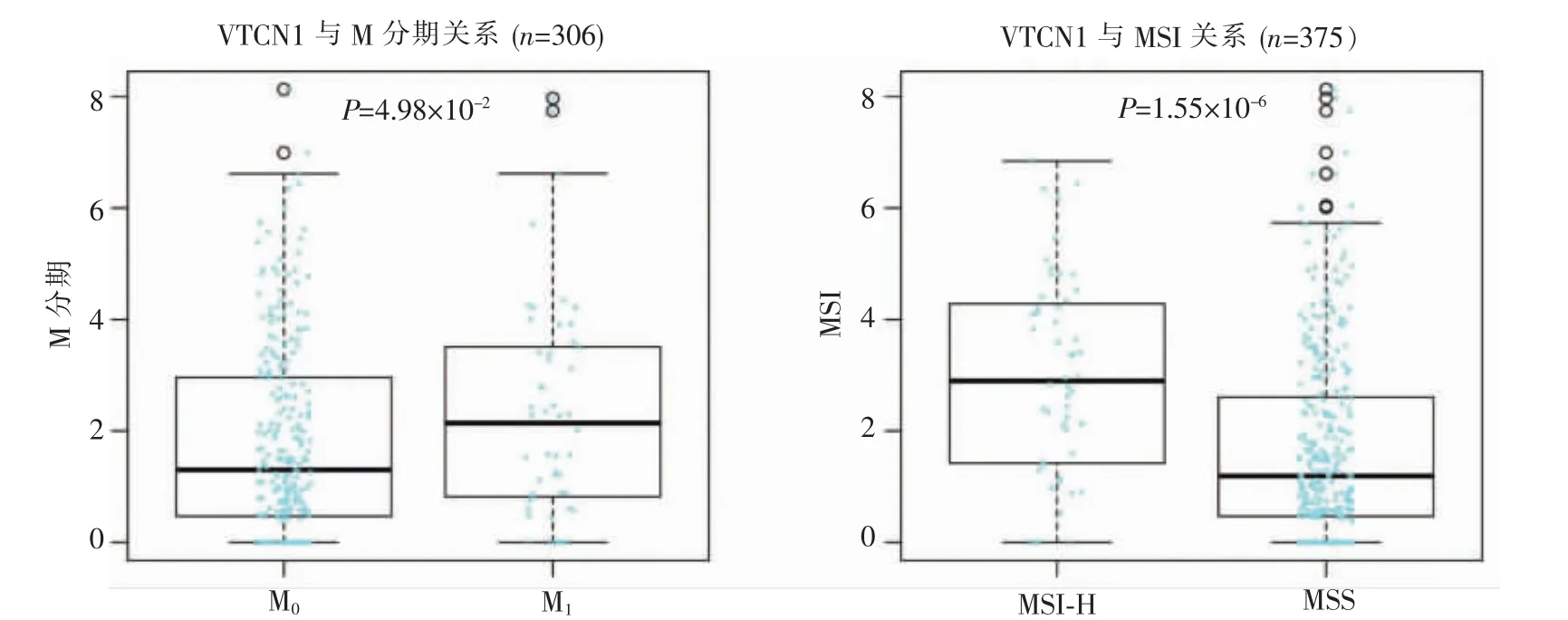
图4 LinkedOmics数据库查询VTCN1与CRC远处转移及MSI的关系
三、VTCN1与CRC预后的相关性
通过包含TCGA RNA测序数据的人类蛋白质图谱数据库来分析VTCN1与CRC预后的相关性。结果显示VTCN1表达水平高低与CRC的总生存率不相关(P=0.30)(见图5A)。TNMⅢ~Ⅳ期结肠癌中,VTCN1低表达与总生存率的增加相关(P=0.008)(见图5B),TNM Ⅲ~Ⅳ期直肠癌中,VTCN1高表达却相对拥有更好的总生存率(P=0.012)(见图5C)。
在Kaplan-Meier Plotter数据库对直肠癌VTCN1表达与总生存率的相关性作进一步分析,发现Ⅰ、Ⅱ、Ⅳ期直肠癌VTCN1高表达组总生存率有相对增加的趋势。对比VTCN1低表达组及高表达组总生存率,Ⅰ期直肠癌(P=0.34)(见图5D)和Ⅱ期直肠癌(P=0.14)(见图5E)中差异无统计学意义,Ⅳ期直肠癌的VTCN1表达与生存率相关性有统计学意义(P=0.007 1)(见图5G)。与此不同的是Ⅲ期直肠癌,其VTCN1低表达组预后更好 (P=0.003 2)(见图5F)。这可能与不同CRC以及不同临床分期肿瘤微环境相关。
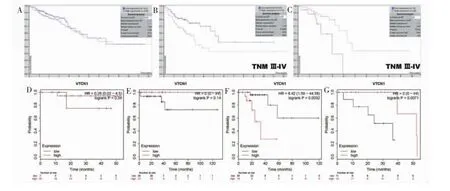
图5 人类蛋白质图谱数据库/Kaplan-Meier Plotter数据库的VTCN1与CRC总生存率的相关性
四、VTCN1与CRC肿瘤浸润免疫细胞/粒细胞有关
分析VTCN1与免疫细胞/粒细胞浸润的相关性,包括B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突状细胞。结果表明,结肠癌组织VTCN1的表达与 B细胞 (P=1.09×10-3)、CD8+T细胞(P=7.60×10-4)、中性粒细胞(P=1.80×10-2)、树突状细胞(P=5.40×10-3)的浸润水平呈显著正相关。直肠癌组织中VTCN1的表达与CD8+T细胞 (P=1.29×10-2)、中性粒细胞(P=4.24×10-2)的浸润水平呈正相关,差异有统计学意义(见图6)。当然,由于结肠癌及直肠癌的肿瘤纯度不显著 (分别为P=0.05、P=0.7),VTCN1与此6种免疫细胞浸润的具体相关性仍有待进一步研究。
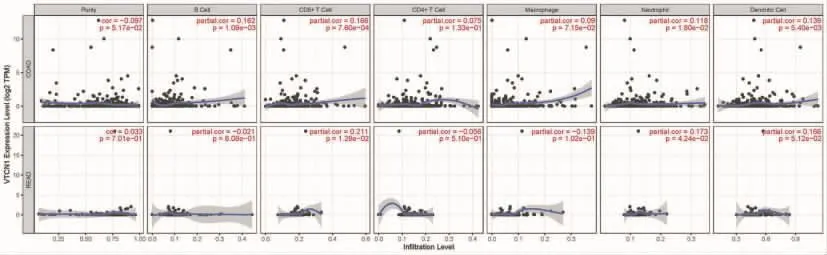
图6 TIMER数据库查询VTCN1与CRC肿瘤浸润免疫细胞/粒细胞的相关性
五、B7S1在CRC微环境中蛋白质表达水平的差异
从蛋白质水平评估B7S1在CRC肿瘤微环境中的表达。为检测CRC肿瘤组织中B7S1的表达模式,收集24例CRC样本,对正常肠道组织、CRC标本进行抗CD45、抗B7S1的免疫荧光染色。结果显示,在肿瘤组织切片中,B7S1表达水平明显高于正常组织(P<0.000 1)(见图7A、B),同时在肿瘤组织中B7S1在CD45-及CD45+免疫细胞中均有表达,提示CRC组织及免疫细胞均上调表达B7S1(见图7A)。表明B7S1可能参与CRC肿瘤免疫调控过程。
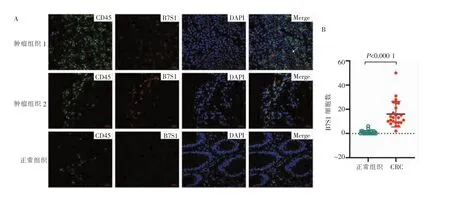
图7 免疫荧光染色分析B7S1在CRC的表达
讨 论
肿瘤免疫治疗,特别是免疫检查点阻断治疗成为包括CRC在内多种实体瘤的一种极具潜力的治疗手段[4]。在CRC中,肿瘤浸润的CD8+T淋巴细胞被认为是介导抗肿瘤免疫反应的主要效应细胞,其浸润程度可作为判断肿瘤预后的指标[5]。然而,在肿瘤微环境中,肿瘤细胞会利用各种条件负向调控CD8+T淋巴细胞的作用,以逃避免疫监视、促进肿瘤进展,其中包括上调共抑制性免疫检查点分子[6]。免疫检查点分子主要来自B7-CD28超家族和肿瘤坏死因子受体超家族。参与T淋巴细胞活化第2信号,包括共刺激性和共抑制性分子,通过增强或减弱T淋巴细胞受体下游信号,精确调控T细胞的激活程度和应答强度。研究证实,阻断共抑制性免疫检查点分子可增强CD8+TIL的抗肿瘤活性并维持其高度持久的抗肿瘤免疫反应[7]。目前利用免疫检查点拮抗型单抗对肿瘤进行人工干预,以延缓CD8+T淋巴细胞衰竭,提高抗肿瘤免疫应答效应已在临床上显示明显有效的抗肿瘤疗效[4]。
程序性细胞死亡蛋白1(programmed cell death protein 1,PD-1)/PD-L1单抗属于经典的免疫检查点拮抗剂,目前在多种实体瘤中表现出持久、有效的抗癌效果[8]。研究指出,PD-1拮抗剂nivolumab和pembrolizumab在转移性CRC病人中疗效显著。这些病人具有高水平的MSI-H或错配修复缺陷(different mismatch repair,dMMR)[9-10]。 然而, 由于MSI-H或dMMR在CRC中的发生率仅约15%[9]。绝大多数微卫星稳定或微卫星不稳定水平较低(microsatellite instability-low,MSI-L)的CRC病人对此类治疗的应答显得尤为温和[9]。因此,需针对CRC筛选出更有价值的免疫治疗靶点。
虽然其经典的PD-1及其配体PD-L1阻断治疗在多种实体瘤中表现出持久有效的广谱抗癌效果,但仅有部分病人受益于此类治疗方案[8]。因此,亟待针对特定肿瘤筛选出特异性的免疫治疗靶点。PDL1所属的B7家族目前已知成员包括CD80(B7-1)、CD86(B7-2)、PD-L1(B7-H1)、PD-L2(B7-DC 或CD273)、ICOSL(B7-H2)、CD276(B7-H3)、B7S1(B7-H4、B7x 或 Vtcn1)、VISTA (B7-H5、GI24 或 PD-1H)、B7-H6 和 B7-H7(HHLA2)[11]。
本研究利用公共数据库对VTCN1在CRC中的表达及其与临床特征的相关性进行系统分析。利用免疫荧光染色技术检测B7S1蛋白水平在CRC肿瘤微环境中的表达和分布特征。无论是mRNA还是蛋白质水平,B7S1在正常肠道组织和CRC中均有一定程度的表达,只是在恶性肿瘤中其表达量明显上调,说明B7S1在CRC发生、发展中可能发挥重要调控作用。分析发现,VTCN1表达水平在不同类型的CRC中差异有显著统计学意义,提示B7S1的表达量可能受不同肿瘤微环境影响。此外,VTCN1水平与CRC的分期、淋巴结转移及远处转移存在相关性,并与MMR状态也存在一定联系。在不同临床分期或不同亚型CRC中,VTCN1表达水平和总生存率之间的相关性有一定差异。这也可能与不同肿瘤类型、不同临床分期的肿瘤微环境差异相关。
在蛋白质水平,与 PD-L1 类似[2],与正常肠道组织比较,B7S1在CRC组织中表达上调。不同的是,PD-L1在 CRC中主要表达在 CD45-细胞上,而B7S1在CD45-和CD45+细胞上均有表达。在肝癌中,CD45+免疫细胞上表达的B7S1主要分布在巨噬细胞,髓样树突状细胞和单核细胞骨髓源性抑制细胞等髓样细胞上[12]。B7S1假设性受体被诱导表达在活化的T淋巴细胞表面[12-13]。B7S1及其受体的表达模式,强烈提示B7S1在调控T淋巴细胞活化中的作用。B7S1和PD-1/PD-L1联合阻断在肝癌动物模型中表现出明显的协同效应。鉴于B7S1在CRC中的特征,B7S1联合PD-1/PD-L1阻断治疗可能是一种新的CRC治疗策略。然而,包括本研究在内的其他相关探索样本量小,缺乏系统性研究。因此,需对更大样本量的CRC病人进行详细的检测分析,以解决此重要问题。

