基于高原低氧适应性的藏鸡胚胎Hb分子表达分析
李倩

摘 要:藏鸡具有良好的克服低氧损害、低氧适应性能力。基于鸡红细胞生成与珠蛋白表达分析,选择403只隐性白鸡、111只藏鸡为样品,低氧环境分别选择为13%氧含量、12%氧含量,采取全期低氧、阶段性低氧模式,对上述2个品种鸡的血红蛋白突变、位点等进行实验分析。结果表明:藏鸡对低氧适应能力较强,在低氧环境诱导下,藏鸡胚胎的珠蛋白量增加。
关键词:高原低氧适应性;藏鸡胚胎;Hb分子
中图分类号:S831.2 文献标识码:B文章编号:1673-1085(2021)7-0018-04
藏鸡是青藏高原地区特有的原始鸡种,多分布于海拔高度为2200~4100m的区域[1]。因藏鸡生长过程中,长期面对低氧环境,所以藏鸡在其机体、生理等方面构建了较强的适应能力机制。据此,本实验以鸡红细胞生成与珠蛋白表达为切入点,选取藏鸡、隐性白鸡2个鸡品种的胚胎进行低氧环境试验,以进一步探讨藏鸡高原低氧适应的Hb(Hemoglobin,血红蛋白)分子机制。
1 鸡红细胞生成与珠蛋白表达
脊椎动物的造血位点根据造血干细胞群的变化而变化;哺乳动物的造血位点顺序为卵黄囊、胎儿肝脏、脾、成年骨髓。但鸡不以胎儿肝脏为造血器官,在骨髓形成前,在卵黄囊、肠系膜中生成血细胞。具体而言,鸡胚胎在发育的第3~5天,造血位点在主动脉的腹壁上;第6~8天,造血祖细胞在叶间细胞中分部[1]。
在鸡胚胎发育过程中,α族、β族珠蛋白受到严格调控,胚胎发育早期,π、ρ、ε珠蛋白基因表达,其他基因沉默;胚胎发育后期,珠蛋白表达方式与胚胎发育早期的珠蛋白表达相反[2]。基于高原低氧环境,鸡胚胎在不同发育阶段的表达是否能够表现出适应性调控,需要对藏鸡胚胎的高原低氧适应性的Hb分子机制进行探讨。
2 材料与方法
2.1 样品来源与低氧孵化模拟
2.1.1 样品来源 实验鸡选择隐性白鸡(白羽肉鸡)和藏鸡,隐性白鸡的种蛋来源于中国农大种鸡场,共计403个;藏鸡的种蛋来源两个群体,35个来自中国农大种鸡场,76个来自西藏不同海拔地區的混合群体。
2.1.2 低氧孵化模拟 孵化全程采用低氧、阶段低氧两种方式进行,对隐性白鸡、藏鸡种蛋进行同时孵化,低氧孵化时的氧气浓度为13%、12%,温度控制为37.5 ℃左右,湿度控制在61%左右,翻蛋次数为1次/2 h[2]。同时,低氧环境下,不对种蛋进行开箱照蛋处理,21 d后,鉴定鸡胚胎死亡日龄。全程低氧环境下藏鸡种蛋数为76个,隐性白鸡种蛋数为233个;阶段低氧环境下藏鸡种蛋数为119个,隐性白鸡种蛋数为152个。
2.2 溶液制备
溶液制备包括:0.5M EDTA试剂、50×TAE缓冲液、10×TBE缓冲液等;RNA提取试剂包括:0.1%的DEPC处理水、70%与75%的乙醇、水饱和酶等[2]。
2.3 血氧饱和度测定
第14天时,对鸡胚胎进行采血测验,血液采自尿囊静脉,采血时间控制在5 min内,并应用肝素钠抗凝。
基于SWISS-MODEL蛋白预测服务器完成突变血红蛋白三级与四级结构的预测,并对血氧饱和度数据、珠蛋白表达数据进行分析[2]。
3 结果与分析
3.1 根据全期低氧的试验分析
总结出76个藏鸡和233个隐性白鸡的种蛋在氧气浓度为13%环境下死亡个数、孵化个数(21 d);35个藏鸡和170个只隐性白鸡的种蛋在氧气浓度为12%的环境下的死亡个数、孵化个数(21 d),具体如表1所示。
为保证实验的可靠性,各阶段的藏鸡、隐性白鸡的种鸡数量设置有所不同,藏鸡、隐性白鸡胚胎在氧气浓度为12%的环境下的阶段存活率、孵化率(21 d)具体如表2所示。
从表1、表2分析可知,海拔越高,隐性白鸡比藏鸡的死亡幅度越大,低氧耐受能力越差。在全期低氧环境下,13%的氧气浓度下隐性白鸡的孵化率为3.1%;12%的氧气浓度下,藏鸡也无法适应,孵化率只有11.3%。同时,根据卡方独立性检验,各阶段与品种因素内各水平间不显著(P>0.05);而孵化率方面,不同品种间差异显著,但低氧阶段间差异不显著(P>0.05) [2-3]。
3.2 Hb突变位点检测
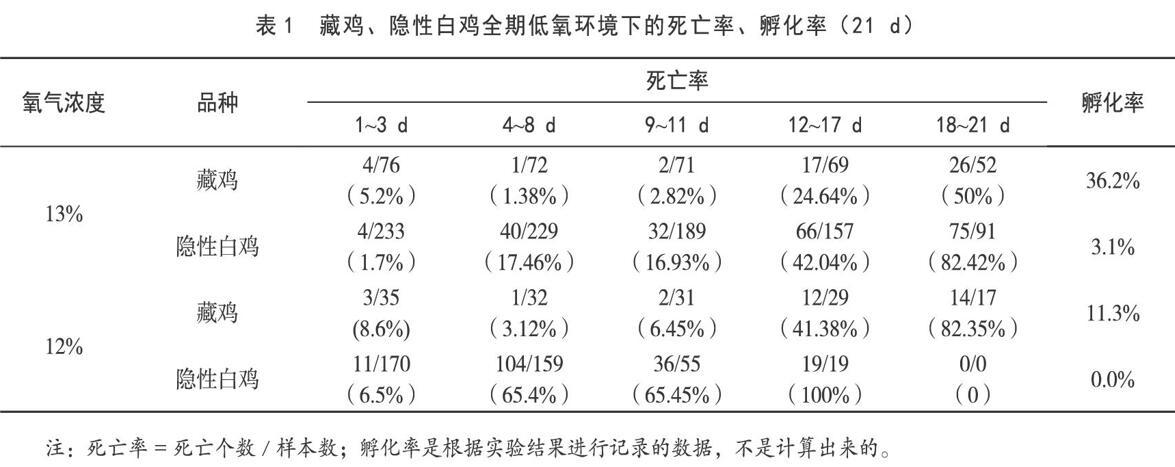
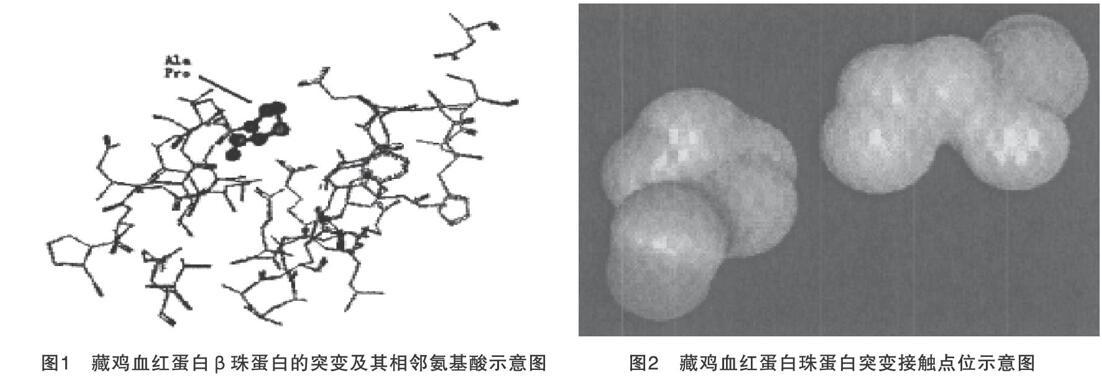
针对存活的隐性白鸡、藏鸡的血红蛋白突变位点进行检测,隐性白鸡中未检测到突变,藏鸡α链存在突变Met-32D(B13)-Leu[4]。通过对其蛋白质序列分析,预测其血红蛋白的三维结构。图1为藏鸡血红蛋白β珠蛋白的突变及其相邻氨基酸示意图;图2为接触点位示意图;图3为藏鸡血红蛋白阶段表达谱示意图。
由图2分析可知,藏鸡的两个血红蛋白接触位点的两个氨基酸之间的距离,根据范德华力作用距离,该突变产生较弱的范德华力作用,突变位点Ile-55H(D6)-Leu处于同一螺旋的突变Ala-51H(D2)-Pro发生于分子表面,未发生新的分子作用力变化。
从图3可以看出鸡胚中有7种血红蛋白(HbA、HbD、HbP、HbM、HbE、HbL、HbH),左图中显示各珠蛋白转换效率差异性大,Alpha A在种鸡孵化第3天时,珠蛋白百分比为85.69%;在孵化第18天时,珠蛋白百分比为26.75%,在低氧环境下,珠蛋白将直接影响血红蛋白百分比。从图3右图分析可知,在种鸡孵化第4天时,Hbp的血红蛋白百分比为14.85%;孵化第8天后,逐渐趋于0,这与常氧环境下种鸡孵化相比,血红蛋白组合出现巨大差异。同时右图中,胚胎中的HbE血红蛋白百分比为90%,超过其他种类血红蛋白含量,因此,HbE成为藏鸡胚胎的主要血红蛋白[5]。
4 讨论
结合上述实验结果分析,在全期低氧情况下,藏鸡的死亡集中于12 d以后,表明藏地的低氧高适应性表现为4~11 d。阶段性低氧情况下,藏鸡的孵化率为80%以上,与常氧下的孵化率相近。同时,藏鸡的低氧损害后期恢复能力较强,孵化率较高。另外,藏鸡胚胎血红蛋白的7个亚基分析可知,藏鸡胚胎的基因频率越高,孵化率越高,因此可以认为基因的突变是一种低氧适应性能力的突变[6]。除此之外,结合实验结果,藏鸡的珠蛋白突变,有效提升了其血红蛋白的氧亲和力以及血液的氧亲和力,进而表现出藏鸡胚胎对低氧的高适应能力。由于血红蛋白在与氧结合的过程中,可以通过变构,使β链、H螺旋靠近,以增强血红蛋白释放的氧量,维持组织需要[6]。但在藏鸡胚胎中,球蛋白变异与人类的血红蛋白HbF变异相似,保证了藏鸡胚胎在低氧环境中,具有较高的血氧亲和力[6]。在低氧诱导下,藏鸡胚胎的珠蛋白基因表达受到抑制。
5 結论
本试验结果显示,藏鸡胚胎孵化率随着海拔的升高显著性逐渐降低,氧气含量为12%的低氧环境中,藏鸡胚胎低氧适应性不强,孵化率为11.3%。结合全期低氧实验结果表明,藏鸡低氧死亡集中于12 d以后。同时,在12%氧气含量的低氧环境诱导下,藏鸡胚胎的珠蛋白表达增加,使血红蛋白量增加。另外,在血红蛋白功能位点方面,HbP的血氧亲和力最强,HIF-1α直接参与红细胞转换、珠蛋白低氧开关机制调控。
参考文献:
[1] 商鹏, 董亚南, 朱新海,等. 藏鸡育种研究现状及建议[J]. 中国家禽, 2019, 41(01):45-49.
[2] 张莹, 张戌园, 张浩,等. 转铁蛋白基因表达与低氧适应[J]. 中国家禽, 2019(22):5-8.
[3] 王志敏, 徐亚欧, 杨磊,等. 不同海拔地区藏鸡生理生化指标的研究[J]. 畜牧与饲料科学, 2018, 39(02):1-7.
[4] 贾腾飞. 藏鸡高原低氧环境适应机制的研究进展[J]. 畜禽业, 2018, 29(12):15-18.
[5] 张红亮, 张浩. 藏鸡低氧适应研究进展[J]. 中国家禽, 2018, 40(08):47-52.
[6] 唐晓惠, 强巴央宗. 藏鸡对高原低氧环境适应性的研究现状与展望[J]. 中国家禽, 2015, 37(18):1-4.
Analysis of Hb Molecular Expression in Tibetan Chicken Embryos Based on High Altitude Hypoxia Adaptability
LI Qian
(College of Preparatory Education, Qinghai University for Nationalities,
Xining 810000, China)
Abstract: Tibetan chicken has a good ability to overcome hypoxia damage and adaptability.Based on the analysis of chicken erythropoiesis and globin expression, 403 recessive white chickens and 111 Tibetan chickens were selected as samples. The hypoxic environment was selected as 13% oxygen content and 12% oxygen content, respectively. Total hypoxia and phased hypoxia were adopted. Model, experimental analysis of hemoglobin mutations and loci of two breeds of chickens.The results show that Tibetan chickens have a strong ability to adapt to hypoxia. Under the induction of hypoxia, the globin content of Tibetan chicken embryos increases.
Keywords: Plateau hypoxia adaptability; Tibetan chicken embryo; Hb molecules

