水稻卷叶类型及调控机制研究进展
邓秋雨,肖应辉
(湖南农业大学农学院,长沙 410128)
水稻(Oryza sativaL.)是世界上最重要的粮食作物之一[1],提高水稻产量是水稻育种主要的目标,增加水稻产量对我国乃至世界粮食安全都具有重大意义。光合作用是影响水稻产量的主要因素之一,而叶片是水稻进行光合作用的主要场所,所以改变叶形、增大植株光捕获率从而增强光合作用对提高水稻产量具有重要影响。
相关研究表明,水稻叶片适度卷曲有利于提高植株的光合效率,增加光合产物的有效积累量[2]。叶片适度卷曲能使叶片保持直立不披垂,增加水稻群体受光面积和光能利用率,进而显著增加光合效率。此外,叶片适度卷曲还有利于水稻群体内的空气流通,为光合作用提供充足的CO2;也有利于蒸腾作用,促进水稻植株生长发育。叶片光合作用、蒸腾作用和呼吸作用的增强还能提高水稻根系的活力及植株的抗性,为增加产量提供保障[3,4]。但是,若叶片高度卷曲甚至内卷或外卷成圆筒状,则会导致叶片表面的漏光损失增大,水稻植株光能利用率降低。
本文主要综述水稻卷叶的类型及调控机制研究进展,总结已定位的76 个卷叶相关调控基因,并整理其中39 个已克隆的卷叶相关调控基因及基因功能,为水稻卷叶性状的研究提供新的理论依据。
1 水稻卷叶的类型
目前的研究发现,水稻卷叶突变体叶片卷曲的类型有3 种:内卷、外卷和扭曲。内卷即叶片朝近轴面(腹面)卷曲,外卷是叶片朝远轴面(背面)卷曲,扭曲则没有规则。从卷曲位置上划分,可以分为全部叶片卷曲和部分叶位叶片卷曲(如剑叶、倒二叶、倒三叶等)。以叶片卷曲度来划分,可分为高度卷曲(极度内卷或极度外卷成圆筒状)、中度卷曲(叶片明显卷曲成U 形)和轻微卷曲(两侧或单侧叶缘微卷)。也有部分卷叶性状在特定生育期才会表现,如在苗期表现为卷叶而在生育后期叶片逐渐平展,在生育前期为平展叶表型而在后期叶片逐渐卷曲等,所以也可根据卷曲发生的时期来分为特定生育期卷曲和全生育期卷曲。而在全生育期卷曲中,又存在着全生育期叶片卷曲程度一致和随着植株的生长发育,叶片卷曲程度逐渐增强的情况。
2 水稻卷叶形成的细胞学原因
水稻卷叶突变体叶片的组织切片分析发现水稻卷叶形成的细胞学原因大致可分为四大类。
第一类:因泡状细胞形态、大小、数量和分布的改变导致水稻叶片卷曲,这也是水稻卷叶突变体叶片卷曲的最主要原因。一般情况下,增加泡状细胞的数量或大小会导致叶片外卷[5,6];相反,减少泡状细胞的数量或大小通常会导致叶片内卷[7,8]。如果水稻卷叶性状受基因调控,则是不可逆的;当受到环境胁迫时,如干旱胁迫、蒸腾作用加强、细胞失水等原因引起泡状细胞皱缩使叶片卷曲则是可逆的,在水分充足条件下,泡状细胞吸水,卷叶又可恢复为平展叶[9]。
第二类:薄壁细胞和厚壁细胞的变化导致卷叶的形成。薄壁细胞是大多数植物体内数目最多的细胞,其功能很多,如贮藏营养物质、进行光合作用和需氧呼吸等;而厚壁细胞在植物体内主要起支撑作用。姜建芳研究表明,水稻细卷叶突变体OSPM11的薄壁细胞呈现出严重变形且排列无规则[10]。陈炜[11]的研究表明,nrl3突变体表型窄卷叶是叶片远轴面厚壁细胞发育缺陷导致的。Zhang 等[12]研究发现,水稻叶片卷曲是由于其背面厚壁细胞发育不良,叶片失去支撑力,造成了叶片极度内卷。Zou 等[13]的研究也表明,厚壁细胞的部分缺失会导致卷叶的形成。
第三类:维管束中细胞的变化对水稻叶片卷曲产生重要影响。水稻twi1突变体叶片扭曲,实验证明TWI1具有控制维管束细胞特异性分化的功能[14]。显性内卷叶突变体70-36 从6 叶期才开始卷曲,组织切片结果表明,叶片内卷的细胞学原因为中脉和侧脉维管束远轴面的叶肉细胞不能正常分化[15]。由于水稻phe1突变体的叶脉维管束韧皮部中筛管细胞增多,整个韧皮部的面积显著增大,从而使叶脉远轴面皱缩导致叶片外卷[16]。
第四类:角质层、表皮细胞和叶肉细胞的变化导致水稻叶片卷曲。Guo 等[17]的研究表明,窄卷叶突变体Oschr4-5的角质层蜡质含量显著增加,导致失水率降低,增强了水稻植株的耐旱性。同样,表皮细胞的改变也影响水稻叶片形态。研究显示cld1突变体叶片卷曲的主要原因是表皮细胞受损降低了叶片的保水能力,导致叶片水分亏缺[18]。而水稻rld突变体叶片卷曲是由于维管束之间的下表皮叶肉细胞面积明显增大且泡状化所致[19]。
3 水稻卷叶形成的分子调控机制
纵观前人的研究发现,水稻卷叶性状一般由单基因控制,且多为单基因隐性遗传,少数为单基因显性遗传,还有不完全显性遗传,如ERL1[20]和SRL2[21],和不完全隐性遗传,如rl8[22]和rlt[23]。也有水稻卷叶性状由多基因控制,如李仕贵等[24]研究发现,籼粳交DH 群体中的卷叶性状由2 对基因控制,且这2 对基因存在互补作用。以上研究结果说明水稻卷叶性状的遗传机理十分复杂。目前,水稻12 条染色体上均有卷叶相关调控基因被报道,共76个(表1),包括在经典遗传图谱上已标定的6 个控制卷叶的隐性基因rl1-rl6[25]。其中有39 个已被克隆(表2)。根据其基因功能可以将已克隆的水稻卷叶相关基因划分为5 类。
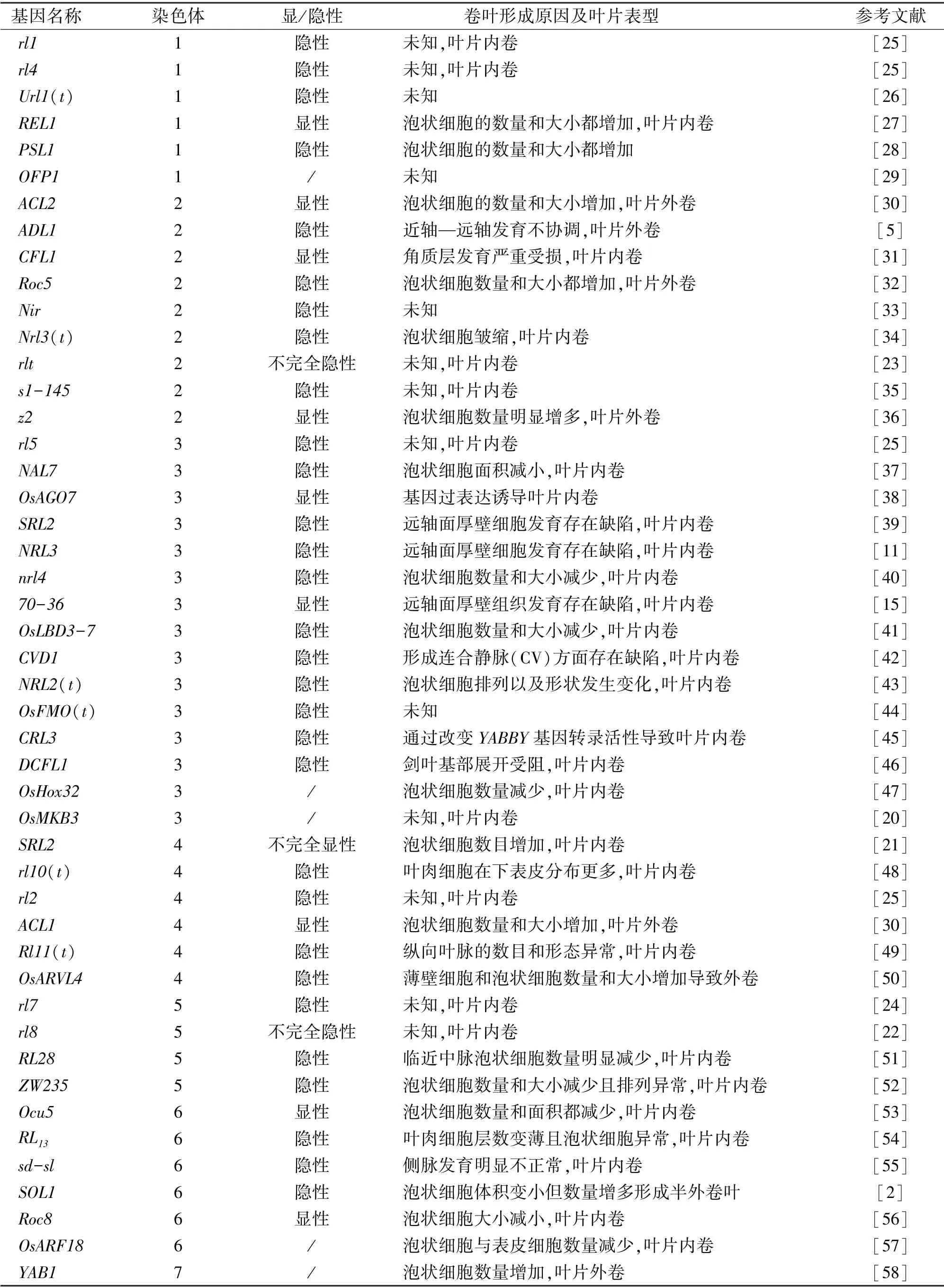
表1 已定位的水稻卷叶相关基因及卷叶形成原因Table 1 The mapped genes related to rice rolled leaf and causes of rolled leaf formation

续表1

表2 已克隆的卷叶相关基因及功能Table 2 The cloned genes related to rolled leaf and functions

续表2
3.1 叶片的极性(Adaxial/Abaxial)轴建立相关基因
水稻叶片极性轴(近轴—远轴)主要是通过控制叶片近轴极性的基因(HD-ZIP Ⅲ和ARP 家族基因)与控制叶片远轴极性的基因(KANADI和ARF家族基因)及叶面发育基因(YABBY 和WOX 家族基因)之间的协同促进和拮抗作用而建成的。目前有少量调控叶片极性的基因被报道,如ADL1基因编码一个半胱氨酸蛋白酶,突变体adl1叶片近轴面泡状细胞增大,导致叶片呈现出外卷,HD-ZIP Ⅲ基因在adl1突变体成熟叶片中的表达量增加,表明ADL1与叶片极性轴的建立有关[5]。OsYABBY6是一类水稻转录因子,主要参与对叶片近轴面发育的调控,转录抑制转基因株系CE-OsYABBY6的叶片呈现出内卷的表型[80]。
3.2 泡状细胞发育相关基因
在已定位的水稻卷叶相关基因中,绝大多数的基因都与泡状细胞的发育相关。如OsHox32、Roc5、Roc8、OsLBD3-7、ZW235、SRL1、SLL2、ACL1及其在水稻中的唯一同源物ACL2等一系列基因都是通过调节泡状细胞的数目和大小进而调控叶片的形态,使叶片表现出卷叶的表型。crm1-D突变体从苗期到开花期都表现出卷叶,组织学分析表明卷叶原因为泡状细胞的尺寸减小。crm1-D的突变表型由一个显性核基因控制,图位克隆结果显示HD-ZIP CLASS IV基因家族成员Roc8为候选基因。此外,在构建的Roc8敲除株系中,泡状细胞的大小显著增加,表明Roc8负调节泡状细胞的大小[56]。李战朋[52]研究表明,卷叶基因ZW235是一个核内转录因子,突变体zw235中泡状细胞数量变少、面积变小,导致叶片内卷。通过构建基因ZW235的互补载体和敲除载体证实了突变表型是由于基因功能的缺失所导致的。酵母单杂交实验结果显示,ZW235 蛋白与YAB1基因启动子区域结合元件相互结合而发挥作用。YABBY基因中YAB1与YAB3都参与调控水稻叶片中泡状细胞的发育进而导致卷叶的形成。
3.3 厚壁细胞发育相关基因
在已报道的水稻卷叶突变体中,半卷叶突变体srl2是从射线辐射的籼稻品种中籼3037 中分离得到的。图位克隆结果显示SRL2编码一种新的植物特异性蛋白质,最终实验结果表明SRL2在调节叶片发育特别是在厚壁细胞分化过程中起重要作用[39]。窄卷叶突变体nrl3的组织学分析表明,叶片远轴面的厚壁细胞发育存在缺陷[11];SLL1是控制水稻卷叶性状的关键基因,编码KANADI 家族的SHAQKYF类MYB 转录因子,SLL1的缺失会导致远轴面厚壁细胞的程序性死亡[12]。突变体erl1从苗期到成熟期都表现为极度内卷,叶片的石蜡切片结果表明维管束远轴面的厚壁细胞发生异常,从而使得叶片卷曲[20]。
3.4 角质层和表皮细胞发育相关基因
组织学研究表明,角质层与表皮发育缺陷是叶片卷曲的主要原因之一。CFL1编码WW 结构域蛋白,可通过影响HDG1的功能来负调节角质层的发育,在水稻中过表达CFL1导致了叶片内卷[31]。OsCHR4通过表观遗传调控生长素和蜡质生物合成基因的表达来调控叶片形态和角质层蜡质的形成,Oschr4-5突变体的角质层蜡质含量较高,导致失水率降低和耐旱性增强,从而诱导了卷叶的形成[17]。CLD1/SRL1编码一种糖磷酸肌醇(GPI)锚定膜蛋白参与调节水稻的卷叶和其他方面的生长发育。CLD1/SRL1功能的丧失导致叶表皮缺陷,如表皮细胞体积增大。叶表皮缺陷造成叶片保水能力降低,导致cld1突变体叶片缺水和叶片卷曲[18]。
3.5 miRNAs 和激素相关基因
miRNAs 在转录后水平负调控基因的表达可以诱导水稻卷叶的形成。OsmiR160负调控靶基因Os-ARF18的表达,且抗OsmiR160型OsARF18水稻转基因植株mOsARF18表现出卷叶表型[57]。使用短串联靶模拟(STTM)系统敲除microRNA166,鉴定出的miR166敲除系(STTM 166)也表现出卷叶表型,这是由于STTM166水稻植株的叶片泡状细胞较小和厚壁细胞异常[81]。AGO 蛋白是RNA 诱导的沉默复合体的主要组成蛋白,对水稻叶片的发育起关键作用,如过表达OsAGO7可诱导叶片内卷[38]。还有一些与植物激素相关的基因通过影响激素的生物合成间接诱导水稻卷叶的形成。NAL7参与生长素的生物合成,NAL7基因的nal7过表达突变体中卷叶表型是由于生长素过量导致的[37]。YABBY1(YAB1)参与水稻中赤霉素生物合成的反馈调节,内源和外源YAB1基因的表达都受到抑制的转基因水稻株系植株的叶片外卷成圆筒状[58]。
4 总结与展望
根据前人的研究发现,获得水稻卷叶突变体的方法主要有以下几种:(1)化学诱变。如内卷叶突变体cul1-1[61]和半不育卷叶突变体rlms1[82]都是经EMS 诱变而来。(2)物理诱变。如rld突变体[19]是平展叶籼稻品种经60Co-γ 射线辐射而得到的极度内卷叶突变体。(3)生物诱变。如水稻遭遇害虫侵害时会激发它的抗植食性防御反应从而诱导卷叶[83]。(4)农杆菌转化法。如水稻显性卷叶突变体AC270是通过农杆菌转化法得到的转基因植株[84]。(5)自然变异。如突变体nrl7是在田间粳稻品种C275 群体中发现的1 株具有窄卷叶表型的突变体,遗传分析发现其突变表型为单基因隐性遗传[85]。
在已报道的水稻卷叶突变体中,部分卷叶性状是由环境胁迫所致,不具有遗传性,而由基因控制且能稳定遗传的卷叶性状是当下研究的热点。截至目前,已成功克隆了39 个与卷叶性状相关的基因,但由于水稻的卷叶性状具有复杂的调控网络,导致这些基因在育种上的利用极少,并且至今发现的卷叶突变体都还存在许多如株高严重降低、分蘖数减少、结实率显著下降甚至不能结实等不利变异,若利用不当会给水稻生产造成巨大损失。所以,对不同水稻品种叶片的最适卷曲度进行研究至关重要,特别是在同一水稻品种中同一卷叶基因的不同表达量对叶片卷曲度调控的差异,不同基因对同一水稻品种叶片卷曲度调控的差异,还有多个基因对叶片卷曲度调控的叠加效应以及不同水稻品种间的同一卷叶基因对叶片最适卷曲度的调控是否存在差异都需要进一步探讨。

