土壤可溶性有机氮测定方法研究进展①
储 成,程 谊,曹亚澄,蔡祖聪,3,4,5,张金波,3,4,5*
土壤可溶性有机氮测定方法研究进展①
储 成1,程 谊1,曹亚澄2*,蔡祖聪1,3,4,5,张金波1,3,4,5*
(1 南京师范大学地理科学学院,南京 210023;2土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;3 江苏省地理环境演化国家重点实验室培育建设点,南京 210023;4 江苏省地理信息资源开发与利用协同创新中心,南京 210023;5 南京师范大学虚拟地理环境教育部重点实验室,南京 210023)
可溶性有机氮(DON)是土壤中生物可利用有机氮库的主要成分,是最为活跃的有机氮形态之一。DON在土壤中的迁移和转化是土壤氮素地球生物化学循环的重要一环,与氮素养分供应、损失等过程密切相关。然而缺失准确、可靠的土壤DON分析方法严重限制了DON的相关研究进程。本文综述了近年来国内外土壤浸提液和水体中DON测定方法,重点比较了不同可溶性总氮(DTN)测定方法以及不同前处理方法对提高DON测定结果准确性的影响。
可溶性有机氮;可溶性总氮;前处理方法;无机氮去除;差减法
土壤可溶性有机氮(dissolved organic nitrogen,DON)是指土壤中能溶于水或KCl、CaCl2、K2SO4等盐溶液的有机态氮[1],是土壤可溶性总氮(dissolved total nitrogen,DTN)的主要组成部分,是土壤有机氮矿化作用的直接底物,是土壤氮素中除无机态氮外最为活跃的氮素成分[2]。研究发现,土壤DON含量受土壤类型、植被覆盖、管理措施(施肥、留茬耕作)、气候条件(降雨、气温)影响[1,3],DON/DTN比例波动范围也较广。例如,林地土壤中DON含量为1 ~ 448 mg/kg,大部分不高于40 mg/kg,DON/DTN比例为16% ~ 67%[3-4];而农业土壤中DON含量为1 ~ 413 mg/kg,DON/DTN比例为4% ~ 90%[5-6]。土壤DON形态繁多,包含氨基酸、氨基糖、多肽、蛋白质、含氮酚类、氨基酸–腐殖酸复合物等[7-8],其中氨基酸、氨基糖、蛋白质是土壤中DON最重要的组成部分。农田土壤中氨基酸占DON的比例小于5%,氨基糖和杂环氮化合物的比例平均约为15%[1],氨基氮(肽和蛋白质)的比例为35% ~ 57%[1,7,9]。林地土壤中氨基酸的比例为1% ~ 25%[4],结合态氨基酸的比例为48% ~ 74%[10]。这些小分子氮化合物可以被微生物迅速吸收或转化,是生物可利用有机氮库的主要成分[2];而含氮酚类、氨基酸–腐殖酸复合物等DON转化缓慢,是土壤中比较稳定的DON组分[3,9]。另外,DON在土壤中的移动性也较强,可随土壤水分移动而发生径流或淋溶,会造成地下水污染富营养化或加速土壤N2O排放,是土壤氮素损失的重要途径之一[1-2]。因此,准确测定土壤DON含量,确定土壤DON源和汇,将有助于深入研究DON在土壤氮素地球生物化学循环、氮素养分供给以及氮素损失中的作用,有利于完善有关氮循环的理论。
采用盐溶液或水溶液能从土壤中提取出DON,但同时也提取出可溶性无机氮(dissolved inorganic nitrogen, DIN),由于土壤浸提液中DIN的存在,目前还没有一种准确、可靠的方法可以直接提取或测定土壤浸提液中DON含量[11],主要通过差减法,即用土壤浸提液中DTN含量减去DIN含量,计算出DON含量[1,12]。土壤浸提液中DIN包含NH4+-N、NO– 3-N和NO– 2-N,以前两者为主。NH4+-N含量主要采用靛酚蓝比色法或离子色谱法测定[13],NO– 3-N含量主要采用镉柱还原比色法、硫酸肼还原比色法或离子色谱法测定[13-14],NO– 2-N含量主要采用N-1-萘基乙二胺比色法或离子色谱法测定[14]。上述无机氮测定方法分析误差低,完全满足DON测定的要求,然而差减法计算DON含量会累积多次测定误差,影响结果的准确性[11]。已有的研究表明,可以在两方面进行改进来提高DON分析的准确性:一是提高DTN测定结果的准确性,这一点是准确测定DON含量的关键[15-17]。二是对样品进行前处理降低浸提液中DIN比例以减少该组分的干扰。差减法累积的DIN和DTN的测定误差使得DON的计算结果准确度降低、变异度较大;特别是DIN含量较高的样品,DON计算结果常出现负值[18-19]。土壤浸提液和水体存在相似性,大量水体中的DON的测定方法的研究表明,通过前处理方法降低水体中的DIN/DTN比例,可有效降低差减法计算带来的测定误差[11,20],因此水体DON的测定方法研究具有较高的参考价值。目前用于降低溶液中DIN/DTN比例的前处理方法主要有:过滤、吸附、催化及预浓缩[11]。这些前处理方法各有优缺点,DIN去除率和DON回收率也有较大差别,需要进一步综合评估适用性。综上所述,准确测定DON含量要在“提高DTN测定准确性”和“减少差减计算误差”两个方面进行改进。
本文综述了近年来国内外土壤浸提液和水体中DTN的测定方法,比较了不同DTN测定方法优缺点及适用范围;评估了不同前处理技术对DIN去除率和DON测定准确性的影响。基于上述研究,本文筛选出目前最优的DTN测定方法和前处理技术,可为建立准确、可靠的土壤DON测定方法提供依据。
1 土壤浸提液或水体中DTN测定方法比较
土壤浸提液或水体中DTN含量都是通过化学法或燃烧法将样品中所有形态的氮化合物消化成测定形态来测定。不同方法对不易消化的氮化合物组分的消化能力决定了DTN测定回收率。常用的DTN消化方法见表1。
1.1 凯氏法(total Kjeldahl nitrogen, TKN)
TKN法使用硫酸和催化剂将溶液中的含氮化合物全部还原为NH4+-N,再通过蒸馏滴定或靛酚蓝比色法定量氮含量。TKN法有以下几点缺陷:①TKN检测限较高,为N 0.05~ 0.2 mg/L,消化试剂带入氮导致较高的空白,因此不适合低DTN和DON浓度较低的样品[29];②TKN法只能消化蛋白质、氨基酸、肽、胨、核酸、尿素等氮为负三价形态的有机氮化合物,不能完全氧化叠氮、连氮、偶氮、腙、硝基、亚硝基、腈、肟、半卡巴腙类的含氮化合物[13],易造成结果被低估;③TKN法的测定易受NO– 2-N和NO– 3-N浓度的干扰[13,30],有研究者用TKN法测定高NO– 3-N样品,发现高达90% 的DTN被低估[31];④稀释操作也会加大测量误差[17]。因此,TKN法现已逐渐被其他新技术所取代。
1.2 紫外氧化法(ultraviolet, UV)及过硫酸钾氧化法(persulfate oxidation, PO)
UV和PO法将所有形态氮都催化氧化成NO– 3-N,再用镉柱还原比色法或离子色谱法定量[22]。UV法测定氮回收率不理想(平均71%±21%)、结果重现性也不佳[25]。改进后的PO法采用过硫酸钾作为强氧化剂,在高温高压或紫外催化条件下可将消化效率提高至平均93%±13%[32]。PO法后被广泛应用于新鲜水样和土壤溶液[33-34]。优化试剂的比例还可以提高DTN的回收率,更利于提高DON的回收率[35]。PO法的问题在于:①不同的DON氧化效率差异很大,例如EDTA的回收率为87% ~ 99%[25,36],而安替比林的回收率只有45% ~ 68%[25,36];②过硫酸钾中的杂质氮导致测定时空白值含氮量较高,需要将过硫酸钾结晶提纯[25];③碱性溶液中DTN含量结果易被低估,例如在碱性条件下NH4+-N可能以NH3形态损失[37]。总体而言,相比于TKN法和UV法,PO法具有检测限低、分析结果准确性高、实验条件简单易行的优点,已在连续流动分析仪上实现自动化批量操作。
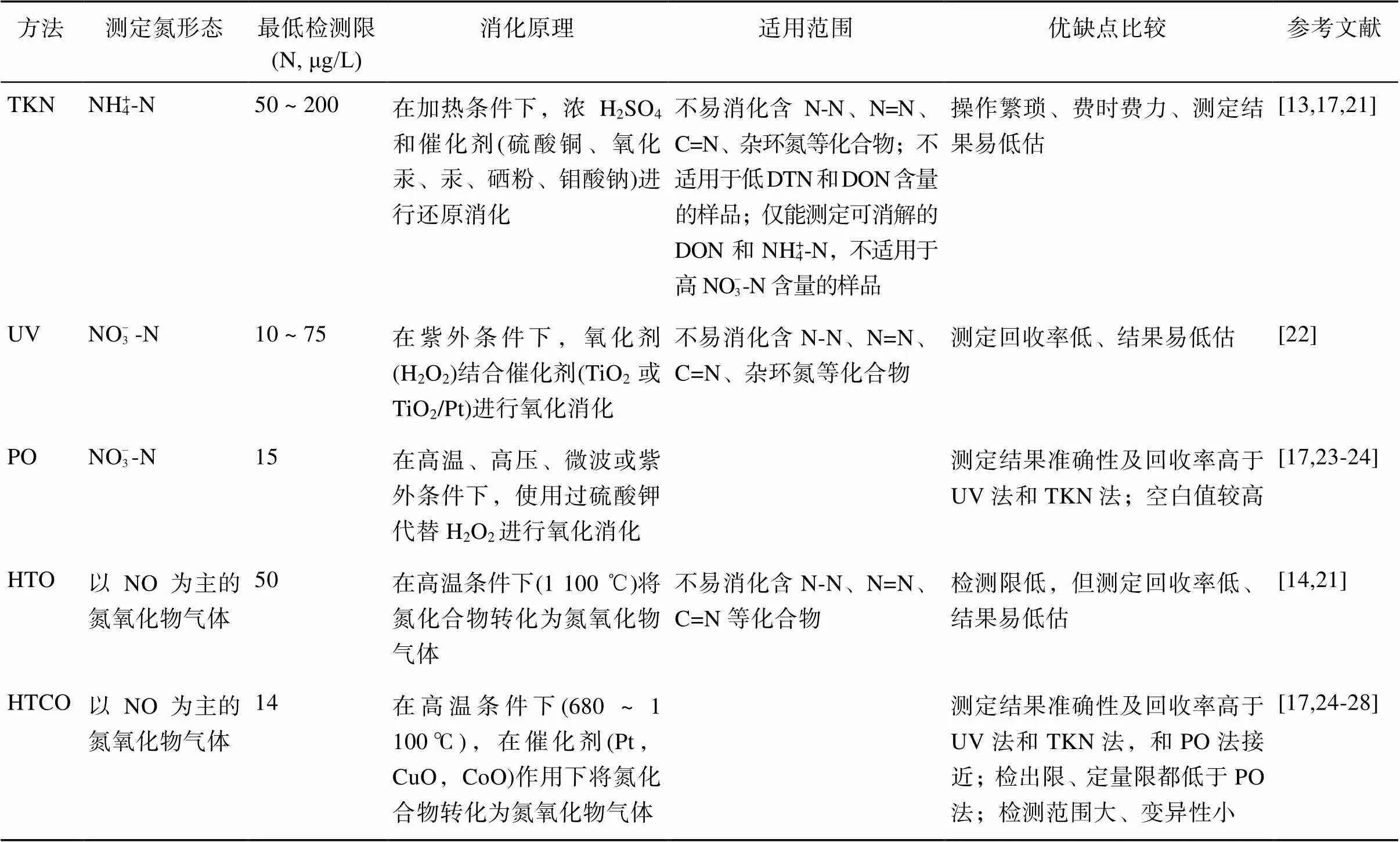
表1 土壤浸提液或水体中DTN不同测定方法的比较
1.3 高温氧化法(high-temperature oxidation, HTO)及高温催化氧化法(high-temperature catalytic oxidation, HTCO)
HTO法和HTCO法是将样品直接注入氧化柱中,使所有形态氮化合物在高温条件下转化为氮氧化物气体NO,NO再与O3反应生成激发态NO* 2-N后用于定量[27]。反应过程使用催化剂的称为HTCO法。众多研究表明,HTCO法能获得准确性和重现性均更高的结果,例如Pathak等[17]用HTCO法测定标准DON物质的标准偏差仅为±1%,测定废水样品DON含量的标准偏差为±5%,回收率高于99%;而且HTCO法在抗稀释干扰方面更强;HTCO法还表现出良好的精度(1.5%),可用于多种天然水体样品的DTN的测定[26]。此外,Chen等[27]还发现水、K2SO4、KCl等不同提取溶剂对HTCO法测定土壤DTN准确性的影响十分微小,但更高的催化温度可能造成盐分的升华,损坏仪器且影响测定结果[26];有研究表明680 ℃作为氧化温度能获得最为准确的结果[23]。综合看来,HTCO法转化样品的步骤少,需样量少,操作更容易、方便,具有作为常规测定方法的潜力[24,38]。
2 不同前处理方法对土壤浸提液或水体中DIN去除率及DON测定准确性的影响
差减法计算会累积DIN和DTN的测量误差[11,38],尤其是DIN/DTN比例较高的样品,DON测量误差的数值甚至会超过DON的浓度[18,39];例如,Lee 和Westerhoff[40]测定DIN/DTN比例高于90% 的地表水中DON浓度,测量误差(N 0.19 mg/L)高于DON浓度本身(N 0.15 mg/L)。研究一致认为高比例的DIN/ DTN对DON测定结果的准确性有明显的影响[12,30],DIN/DTN比例从50% 上升至91%,相对标准偏差可从2.5% 上升至47%[41]。还有许多研究测定土壤浸提液或水体中DON浓度时,都出现了一定比例的负值或远低于真实浓度的结果[18-19, 39-40,42]。较多研究认为能准确测定DON的DIN/DTN比例临界值为0.6[15, 40,43],也有研究认为是0.85[42]或0.5[41]。可靠的前处理方法应是在降低样品DIN/DTN比例的同时,仍能保证较高的DON回收率[11,20,40],并且DTN分析方法的相对标准偏差要低于一定比例[16]。目前,降低DIN/DTN比值的前处理方法主要有4类:膜分离法、吸附法、催化还原法和预浓缩法,这些方法的DIN去除率、DON回收率、使用范围等不尽相同。本文综合比较了不同前处理方法对土壤DIN去除率及DON测定准确度的影响(表2)。
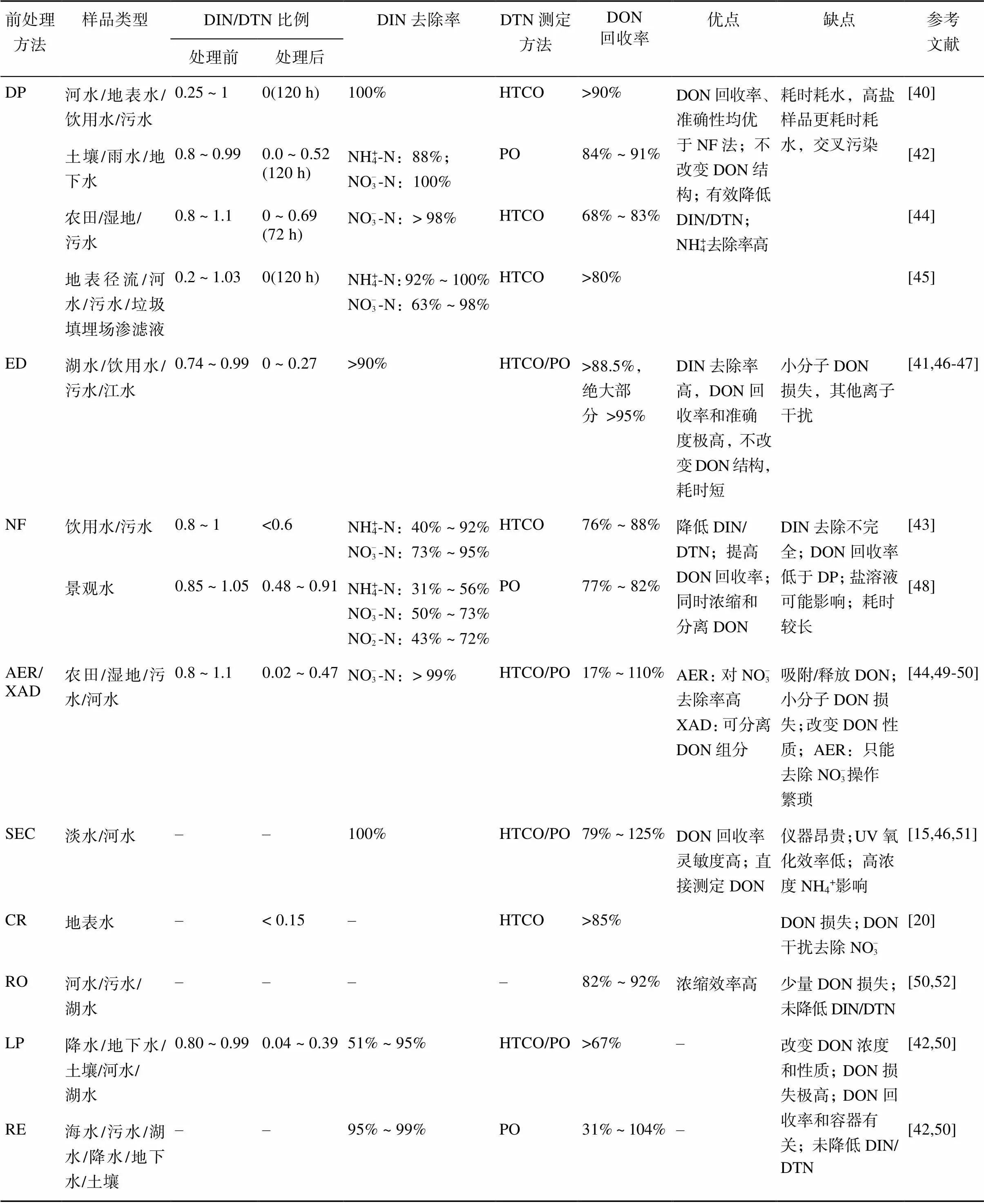
表2 不同前处理方法和DTN测定方法对溶液中DIN去除率和DON回收率的影响
2.1 膜分离法
2.1.1 渗析法(dialysis process, DP) DP法基本原理是溶质分子在浓度梯度推动下透过半透膜,穿过膜的分子大小由与膜孔径相关的分子截留量决定;DP法在降低DIN含量的同时也能浓缩DON。现研究认为分子截留量100 Da的渗析膜可以用作去除DIN的研究,而DON分子量几乎都超过100 Da,即使是游离态氨基酸分子量也接近100 Da,加之90% 以上的氨基酸都是以结合态形式存在,无法透过渗析膜[12]。Lee 和Westerhoff[40]用分子截留量为100 Da的渗透膜处理DIN/DTN比例超过0.6的地表水和饮用水,DIN去除率达70%,氨基酸、多肽和可溶性有机质(dissolved organic matter, DOM)分离提取物的平均回收率在95% 以上;即使使用分子截留量较高的100 ~ 500 Da的渗析膜前处理时DOM的回收率也没有显著影响DON回收率[45]。Feuerstein等[53]用同位素方法证明了DP法几乎没有改变溶液中的元素组成。
虽然DP法去除DIN效果显著,但DP法存在如下缺陷:①渗析过程耗时较长,通常是24 ~ 120 h[39-40],且需消耗大量分散介质——淡水,同一批次的样品易交叉污染,处理高含盐量的样品消耗更多的时间(216 h)和淡水[42]。②个别实测样品DON回收率不理想,低分子量DON组分会渗透过渗析膜[44],较高分子量组分可能被渗析膜吸附和阻滞[42]。Lee和Westerhoff[40]也发现,即使DON损失量较大,去除DIN也能达到提高DON回收率和测定准确度的效果。③中性环境pH(6 ~ 8)条件下存在的NH4+-N易被带负电荷的渗析膜吸引受到阻滞,调节pH提高NH4+-N的去除率的效果评价不一致[42,45]。
2.1.2 电渗析法(electrodialysis, ED) ED法是指在外加直流电场作用下,溶液中阴、阳离子作定向迁移,分别选择性透过阴离子交换膜和阳离子交换膜,溶液中DON得到分离的过程。DIN是带电离子且分子量低于100 Da,DON不带电荷或只带微弱电荷[54]且分子量通常高于500 Da,因此ED法采用膜孔径约100 ~ 200 Da[55]的离子交换膜作为分离介质,可有效降低土壤浸提液或水体中DIN含量,且堵塞引起的DON损失相对较少。例如,Zhu等[41]在电压30V、交换液浓度0.5 mol/L、流速360 ml/h条件下,ED法处理水体溶液180 min后的DIN去除率高达99%;其他研究结果也发现短时间的ED法处理可得到100% 的DIN去除率[46-47,56]。此外,ED法测定DON的准确度及回收率显著提高。ED法处理绝大部分DON标准物质的回收率均高于95%,即使是游离氨基酸回收率也能达到80% 左右,平均为88.5%[41];宋海青等[47]用ED法处理长江水样发现15 min后的DIN/DTN比例从0.87降至0.3左右,DON测定含量从0.15 mg/L上升直至稳定在0.36 mg/L,可溶性有机碳(dissolved organic carbon, DOC)损失率低于4%,相对标准偏差从18.65% 下降为3.25%,这个发现与Chon等[46]的结果一致。还有研究发现采用ED法处理DIN/DTN=0.81的湖水、DIN/DTN=0.84的饮用水,即使没有显著改变DON的浓度,也大大减小了DON测量的相对标准偏差[41]。由此可见,ED法在温和条件下几乎可完全去除DIN,可获得极高的DON回收率和准确度,且不会改变DON(如色氨酸、腐殖质等)分子结构[41]。因此,ED法为“直接测定DON含量”提供了可能性,其检测限(method detection limit, MDL)为N 0.15 mg/L[41]。
近年来很多研究评价了ED法去除DIN的影响因素:①pH会影响溶液中DIN的去除率,一般认为NH4+-N去除效果最理想的pH为7 ~ 10[56],pH过低易形成浓差极化,pH过高会出现胶体污染,均不利于DIN去除;另外,pH也能决定氨基酸等DON组分的电离状态,从而影响DON测定回收率,调节pH至等电点能有效降低DON组分的电离,降低DON损失率[47]。pH上升还会改变离子交换膜和DOM性质,导致膜吸附更多的DON[55]。②亲水性的低分子量DOM易穿过膜、疏水性的大分子量DOM易被膜吸附都会导致DOC损失[54-55],损失的DOM组分主要是低分子量的酸性、中性组分以及大分子量的腐殖质[46];部分游离氨基酸或肽(谷氨酸、谷胱甘肽)分子较小也容易透过离子交换膜,而且电离后带电荷,保留率约80%[41];非极性分子尿素受电场的作用很小,回收率高于97%[41]。③土壤浸提液中大量存在的Cl-、SO2– 4、K+、Ca2+、Mg2+等离子会和DIN竞争交换位点,也会影响DIN去除率[46,55]。
2.1.3 纳滤法(nanofiltration, NF) NF法也是根据分子大小差异截留纳米级别(约150 ~ 200 Da)的物质,单价DIN离子可通过而多价阴离子和有机小分子(200 ~ 2 000 Da)被截留[57]。Xu等[43]研究结果表明污水处理厂的出水中硝酸盐的去除率达到90% 以上,DIN/DTN比例从0.95降低至0.6以下,原本差减法计算得到的DON负值结果经过NF法处理后全部成为正值。于红蕾等[48]使用同种纳滤膜研究景观水中DON的精确性,结果表明利用NF270处理后DON标准偏差从44.2% 下降至4.1%。NF法的优势在于:分离效果好、操作压力低、膜通量大、经济省时、浓缩用水量少。
和ED法类似,NF法处理后溶液DIN去除率和DON测定准确度也受多种因素影响:①溶液pH会影响纳滤膜表面的电荷,通过Donnan效应(即滤膜排斥带有相同电荷的离子而吸引带有相反电荷的离子)进一步影响溶液DIN去除率,例如pH在等电点附近时,占主导的筛分效应使得NO– 3-N和NH4+-N去除率达到最高[43,58];NF法处理前调节溶液pH使氨基酸带不同电荷,可将一些氨基酸的截留率提至100%[59]。因此应用NF法要关注纳滤的两种机理——筛分效应和Donnan效应[60]。②溶液的盐浓度会影响DON回收率,高浓度盐会降低谷氨酸[59]的截留率,但Grib等[60]发现盐浓度几乎不影响氧化铝γ纳滤膜对L-丙氨酸和苯丙氨酸的截留,盐溶液对NO– 3截留率的影响也在不同的纳滤膜之间出现不一致的结果[61],看来不同纳滤膜对影响因素的响应也有所区别。③纳米级的分子截留量使得有机物、无机物、胶体颗粒物及生物污染都会影响DON的回收率,因此膜污染问题更为复杂[62]。目前NF法用于测定土壤浸提液中DON的研究还较少,在测定土壤浸提液DON的潜力还有待开发。
2.2 阴离子交换树脂法(anion-exchange resin, AER)
阴离子交换树脂表面的活性基团解离出交换离子后,优先吸附结合溶液中的某些离子,使得活性基团解离的离子与溶液中的阴离子互相交换,AER法操作简单高效、选择性强、回收成本较低,是一种较为经典的前处理方法。土壤NH4+-N在硝化作用下会迅速氧化成NO– 3-N,因此NO– 3-N通常是土壤中DIN的主要成分[63]。硝酸盐选择性树脂可特异性地去除溶液中的硝酸盐[49]并完全回收DON(96.9% ~ 105.8%)[64];Sattayatewa等[49]发现AER法几乎可完全去除DIN/DTN比值接近1的标准溶液中的NO– 3-N,将DON结果提高12%,且DON回收率介于92% ~ 110%。然而Graeber等[44]发现AER处理湿地样品后仅获得17% 的DON回收率,AER法可能不适用于分析自然水样中DON。Pehlivanoglu-Mantas和Sedlak[30]总结早期研究结果也发现在pH 7 ~ 9.9的条件下AER法可吸附12% ~ 32% 的DON。以上截然相反的DON回收率结果是由AER吸附或释放DON的不确定性造成的[11],AER应用的可行性仍需要更多实际样品的研究数据作为支持。另外,AER法吸附的是阴离子,NO– 3-N,NH4+-N和NO– 2-N含量较高的土壤浸提液或水体样本不适用[44]。
还有研究采用吸附–洗脱效率较高的大孔吸附树脂(XAD)来分离溶液中的DON组分,特别是疏水性组分,但是回收率均不理想[54,65]。例如,Leenheer等[65]采用XAD树脂分离自然水体和污水样品中的DON,DON回收率分别为214% 和31%,而处理海藻和细菌的培养液的DON时回收率均低于30%。XAD法联用离子交换树脂可提高有机物分离效果[66],XAD法联用反渗透浓缩技术(reverse osmosis, RO)能有效降低DON的损失率[50]。总的来说,XAD法是根据化合物极性来分离有机组分,可将其应用在DON组分的结构和性质研究,但在测定DON浓度方面不具有明显优势。
2.3 尺寸排阻色谱法(size-exclusion chromatograph, SEC)
SEC法按照分子凝胶孔径大小和分子极性分离出小分子DIN,在SEC分析系统的阳离子交换色谱柱中,快速流出的是亲水性的大分子物质(≥10 kDa),随后流出的是腐殖酸或富里酸类,接着是低分子量的有机酸类,这几类氮化合物组分流出后经UV法转化成NO– 3-N后测定计为DON含量[15];NH4+-N和NO– 3-N则是最后流出。SEC系统与有机氮检测器联用可直接测定溶液中的DON含量[51],方法检测限为N 0.05 mg/L[15]。Graeber等[15]比较了SEC法和差减法测定水体中DON含量的准确性,发现差减法在测定DIN/DTN>0.6的样本时出现了较大误差,而SEC法成功分离出DON,因此误差较低,DON回收率达到89% ~ 103%。SEC取代用实验操作描述不同组分的传统方法,在测量灵敏度、准确度、重现性方面具有优势。然而,SEC法所需仪器昂贵、操作耗时,需要大量标准物质校正要测量的分子大小才能全面分析实际样品中巨大的有机物库[30],NH4+浓度较高时还需要预先用阳离子交换柱去除NH4+以防其影响DON低分子量酸性和中性组分的测定[46],部分DON还会保留在SEC柱中[51],因此SEC技术作为常规分析方法仍有很大的局限性;此外,SEC系统采用UV法氧化氮化合物测定氮含量,也存在UV法测定DTN含量的劣势。SEC法是否适用于高NO– 3-N比例、高盐含量的土壤浸提液样品测定也需进一步研究。
2.4 催化还原法(catalytic reduction, CR)
CR法可将溶液中的NO– 3-N催化还原成N2排出,从而降低溶液中DIN/DTN比例;常用的催化剂为双金属钯基/铂基[20]。Pd-In/Al2O3、Pd-Sn/Al2O3和Pd/ SnO2作为催化剂几乎可完全去除NO– 3-N,17种氨基酸的损失率为0 ~ 15%[20];半胱氨酸、甲硫氨酸和组氨酸的C-S键和C=C双键被氢化,回收率显著降低。在DON较高的样品中,DON会吸附在催化剂上和硝酸根竞争活性催化位,影响NO– 3-N的去除,NO– 3-N也更容易还原成NH4+-N而不是N2[20]。研究表明CR法处理的DIN去除率及DON回收率易受溶液中DON组分、DON含量等因素的影响。
2.5 其他方法
在测定DON含量较低的浸提液或水体样品时,还可采用冻干法(lyophilization, LP)、旋转蒸发法(rotary evaporation, RE)和反渗透膜法(RO)浓缩DON从而减小测定误差。由于浓缩过程并未明显降低DIN/DTN比值,因此这些技术一般结合其他前处理技术对样品进行前处理。浓缩过程会改变DON的性质、含量和完整性[42,50],进而影响DON的回收率。相比于LP法和RE法,RO法浓缩后DON损失率相对较小。RO法分离速度快、无需化学试剂,水样软化后可以较好地保留DON性质[67],在DON浓度低于检测限、低硬度水体中可作为浓缩分离DON的方法使用。实际应用中根据各前处理技术的优缺点联用可有效提升前处理效果。例如联用分离特性好的ED法和浓缩特性高的RO法,可以有效去除干扰离子,提高河水中DOM分离效率[52];阳离子交换柱法结合ED法提高DIN去除率后,SEC法可更好地表征DON组分[46]。
3 结论
目前,采用DTN含量减去DIN含量的差减法是测定DON的主流方法,“提高DTN测定准确性”和“减少差减计算误差”是提升DON结果准确性的两条途径。本文综述了土壤浸提液和水体DTN测定方法的基本原理、优缺点和适用范围,以及DIN去除前处理技术的去除效果、DON回收率及优缺点。
1)采用精确度更高的方法分析DTN可提高DON结果准确性。HTCO法和PO法在检测限、精密度、准确度及氧化效率、空白值控制等方面具有较大优势,且两种方法间无明显差异。
2)采用前处理方法去除DIN从而降低DIN/DTN比值可有效提高DON回收率及准确度,降低测定变异度。DP法和ED法具有更高的DIN去除率及更优的DON回收率,其中ED法因耗时短、回收率更接近100% 而具有更大的优势;NF法的DON回收率略低于DP法和ED法,但同时具备浓缩和分离特性,因此更适用于μg/L级(以N计)DON样品的测定。
3)结合各种技术特性优势,联用多种前处理方法可有效提高前处理效果,可能是未来发展方向之一。
[1] Murphy D V, MacDonald A J, Stockdale E A, et al. Soluble organic nitrogen in agricultural soils[J]. Biology and Fertility of Soils, 2000, 30(5/6): 374–387.
[2] van Kessel C, Clough T, van Groenigen J W. Dissolved organic nitrogen: An overlooked pathway of nitrogen loss from agricultural systems?[J]. Journal of Environmental Quality, 2009, 38(2): 393–401.
[3] Chen C R, Xu Z H. Analysis and behavior of soluble organic nitrogen in forest soils[J]. Journal of Soils and Sediments, 2008, 8(6): 363–378.
[4] Kranabetter J M, Dawson C R, Dunn D E. Indices of dissolved organic nitrogen, ammonium and nitrate across productivity gradients of boreal forests[J]. Soil Biology and Biochemistry, 2007, 39(12): 3147–3158.
[5] 孔祥忠, 于红梅. 农业生态系统土壤可溶性有机氮研究综述[J]. 科技通报, 2016, 32(6): 213–218.
[6] 周晓光, 黄丹枫, 葛体达, 等. 有机和常规蔬菜生产系统土壤可溶性有机氮含量及特征[J]. 上海交通大学学报(农业科学版), 2010, 28(5): 420–425,438.
[7] Paul J P, Williams B L. Contribution of α-amino N to extractable organic nitrogen (DON) in three soil types from the Scottish uplands[J]. Soil Biology and Biochemistry, 2005, 37(4): 801–803.
[8] Sipler R E, Bronk D A. Dynamics of dissolved organic nitrogen[M]//Biogeochemistry of Marine Dissolved Organic Matter. Amsterdam: Elsevier, 2015: 127–232.
[9] Jones D L, Shannon D, V Murphy D, et al. Role of dissolved organic nitrogen (DON) in soil N cycling in grassland soils[J]. Soil Biology and Biochemistry, 2004, 36(5): 749– 756.
[10] Yu Z, Zhang Q, Kraus T E C, et al. Contribution of amino compounds to dissolved organic nitrogen in forest soils[J]. Biogeochemistry, 2002, 61(2): 173–198.
[11] Chen B Y, Westerhoff P, Zhang L, et al. Application of pretreatment methods for reliable dissolved organic nitrogen analysis in water—A review[J]. Critical Reviews in Environmental Science and Technology, 2015, 45(3): 249–276.
[12] Westerhoff P, Mash H. Dissolved organic nitrogen in drinking water supplies: a review.[J]. Journal of Water Supply Research and Technology-Aqua, 2002, 51(8): 415– 448.
[13] Apha A. Standard methods for the examination of water and wastewater[M]. Washington. DC: American Public Health Association. Inc., 1998.
[14] Walsh T W. Total dissolved nitrogen in seawater: A new- high-temperature combustion method and a comparison with photo-oxidation[J]. Marine Chemistry, 1989, 26(4): 295–311.
[15] Graeber D, Gelbrecht J, Kronvang B, et al. Technical Note: Comparison between a direct and the standard, indirect method for dissolved organic nitrogen determination in freshwater environments with high dissolved inorganic nitrogen concentrations[J]. Biogeosciences, 2012, 9(11): 4873–4884.
[16] Saunders J F, Yu Y, McCutchan J H, et al. Characterizing limits of precision for dissolved organic nitrogen calculations[J]. Environmental Science & Technology Letters, 2017, 4(11): 452–456.
[17] Pathak B, Al-Omari A, Wadhawan T, et al. Analytical errors in the measurement of dissolved organic nitrogen in wastewater effluent[J]. Proceedings of the Water Environment Federation, 2015, 2015(10): 4214–4225.
[18] Solinger S, Kalbitz K, Matzner E. Controls on the dynamics of dissolved organic carbon and nitrogen in a Central European deciduous forest[J]. Biogeochemistry, 2001, 55(3): 327–349.
[19] Siemens J, Kaupenjohann M. Contribution of dissolved organic nitrogen to N leaching from four German agricultural soils[J]. Journal of Plant Nutrition and Soil Science, 2002, 165(6): 675–681.
[20] Ambonguilat S, Gallard H, Garron A, et al. Evaluation of the catalytic reduction of nitrate for the determination of dissolved organic nitrogen in natural waters[J]. Water Research, 2006, 40(4): 675–682.
[21] Jones B M, Daughton C G. Chemiluminescence vs. Kjeldahl determination of nitrogen in oil shale retort waters and organonitrogen compounds[J]. Analytical Chemistry, 1985, 57(12): 2320–2325.
[22] Lowry J H, Mancy K H. A rapid automated system for the analysis of dissolved total organic nitrogen in aqueous solutions[J]. Water Research, 1978, 12(7): 471–475.
[23] Sharp J H, Beauregard A Y, Burdige D, et al. A direct instrument comparison for measurement of total dissolved nitrogen in seawater[J]. Marine Chemistry, 2004, 84(3/4): 181–193.
[24] Rogora M, Minella M, Orr A, et al. A comparison between high-temperature catalytic oxidation and persulphate oxidation for the determination of total nitrogen in freshwater[J]. International Journal of Environmental Analytical Chemistry, 2006, 86(14): 1065–1078.
[25] Bronk D A, Lomas M W, Glibert P M, et al. Total dissolved nitrogen analysis: Comparisons between the persulfate, UV and high temperature oxidation methods[J]. Marine Chemistry, 2000, 69(1/2): 163–178.
[26] Badr E S A. Environmental assessment of biogeochemical cycling of dissolved organic carbon (DOC) and nitrogen (DON) in natural waters[EB/OL]. 2005
[27] Chen C R, Xu Z H, Keay P, et al. Total soluble nitrogen in forest soils as determined by persulfate oxidation and by high temperature catalytic oxidation[J]. Soil Research, 2005, 43(4): 515.
[28] Minella M, Tartari G A, Rogora M, et al. Influence of nitrogen speciation on the TDN measurement in fresh waters by high temperature catalytic oxidation and persulfate digestion[J]. International Journal of Environmental Analytical Chemistry, 2016, 96(5): 474–489.
[29] Smart M M, Reid F A, Jones J R. A comparison of a persulfate digestion and the Kjeldahl procedure for determination of total nitrogen in freshwater samples[J]. Water Research, 1981, 15(7):919-921.
[30] Pehlivanoglu-Mantas E, Sedlak D L. Wastewater-derived dissolved organic nitrogen: Analytical methods, characterization, and effects—A review[J]. Critical Reviews in Environmental Science and Technology, 2006, 36(3): 261–285.
[31] Schlueter A. Nitrate interference in total Kjeldahl nitrogen determinations and its removal by anion exchange resins[R]. Cincinnati, USA: Environmental Protection Agency, 1977.
[32] Jones M N. Nitrate reduction by shaking with cadmium: Alternative to cadmium columns[J]. Water Research, 1984, 18(5): 643–646.
[33] Doyle A, Weintraub M N, Schimel J P. Persulfate digestion and simultaneous colorimetric analysis of carbon and nitrogen in soil extracts[J]. Soil Science Society of America Journal, 2004, 68(2): 669.
[34] 田路路, 隽英华, 刘艳, 等. 冻融作用对农田土壤可溶性氮组分的影响[J]. 土壤, 2017, 49(3): 512–518.
[35] 党琦, 于涌杰, 程谊, 等. 过硫酸钾氧化法测定溶解性有机氮含量和15N丰度方法研究[J]. 土壤, 2013, 45(6): 999–1002.
[36] Nydahl F. On the peroxodisulphate oxidation of total nitrogen in waters to nitrate[J]. Water Research, 1978, 12(12): 1123–1130.
[37] Ross D J. Influence of sieve mesh size on estimates of microbial carbon and nitrogen by fumigation-extraction procedures in soils under pasture[J]. Soil Biology and Biochemistry, 1992, 24(4): 343–350.
[38] Sharp J H, Rinker K R, Savidge K B, et al. A preliminary methods comparison for measurement of dissolved organic nitrogen in seawater[J]. Marine Chemistry, 2002, 78(4): 171–184.
[39] Chen B Y, Kim Y, Westerhoff P. Occurrence and treatment of wastewater-derived organic nitrogen[J]. Water Research, 2011, 45(15): 4641–4650.
[40] Lee W, Westerhoff P. Dissolved organic nitrogen measurement using dialysis pretreatment[J]. Environmental Science & Technology, 2005, 39(3): 879–884.
[41] Zhu A B, Chen B Y, Zhang L, et al. Improved analysis of dissolved organic nitrogen in water via electrodialysis pretreatment[J]. Analytical Chemistry, 2015, 87(4): 2353– 2359.
[42] Vandenbruwane J, Neve S D, Qualls R G, et al. Optimization of dissolved organic nitrogen (DON) measurements in aqueous samples with high inorganic nitrogen concentrations[J]. Science of the Total Environment, 2007, 386(1/2/3): 103–113.
[43] Xu B, Li D P, Li W, et al. Measurements of dissolved organic nitrogen (DON) in water samples with nanofiltration pretreatment[J]. Water Research, 2010, 44(18): 5376–5384.
[44] Graeber D, Gücker B, Zwirnmann E, et al. Dialysis is superior to anion exchange for removal of dissolved inorganic nitrogen from freshwater samples prior to dissolved organic nitrogen determination[J]. Environmental Chemistry, 2012, 9(6): 529.
[45] Wang Q, Hua B, Yang J, et al. Dialysis pretreatment for dissolved organic nitrogen analysis in freshwaters[J]. Journal of Chemistry, 2015: 1–7.
[46] Chon K, Lee Y, Traber J, et al. Quantification and characterization of dissolved organic nitrogen in wastewater effluents by electrodialysis treatment followed by size-exclusion chromatography with nitrogen detection[J]. Water Research, 2013, 47(14): 5381–5391.
[47] 宋海青, 陈卫, 陶辉. 电渗析预处理测定水中溶解性有机氮浓度的研究[J]. 环境科技, 2014, 27(6): 9–13.
[48] 于红蕾, 霍守亮, 杨周生, 等. 纳滤预处理测定景观水体中溶解性有机氮质量浓度及其分布特征[J]. 环境科学, 2013, 34(6): 2256–2262.
[49] Sattayatewa C, Arnaldos M, Pagilla K. Measurement of organic nitrogen and phosphorus fractions at very low concentrations in wastewater effluents[J]. Water Environment Research, 2011, 83(8): 675–683.
[50] Chang H, Wang G. Fractionation of nitrogen-enriched dissolved organic matter in water[J]. Separation and Purification Technology, 2013, 117: 89–97.
[51] Huber S A, Balz A, Abert M, et al. Characterisation of aquatic humic and non-humic matter with size-exclusion chromatography - organic carbon detection - organic nitrogen detection (LC-OCD-OND)[J]. Water Research, 2011, 45(2): 879–885.
[52] Koprivnjak J F, Perdue E M, Pfromm P H. Coupling reverse osmosis with electrodialysis to isolate natural organic matter from fresh waters[J]. Water Research, 2006, 40(18): 3385–3392.
[53] Feuerstein T P, Ostrom P H, Ostrom N E. Isotopic biogeochemistry of dissolved organic nitrogen: A new technique and application[J]. Organic Geochemistry, 1997, 27(7/8): 363–370.
[54] Perdue E M, Ritchie J D. Dissolved organic matter in freshwaters[M]//Treatise on Geochemistry. Amsterdam: Elsevier, 2003: 273–318.
[55] Kim D H, Moon S H, Cho J. Investigation of the adsorption and transport of natural organic matter (NOM) in ion-exchange membranes[J]. Desalination, 2003, 151(1): 11–20.
[56] 张宇, 孙宇明, 马文静, 等. 电渗析法处理氨氮废水研究进展[J]. 精细与专用化学品, 2017, 25(7): 24–26.
[57] 李祥, 张忠国, 任晓晶, 等. 纳滤膜材料研究进展[J]. 化工进展, 2014, 33(5): 1210–1218,1229.
[58] Paugam L, Taha S, Dorange G, et al. Mechanism of nitrate ions transfer in nanofiltration depending on pressure, pH, concentration and medium composition[J]. Journal of Membrane Science, 2004, 231(1/2): 37–46.
[59] 杭晓风, 陈向荣, 马光辉, 等. 纳滤技术分离谷氨酸和盐混合液的研究[J]. 膜科学与技术, 2008, 28(2): 63–68.
[60] Grib H, Persin M, Gavach C, et al. Amino acid retention with alumina γ nanofiltration membrane[J]. Journal of Membrane Science, 2000, 172(1/2): 9–17.
[61] Garcia F, Ciceron D, Saboni A, et al. Nitrate ions elimination from drinking water by nanofiltration: Membrane choice[J]. Separation and Purification Technology, 2006, 52(1): 196–200.
[62] van der Bruggen B, Everaert K, Wilms D, et al. Application of nanofiltration for removal of pesticides, nitrate and hardness from ground water: Rejection properties and economic evaluation[J]. Journal of Membrane Science, 2001, 193(2): 239–248.
[63] De Boer W, Kowalchuk G A. Nitrification in acid soils: Micro-organisms and mechanisms[J]. Soil Biology and Biochemistry, 2001, 33(7/8): 853–866.
[64] Crumpton W G, Isenhart T M, Mitchell P D. Nitrate and Organic N Analyses with Second-Derivative Spectroscopy. Limnology & Oceanography, 1992.
[65] Leenheer J A, Dotson A, Westerhoff P. Dissolved organic nitrogen fractionation[J]. Annals of Environmental Science, 2007(1): 45–46.
[66] Świetlik J, Dąbrowska A, Raczyk-Stanisławiak U, et al. Reactivity of natural organic matter fractions with chlorine dioxide and ozone[J]. Water Research, 2004, 38(3): 547–558.
[67] Maurice P A, Pullin M J, Cabaniss S E, et al. A comparison of surface water natural organic matter in raw filtered water samples, XAD, and reverse osmosis isolates[J]. Water Research, 2002, 36(9): 2357–2371.
Advances in Determination of Soil Dissolved Organic Nitrogen
CHU Cheng1, CHENG Yi1, CAO Yacheng2*, CAI Zucong1,3,4,5, ZHANG Jinbo1,3,4,5*
(1 School of Geography Sciences, Nanjing Normal University, Nanjing 210023, China; 2 State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 3 State Key Laboratory Cultivation Base of Geographical Environment Evolution (Jiangsu Province), Nanjing 210023, China; 4 Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application, Nanjing 210023, China; 5 Key Laboratory of Virtual Geographic Environment (Nanjing Normal University), Ministry of Education, Nanjing 210023, China)
Dissolved organic nitrogen (DON), as the main component of the bioavailable organic nitrogen pool in the soil, is one of the most active forms of organic nitrogen. As an important part of the soil nitrogen biochemical cycle, the migration and transformation of DON in the soil is closely related to the processes of nitrogen supply and loss. However, researches on soil DON were strongly limited by the lack of accurate and reliable analysis methods. This article summarized DON determination methods in soil extracts and waters in recent years, and focused on comparing the effects of different total soluble nitrogen (DTN) measurement methods and different pretreatment methods on improving the accuracy of DON analysis.
Dissolved organic nitrogen; Dissolved total nitrogen; Pretreatment methods; Inorganic nitrogen removal; Subtraction method
S151.9;S132
A
10.13758/j.cnki.tr.2021.03.002
储成, 程谊, 曹亚澄, 等. 土壤可溶性有机氮测定方法研究进展. 土壤, 2021, 53(3): 449–457.
国家自然科学基金项目(41830642)资助。
(yccao@issas.ac.cn;zhangjinbo@njnu.edu.cn)
储成(1987—),女,江苏常州人,博士研究生,主要从事土壤氮素测定及仪器分析。E-mail: cc2096@163.com

