转录因子BvM14-Dof3.4响应盐胁迫的功能研究
杜晓雪,黄园园,马春泉,李海英
(1黑龙江大学农业微生物技术教育部工程研究中心,哈尔滨 150500;2黑龙江大学生命科学学院,黑龙江省普通高校分子生物学重点实验室,哈尔滨 150080)
0 引言
中国盐渍化土壤面积已达3400万hm2,占总耕地面积的1/3[1],盐渍化会降低土地生产力,阻碍农作物的正常生长,严重限制着土地利用率与农作物产量[2]。土壤中的盐分会降低土壤的水势,使植物吸水困难,导致植物受到渗透胁迫,渗透胁迫作为盐胁迫后的初级胁迫影响植物的生长[3];当土壤中盐浓度超过阈值时,植物体产生离子毒害。渗透胁迫和离子毒害还会引起氧化胁迫等一系列次级胁迫,导致农作物产量大幅下降[4]。因此,提高农作物对盐胁迫耐受能力对于土地资源的开发利用及提高农作物产量具有重要作用。
Dof转录因子是一种植物特有的转录因子,含一个锌指结构,可以识别靶基因启动子区域中5'末端的AAAG序列[5]。Dof转录因子首先在玉米(Zea mays)中被分离,并证明参与C4植物光合作用[6],之后在许多物种中鉴定到Dof转录因子,例如蒺藜苜蓿(Medicago truncatula)[7]、拟南芥(Arabidopsis thaliana)[8]、水稻(Oryza sativa)[9]、高粱 (Sorghum bicolor)[10]、木豆(Cajanus cajan)[11]、马铃薯(Solanum tuberosum)[12]、大白菜(Brassica rapa)[13]、辣椒(Capsicum annuum)[14]、胡萝卜(Daucus carota)[15]、黄瓜(Cucumis sativus)[16]、番茄(Solanumlycopersicum)[17]、杨树 (Populus trichocarpa)[18]、小麦 (Triticum aestivum)[19]和大豆(Glycine max)[20]。研究表明Dof转录因子可以提高转基因植株的耐盐能力。柽柳(Tamarix hispida)的ThDof1.4基因异源表达可提高转基因烟草活性氧(ROS)的清除能力,从而增加转基因烟草对盐胁迫的耐受性[21];棉花(Gossypium hirsutum)中过表达GhDof1基因提高了棉花的耐盐性、耐冷性及籽油含量[22];番茄(Solanum lycopersicum)SlDof22转录因子通过和SlSOS1基因的启动子结合增加了番茄的耐盐性[23];盐胁迫下水稻(Oryza sativa)OsDof18转录因子参与OsRGLP2基因的转录激活,使转基因烟草表现出更强的耐盐能力[19]。除此外,小立碗藓(Physcomitrella patens)、毛竹 (hyllostachysedulis)、苹果 (Malus domestica)的Dof转录因子也可以提高转基因植株的耐盐能力[13,24-25]。
实验室前期Yang等[26]通过蛋白质组学技术发现乙二醛酶Ⅰ受盐胁迫后表达量呈上调趋势,进一步Wu等[27]证明异源表达BvM14-glyoxalaseⅠ基因能够提高转基因烟草的耐盐能力;通过构建该基因启动子缺失片段植物表达载体,瞬时转化烟草确定了BvM14-glyoxalaseⅠ基因启动子盐胁迫响应的核心片段(P4片段,714 bp),进而采用酵母单杂交技术获得了与BvM14-glyoxalaseⅠ基因启动子P4片段互作的BvM14-Dof3.4转录因子序列;黄园园[28]根据实验室前期获得的转录组数据库信息筛选并克隆获得BvM14-Dof3.4基因的cDNA全长,生物信息学分析表明BvM14-Dof3.4蛋白氨基酸序列与NCBI数据库中甜菜(Beta vulgaris)的氨基酸序列相似度为99.26%,且与菠菜(Spinacia oleracea)Dof3.4蛋白亲缘性较高;200、400 mmol/L NaCl胁迫下该基因的表达量分别上调了2.05倍和1.41倍,说明BvM14-Dof3.4基因应答盐胁迫。为进一步评价BvM14-Dof3.4在作物耐盐遗传改良中的应用价值,本研究将BvM14-Dof3.4基因在拟南芥野生型植株中进行异源表达,通过野生型和转基因植株在0、150 mmol/L NaCl处理下的表型、K+/Na+比、甜菜碱含量以及SOD和POD的酶活性等进行比较分析,确定BvM14-Dof3.4基因能否提高转基因拟南芥植株耐盐能力,为甜菜M14品系优质基因资源的挖掘和耐盐分子机制的解析及甜菜遗传改良工作奠定基础。
1 材料方法
1.1 实验材料
1.1.1 植物材料 甜菜M14品系(专利号:CN1263695A)和拟南芥(Arabidopsis thaliana)哥伦比亚型由实验室保存。
1.1.2 材料的培养和处理 挑选颗粒饱满的甜菜M14品系种子消毒后播种于发芽盒中,7天后将幼苗转入霍格兰营养液中继续培养,14天后进行200 mmol/L NaCl处理7天,保留叶片和根部样品用于后续试验。
将消毒后的野生型拟南芥种子播种于含10 mg/L Kan的1/2 MS固体平板培养基中,置于人工气候室(温度25℃、相对湿度70%、光暗周期14 h/10 h)中培育,7天后将幼苗转入含有150 mmol/L NaCl的1/2 MS固体平板培养基中继续培养,14天后用于后续试验。
1.1.3 菌株及质粒 大肠杆菌(Escherichia coli)DH5α菌株、根癌农杆菌(Agrobacterium tumefaciens)EHA105菌株、植物表达载体35S::pCAMBIA1300均由实验室保存。
1.1.4 试剂及引物 pMD18-T Vector Kit、DNA Marker、Agarose Gel DNA Purification Kit、RNaseA、Ex Taq、限制性核酸内切酶XbaⅠ和SacⅠ等试剂购自TaKaRa公司;DNA连接酶购自Promega公司;超氧化物歧化酶(SOD)试剂盒、过氧化物酶(POD)试剂盒、甜菜碱含量试剂盒购于苏州科铭生物技术有限公司;实验所需引物(表1)由生工生物工程(上海)股份有限公司负责合成。

表1 引物序列
1.2 方法
1.2.1 植物表达载体35S::pCAMBIA1300-BvM14-Dof3.4的构建及转化农杆菌 根据黄园园[28]获得的BvM14-Dof3.4基因cDNA全长序列,设计带有XbaⅠ和SacⅠ酶切位点的基因特异性引物(把表1中对应的引物对加上),进行PCR扩增,反应条件:94℃,2 min;98℃,10 s;62.5℃,30 s;72℃,30 s,循环 30次;72℃,7 min;进而对35S::pCAMBIA1300载体质粒及扩增获得的目的基因进行双酶切(XbaⅠ和SacⅠ),反应条件:37℃反应12~16 h,65℃,灭活30 min终止酶切反应;将连接成功的35S::pCAMBIA1300-BvM14-Dof3.4重组DNA分子转化大肠杆菌DH5α菌株,按照浓度(100、150、200 μL)梯度涂布于含有 50 mg/L Kan的LB固体培养基上,筛选出阳性转化子,送至生工生物工程(上海)股份有限公司测序;测序验证后采用碱裂解法提取重组质粒35S::pCAMBIA1300-BvM14-Dof3.4,经冻融法成功转化根癌农杆菌EHA105,用于后续拟南芥浸染实验。
1.2.2 利用花序浸染法获得异源表达植株 培育野生型拟南芥(WT),待植株抽薹时,将野生型拟南芥植株花序浸没在含有重组质粒35S::pCAMBIA1300-BvM14-Dof3.4的根癌农杆菌EHA105菌液中,收获成熟后的种子在含有50 mg/L Kan的MS培养基上进行筛选,对生长的抗性苗,采用CTAB法提取叶片基因组DNA进行PCR验证,采用TRIzol试剂提取叶片总RNA进行反转录,以18S rRNA为内参基因进行半定量RT-PCR检测。培育至T3代,直至获得BvM14-Dof3.4基因异源表达拟南芥阳性植株(OX)。
1.2.3 根长、鲜重、干重测定 将野生型拟南芥WT和BvM14-Dof3.4基因异源表达拟南芥阳性植株OX植株的种子分别在1/2 MS培养基中培养7天后,选取长势一致的幼苗转移至新的分别含0、150 mmol/L NaCl的1/2 MS培养基中继续培养14天,以0 mmol/L NaCl培养基中WT和OX植株为对照,测定150 mmol/L NaCl胁迫下WT和OX植株的根长、鲜重、干重。
1.2.4 K+/Na+比、甜菜碱含量测定 取0、150 mmol/L NaCl胁迫处理后的WT和OX植株叶片进行60℃烘干处理,待恒重后进行研磨,过60目筛,精确称取样品0.1 g,加入5 mL酸液(HNO3:HClO4=4:1)静置过夜,次日180℃加热消化样品,待样品冷却后加入3 mL CsCl溶液(10 g/L),0.2 μm滤膜过滤后的样品采用火焰光度法对K+、Na+含量进行测定。
精确称取样品0.1 g,加入1 mL 80%甲醇溶液,60℃反应30 min,25℃条件下12000 r/min离心15 min,取上清作为样品待测液,采用微板法测定甜菜碱含量,具体方法参见G0122W甜菜碱含量试剂盒说明书。
1.2.5 SOD和POD酶活测定 称取0、150 mmol/L NaCl胁迫处理后的WT和OX植株新鲜叶片0.2 g,加入1 mL提取液,置于冰上研磨,在4℃条件下12000 r/min离心10 min后,取上清作为样品待测液,采用紫外分光光度法测定叶片中SOD和POD酶活性,具体步骤参照G0102F超氧化物歧化酶(SOD)-WST法-说明书和G0108F过氧化物酶(POD)-WST法-说明书。
1.2.6 数据统计分析 本研究所有样品都进行3次生物学重复,利用GraphPad Prime 6软件进行分析和数据处理,采用方差分析进行样品间差异分析,差异显著性阈值为P<0.05。
2 结果与分析
2.1 植物表达载体35S::pCAMBIA1300-BvM14-Dof3.4的构建
提取35S::pCAMBIA1300-BvM14-Dof3.4重组质粒,利用带有XbaⅠ和SacⅠ酶切位点的基因特异性引物BvM14-Dof3.4-S和BvM14-Dof3.4-AS进行PCR扩增验证,根据已知的BvM14-Dof3.4基因cDNA全长大小,由图1可以确定重组质粒中含有BvM14-Dof3.4基因,说明载体构建成功,可以进行后续转化试验。

图1 35S::pCAMBIA1300-BvM14-Dof3.4重组质粒PCR产物的1%琼脂糖凝胶电泳图
2.2 BvM14-Dof3.4基因异源表达拟南芥阳性植株的获得
将成功转入35S::pCAMBIA1300-BvM14-Dof3.4重组质粒的根癌农杆菌EHA105,利用花序浸染法转化拟南芥野生型WT植株,经筛选获得Kan抗性苗。以BvM14-Dof3.4-S和BvM14-Dof3.4-AS为引物,随机选取4株抗性苗进行PCR检测,如图2(A)所示,4株异源表达拟南芥植株中均含有BvM14-Dof3.4基因。进而以18S rRNA为对照,采用dof-S和dof-AS为引物对上述4株异源表达拟南芥植株进行RT-PCR检测,如图2(B)所示,1-3号异源表达拟南芥植株的BvM14-Dof3.4基因进行了转录,4号植株虽有基因转入但未进行转录。因而成功获得了3株BvM14-Dof3.4基因异源表达拟南芥阳性植株OX1-3。
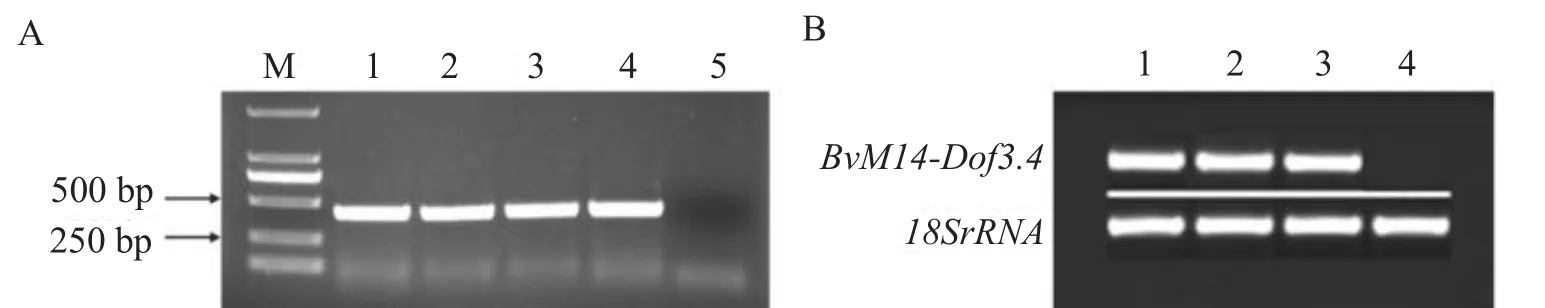
图2 BvM14-Dof3.4基因异源表达拟南芥植株OX的PCR及RT-PCR检测结果
2.3 BvM14-Dof3.4基因异源表达拟南芥植株生理生化指标测定
2.3.1BvM14-Dof3.4基因异源表达拟南芥植株根长、鲜重、干重测定 以0 mmol/L NaCl培养基中拟南芥野生型WT植株和BvM14-Dof3.4基因异源表达拟南芥OX植株为对照,150 mmol/L NaCl胁迫处理后的WT和OX植株的表型、根长、鲜重和干重如图3所示。由图3(A、B)可见,0 mmol/L NaCl时OX植株根长较WT植株略长,但差异不显著;150 mmol/L NaCl胁迫处理后,OX植株根长显著长于WT植株,说明BvM14-Dof3.4基因的异源表达能够促进盐胁迫下拟南芥植株根的生长。进一步发现150 mmol/L NaCl胁迫处理后,OX植株的鲜重(图3(C))和干重(图3(D))均显著高于WT植株,说明BvM14-Dof3.4基因的异源表达可以保证OX植株在盐胁迫下的正常生长,提高了OX植株的耐盐能力。
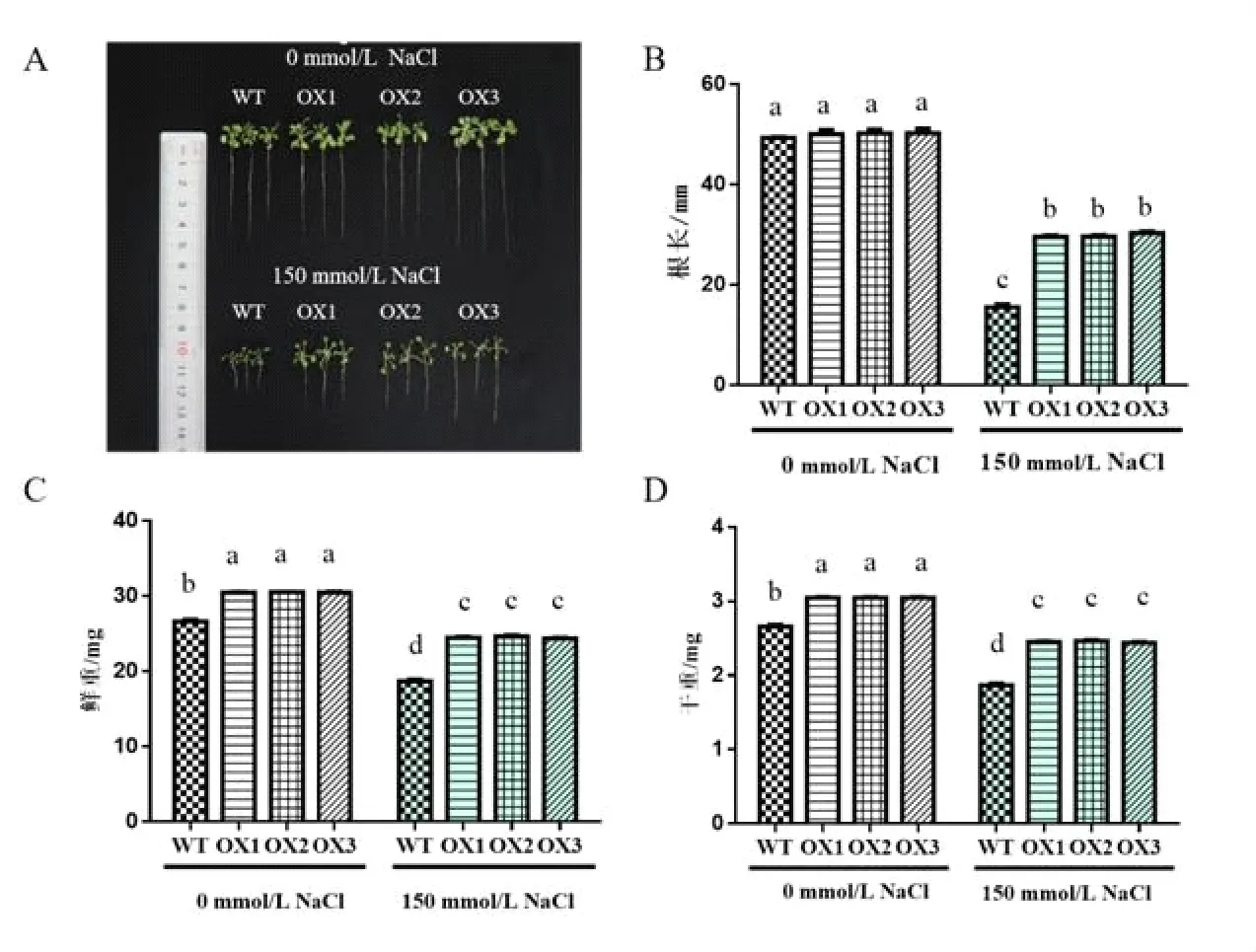
图3 150 mmol/L NaCl处理前后WT和OX拟南芥植株的表型及根长、鲜重、干重测定结果
2.3.2BvM14-Dof3.4基因异源表达拟南芥植株K+/Na+比及甜菜碱含量的测定 由图4(A)可知,0 mmol/L NaCl时OX植株K+/Na+比值与WT植株相比差异不显著,而150 mmol/L NaCl胁迫处理后,OX植株K+/Na+比值较于WT植株增加1.3倍(P<0.05),说明BvM14-Dof3.4基因的异源表达增加了OX植株对K+的吸收和Na+的外排,从而减轻OX植株受到盐的伤害,提高了OX植株的耐盐能力。甜菜碱含量如图4(B)所示,0 mmol/L NaCl时虽然OX植株甜菜碱含量略高于WT植株,但差异并不显著,而150 mmol/L NaCl胁迫处理后,OX植株甜菜碱含量较WT植株含量增加1.1倍(P<0.05),说明BvM14-Dof3.4基因的异源表达通过增加甜菜碱含量改善了OX植株的渗透调节能力,提高了OX植株抵御盐胁迫的能力。

图4 150 mmol/L NaCl处理前后WT和OX拟南芥植株的K+/Na+比值和甜菜碱含量测定结果
2.3.3BvM14-Dof3.4基因异源表达拟南芥植株SOD、POD酶活的测定 150 mmol/L NaCl胁迫处理前后WT植株和OX植株的SOD和POD酶活测定结果如图5所示。0 mmol/L NaCl时,OX植株与WT植株SOD和POD酶活差异不显著,而150 mmol/L NaCl胁迫处理后,OX植株的SOD和POD酶活显著增加,相较于WT植株分别上调1.3和1.2倍(P<0.05),说明BvM14-Dof3.4基因的异源表达通过提高SOD和POD酶活性,加速ROS的清除,降低盐胁迫下ROS升高而导致的伤害,从而增强OX植株的耐盐能力。

图5 150 mmol/L NaCl处理前后WT和OX拟南芥植株的SOD和POD酶活测定结果
3 讨论与结论
Dof转录因子C末端的转录激活调控结构域的多变性使得Dof转录因子可以发挥多种生物学功能[29],虽然越来越多的Dof转录因子被报道在植物逆境中发挥作用,但甜菜中进行Dof转录因子功能的研究还未见报道。
一般情况下,盐胁迫后植物细胞内(除液泡外)Na+含量会显著升高,造成离子毒害,植物细胞会通过排除过量的Na+和吸收更多的K+,来维持细胞内K+/Na+比例平衡,因此维持较高的K+/Na+比值可增强植物抵御盐胁迫的能力[30]。本研究中150 mmol/L NaCl胁迫处理后,BvM14-Dof3.4基因的异源表达促进了拟南芥细胞内K+/Na+比值升高,同时甜菜碱含量的提高也增加了BvM14-Dof3.4基因异源表达拟南芥植株体内的渗透调节作用,共同提高了异源表达拟南芥植株耐盐能力,这与才晓溪等[31]在强耐盐特性的甜菜M14品系与二倍体栽培甜菜耐盐性比较的研究报道是一致的。
盐胁迫不仅对植物造成离子毒害和渗透胁迫,还会使ROS过量积累引起次级氧化胁迫,影响植物的生长发育。SOD和POD是ROS清除系统中的关键酶,其中SOD催化O2.-与H+生成H2O2,再经过POD与其他酶相互协调,可有效地清除盐胁迫下植物代谢途径中产生的ROS。大量研究报道已经表明,SOD和POD活性的增强可以提高植株对盐胁迫的耐受性[32]。本研究中,150 mmol/L NaCl胁迫处理后BvM14-Dof3.4基因异源表达拟南芥植株中SOD和POD酶活性和对照组相比显著增加,表明异源表达拟南芥植株增强了ROS的清除能力,从而提高了异源表达拟南芥植株对盐胁迫的耐受能力,这与Zang等[21]人在柽柳的中的研究报道一致。
本研究首次在甜菜M14品系中展开转录因子BvM14-Dof3.4响应盐胁迫的功能研究,并证明BvM14-Dof3.4参与甜菜M14品系耐盐的生物学过程,通过提高K+/Na+比值(1.3倍)和甜菜碱含量(1.1倍)来维持渗透压,通过提高SOD酶活性(1.3倍)和POD酶活性(1.2倍)加速ROS清除,最终促进植株生长,提高异源表达植株的耐盐性,结果填补了甜菜属Dof家族转录因子参与植物耐盐过程的研究。虽然本研究阐明了BvM14-Dof3.4转录因子的耐盐功能,但其所参与的代谢途径并不清楚,后续试验将主要围绕以下两方面开展:(1)BvM14-Dof3.4基因结构分析;(2)BvM14-Dof3.4转录因子在BvM14-glyoxalaseⅠ基因抗盐系统中的功能。

