siRNA转染对大鼠髓核细胞TRAIL表达和细胞行为的影响△
徐世民,刘 洋,潘洪发,史玉林,王瑞泓,高加智
(山东省潍坊市人民医院脊柱外科,山东潍坊 261041)
椎间盘退行性病变(intervertebral disc degenera⁃tion,IDD)作为一种常见的骨关节疾病,是导致椎间盘突出、腰椎滑脱和椎管狭窄甚至造成残疾的主要原因,严重影响患者健康并降低患者生活质量,给社会带来了巨大的医疗和经济负担,但其发病机制尚不明确[1]。目前研究显示,椎间盘退行性病变与衰老、过度体力劳动、炎性细胞因子以及遗传因素有关,其中炎症因子激活导致的细胞凋亡是导致疾病发病主要因素[3]。半胱氨酸天冬氨酸酶(caspase)家族激活所导致的细胞凋亡是导致椎间盘退行性疾病的主要原因[4]。
半胱氨酸天冬氨酸酶家族是一个高度同源的蛋白质家族。Caspase-3是从人T淋巴细胞中克隆到的Caspase家族成员,在胞浆中作为一种非活性的前体酶存在,Caspase-3的激活导致质膜脱落、染色质凝聚、DNA断裂[5]。研究发现,Caspase-3可作为治疗IDD靶点改善椎间盘退行性病变症状[6]。而TRAIL是属于TNF超家族的一种氨基酸Ⅱ型跨膜蛋白,在转化细胞和癌细胞中TRAIL可优先通过TRAIL-R2/DR5 和 TRAIL-R1/DR4 受体诱导细胞凋亡[7,8]。TRAIL基因在人椎间盘中的表达与IDD有关,提示TRAIL基因可能在IDD发病机制中起一定作用。
细胞凋亡主要包括线粒体途径和死亡受体途径。在细胞凋亡的信号作用下,线粒体中凋亡因子内激活,改变线粒体膜通透性,大量凋亡因子被释放,激活caspese-3蛋白对底物切割,引起凋亡。在死亡受体途径中,TRAIL被激活后,诱导Fas相关死亡结构域蛋白 (Fas-associated death domain,FADD)、cas⁃pese-8与死亡受体DR4和DR5结合形成死亡诱导信号复合物(death-inducing signaling complex,DISC),触发细胞凋亡。因此,本研究探讨TRAIL和Cas⁃pase-3与IDD发病的关系,为临床治疗提供依据。
1 材料与方法
1.1 实验动物与处理
选用雄性SD大鼠(潍坊医学院动物实验中心提供),体重 (400.56±30.14)g,共10只。所有大鼠适应性喂养1周后,采用弯曲鼠尾法建立椎间盘退变模型。造模后单笼喂养,每日观察鼠尾U型固定器,若固定器脱落再次进行固定。造模8周后随机选取5只大鼠进行腰椎X线检测。大鼠腰椎X线显示脊柱腰段向一侧成S状侧弯,判断本次造模成功。造模成功后继续喂养4周,将小鼠麻醉后,取得椎间盘组织,处死。PBS液漂洗大鼠尾椎间盘中髓核组织;采用眼科剪,将髓核组织剪碎至0.1 mm3的小碎块;加入3 mg/mlⅠ型胶原酶和4 mg/ml消化酶,至于温箱中消化4 h;将消化混合液进行离心,使用10%血清DMEM培养基重悬,将细胞悬浮液加入到培养皿中,置于5%CO2,37℃的温箱中过夜培养;当原代细胞从髓核组织块边缘逐渐生长出来,用无菌PBS进行冲洗,然后使用0.25%胰酶消化处理,约有80%的贴壁细胞脱落时,终止消化,离心并重悬细胞,按照106/ml的细胞密度重新接种于培养皿中;待细胞生长达到培养皿底部约80%汇合率时收获细胞进行相关实验。
1.2 细胞分离与培养
髓核组织用消化酶消化后,分离出髓核细胞,用10%胎牛血清(美国Invitrogen公司)的DMEM培养基(美国Gibco公司)进行沉淀,记为原代(P0)。加入0.25%胰蛋白酶(美国Gibco公司)2 ml,当细胞突起回缩、变圆、细胞间隙变大,按1∶4传代接种到新的培养皿中,细胞计数并调整细胞密度。
1.3 细胞分组处理
P1细胞分为4组,分别为空白对照组(control组)、TRAIL-siRNA转染组(siTRAIL组)、TNF-α处理组(TNF-α组)和TNF-α处理+TRAIL-siRNA转染组(TNF-α+siTRAIL组)。
空白对照组:细胞常规培养,不行其它干预。
TRAIL-siRNA转染组:将髓核细胞用0.25%胰蛋白酶消化并计数后接种于6孔板,以DMEM培养基稀释 10 μl Lipofectamine 2000~250 μl,加入 0.05 nmol的TRAIL siRNA至250μl DMEM培养基,终浓度为200 nmol/L。1×PBS缓冲液冲洗采用荧光定量PCR检测髓核细胞中TRAIL的表达,以确定转染效率。
TNF-α处理组:细胞接种于6孔板,加入浓度为100 ng/ml的TNF-α的低糖DMEM培养基,持续培养2 d。
TNF-α处理+TRAIL-siRNA转染组:将髓核细胞用浓度为100 ng/ml的TNF-α处理,培养2 d后,用0.25%胰蛋白酶消化并计数后接种于6孔板,加入Lipofectamine 2000和TRAIL siRNA DMEM培养基,终浓度为200 nmol/L。1×PBS缓冲液冲洗采用荧光定量PCR检测髓核细胞中TRAIL的表达,以确定转染效率。
1.4 检测方法
1.4.1 MTT检测细胞活性
将细胞以每孔5×103个细胞接种到培养板。培养48 h后,加新鲜配置的MTT溶液(5 mg/ml)20μl/孔,继续孵育4 h。上清液吸除,每孔中加150μl DMSO,室温,摇床振荡10 min。490 nm波长,测定各孔光吸收值。
1.4.2流式细胞仪检测细胞凋亡
细胞收集后并洗涤,用 100 μl的标记溶液FITC-Annexin V和PI溶液重悬细胞,室温下避光孵育15 min。1 200 r/min,弃上清,重悬。加入荧光染液溶液,4℃孵育20min。BD FACSAria流式细胞仪检测。
1.4.3细胞总蛋白提取与Western blot分析
收集体外培养的各组细胞,置-80℃冰箱保存。检测前室温下自然解冻,制备细胞匀浆。采用8%凝胶,室温,100 v,电泳90 min。在4℃冰箱中利用湿转法进行转印,85 v,90 min。将转印后的PVDF膜与Caspase-3抗体(1∶500)抗体结合,4℃,12 h。PVDF膜与二抗(1∶2000)结合。进行发光法应并拍照。
1.5 统计学方法
2 结果
2.1 MTT细胞增殖检测
MTT法检测细胞增殖结果见图1,相较于空白对照组,TRAIL-siRNA转染组细胞的生长速度(100.75±5.72)%,差异无统计学意义(P>0.05),TNF-α处理组细胞的增殖速度(49.19±2.89)%,差异有统计学意义(P<0.05),而TRAIL-siRNA转染+TNF-α处理组细胞的活性无明显变化(P>0.05),提示沉默TRAIL的表达能显著改善TNF-α诱导的细胞活性抑制。
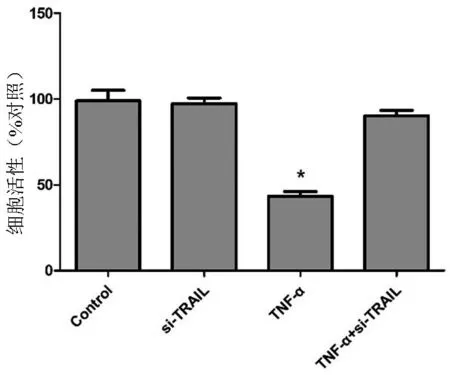
图1 siRNA沉默TRAIL表达对大鼠髓核细胞活性的影响 注:与对照组相比,*P<0.05
2.2 流式细胞检测细胞凋亡
流式细胞术检测细胞凋亡结果见图2,相较于空白对照组,TRAIL-siRNA转染组大鼠髓核细胞凋亡无明显改变(P>0.05),TNF-α处理组细胞的细胞凋亡显著增加(P<0.05),提示TRAIL-siRNA转染可抑制TNF-α诱导的细胞凋亡。
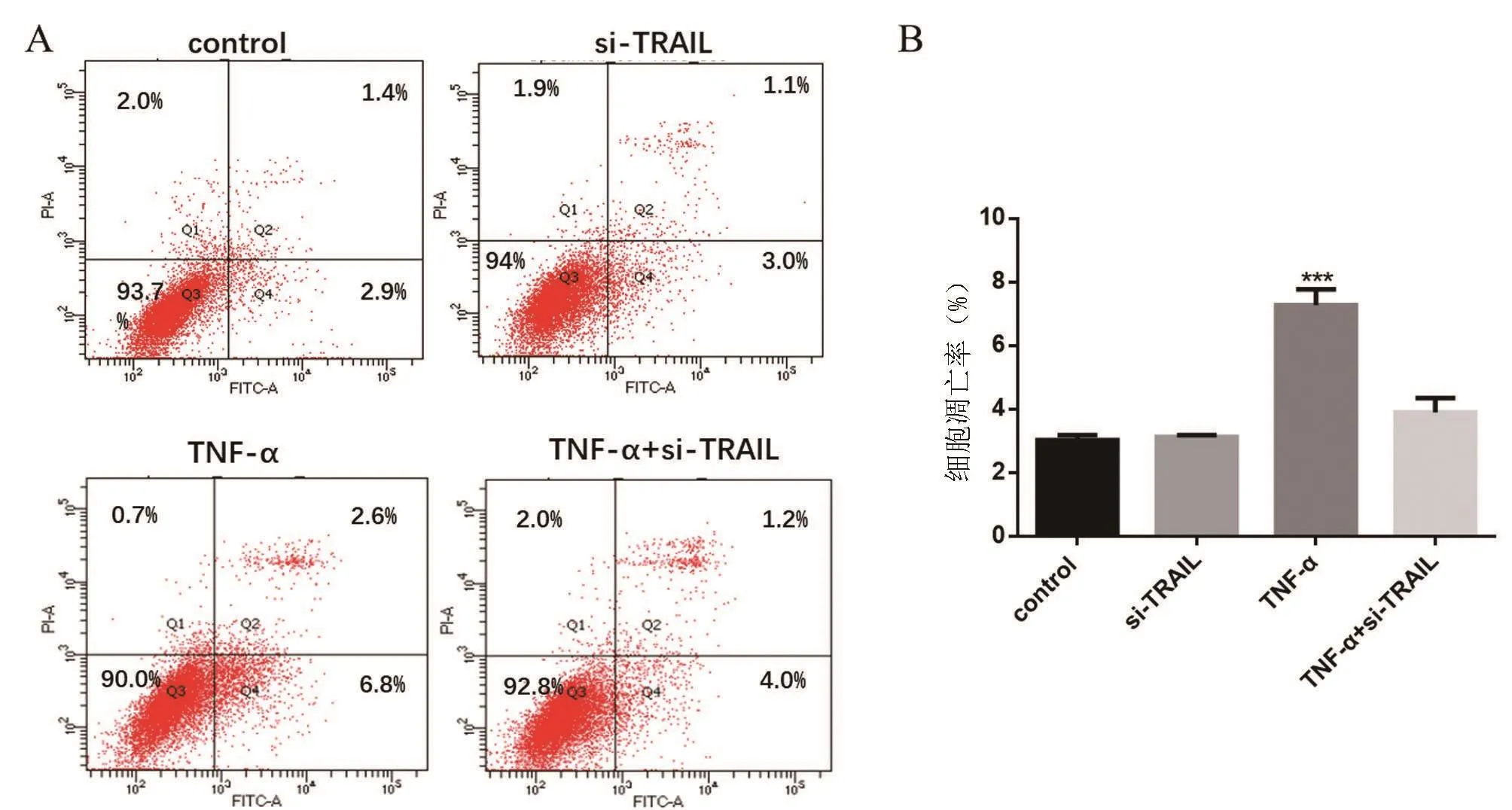
图2 siRNA沉默TRAIL表达对大鼠髓核细胞凋亡的影响
2.3 Wester block检测Caspase-3蛋白表达
Western blot检测大鼠髓核细胞中Caspase-3蛋白表达水平的结果见图3。相较于空白对照组,TRAIL-siRNA转染组大鼠髓核细胞中Caspase-3活性和表达无明显变化(P>0.05),TNF-α处理组细胞中Caspase-3的活性和表达明显升高(P<0.05),而TRAIL-siRNA转染+TNF-α处理组细胞Caspase-3的活性和表达无明显变化(P>0.05),提示沉默TRAIL的表达可抑制TNF-α诱导的Caspase-3激活和表达。
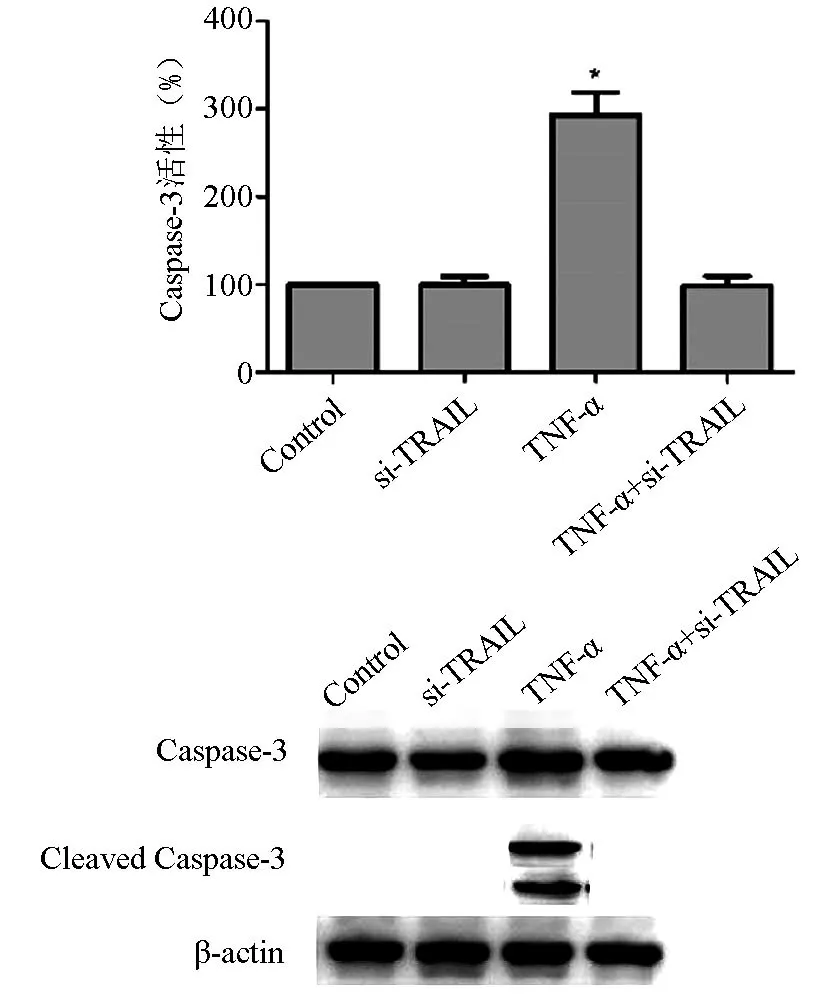
图3 siRNA沉默TRAIL表达对大鼠髓核细胞中Cas⁃pase-3活性和表达的影响
3 讨论
大约40%的30岁以下的人和超过90%的55岁或55岁以上的人群患不同程度的椎间盘退行性病变。我国IDD发病率呈逐年上升,且呈年轻化趋势[6]。在多种机制的作用下,椎间盘组织发生细胞表型改变、凋亡、老化、炎性反应以及细胞外基质成分改变等,最终导致患者出现一系列临床症状[9]。椎间盘细胞结构和功能发生变化会破坏纤维环与核之间的边界导致髓核细胞失水,降低椎间盘的承载能力。随着生活方式的改变、运动的减少、衰老以及人类生活的加速和长期的工作,椎间盘退行性病变的发病率不断上升。椎间盘退行性病变可能导致丧失劳动能力,甚至导致残疾,已逐渐成为全球公共卫生问题之一。
细胞凋亡是细胞内稳态的一个重要过程,在多种临床疾病中起着重要作用。细胞凋亡是导致椎间盘退行性病变的主要原因,并证实在IDD过程中抑制细胞凋亡是预防或逆转椎间盘退变的有效途径[10,11]。Gruber等[12]首次在人体中证实椎间盘细胞存在凋亡现象,经检测发现IDD患者60%左右的椎间盘细胞发生凋亡。
细胞凋亡的过程比较复杂,一般认为凋亡过程主要有两种途径,即线粒体途径和死亡受体途径。线粒体通路被多种细胞应激和大量凋亡信号激活,对IDD过程中细胞凋亡起着重要的作用。在氧化应激作用下,位于线粒体中的bcl-样蛋白发生构象变化导致线粒体通透性改变,线粒体膜电位被下调,线粒体随后通过释放细胞色素C,caspase级联反应被激活,完成对底物切割,引起凋亡[13]。死亡受体途径主要由TRAIL/TRAIL-R介导,TRAIL被激活后,诱导Fas相关死亡结构域蛋白(Fas-associated death do⁃main,FADD)、caspese-8与死亡受体DR4和DR5结合形成死亡诱导信号复合物(death-inducing signal⁃ing complex,DISC),触发细胞凋亡[14]。
多种异常刺激可以增加髓核细胞中的炎性因子(如IL-1β和TNF-α)表达,从而引起髓核细胞合成代谢与分解活性的失衡,加速了椎间盘退变。同时也有研究证实,高水平的TNF-α可以激活内源性和外源性途径中的Caspase-3蛋白发挥凋亡作用,因此本研究选择TNF-α作为诱导髓核细胞凋亡的刺激性因子[15]。
本次研究结果发现,经TNF-α处理后细胞增殖明显降低,细胞凋亡显著升高,Western blot检测结果显示TNF-α处理组细胞的Caspase-3蛋白明显高于其他组。此外本次研究发现,TRAIL-siRNA转染+TNF-α处理组细胞的活性、凋亡率及Caspase-3蛋白水平与对照组无明显差异,提示siRNA沉默TRAIL表达可抑制TNF-α诱导的细胞凋亡,并可显著抑制TNF-α诱导的Caspase-3激活和表达。由此本次研究认为,TRAIL和Caspase-3蛋白通过参与髓核细胞的凋亡而引发腰椎间盘退变。TRAIL是一种凋亡分子,能与死亡受体特异性结合后选择性诱导细胞凋亡。Caspase-3蛋白具有剪切DNA蛋白片段的功能,是调控细胞凋亡的关键因子。Sun等[16]研究发现,TRAIL可激活死亡受体而启动外源性凋亡途径诱导髓核细胞凋亡,与本次研究结果相一致,并认为抑制TRAIL基因的表达使ERK通路失活,成为临床治疗IDD的潜在治疗靶点。与先前研究相一致的是,caspase-3在内源性(线粒体)细胞凋亡中发挥重要作用,短期抑制caspase-3可用于治疗损伤诱导的椎间盘退行性病变[6]。
简而言之,本研究通过观察TRAIL沉默后大鼠髓核细胞生物学特性的变化情况,表明TRAIL基因和Caspase-3蛋白诱导的凋亡途径参与了腰椎间盘的退变。

