光谱法结合计算模拟探究胡桃醌与脯氨酰顺反异构酶1的相互作用
蒋晓玙,马超,余凯,周安,朱国飞
(1.贵阳职业技术学院生化工程系,贵州贵阳 550081)(2.贵州理工学院食品药品制造工程学院,贵州贵阳 550003)
关键字:胡桃醌;脯氨酰顺反异构酶1(Pin1);光谱学;计算模拟;定点突变
胡桃楸和核桃在我国资源丰富,很多部分均可食用,具有很高的营养价值。大量研究结果表明,其含有的有效成分胡桃醌(Julgone,又名5-羟基-1,4-萘醌,属于萘醌类化合物),不仅具有显著的抗菌、止血功能,还具有较好的抗肿瘤功效,能有效地抑制胃癌,肝癌,卵巢癌,宫颈癌,肺癌,结肠癌等恶性肿瘤的增殖[1-3]。然而,胡桃醌的这种抗肿瘤作用的分子机制任然还不是很清楚。
脯氨酰顺反异构酶 1(peptidyl-prolyl cis-trans isomerase NIMA-interacting 1,Pin1)可以特异性调节磷酸化蛋白质中丝氨酸或苏氨酸-脯氨酸模体(pSer/Thr-Pro)从顺式构象转为反式构象,从而调节该蛋白功能,影响一系列信号通路[4]。Pin1的底物蛋白在有丝分裂、转录、分化和DNA损伤应答等各种生物功能起着重要的作用。尤其值得注意的是,Pin1在原癌基因信号通路中也起着关键的作用,并且在乳腺癌、结肠癌、前列腺癌和甲状腺癌等多种肿瘤细胞中过量表达,其表达量高低与肿瘤恶性程度成正相关,而抑制肿瘤细胞中 Pin1蛋白的活性能够触发细胞凋亡[5,6]。尽管研究表明,胡桃醌可作为 Pin1小分子抑制剂,能有效抑制其活性,从而抑制肿瘤增殖,但是胡桃醌与Pin1具体作用机制还知之甚少[7]。
为了从分子水平上探究胡桃醌对 Pin1的抑制机制,本研究采用最常用的光谱法结合计算模拟探究了胡桃醌与 Pin1的互作机理[8,9]。在本研究中,首先使用荧光光谱推断出Pin1与胡桃醌的淬灭常数、结合常数、结合位点数以及热力学参数等信息。其次,使用同步荧光光谱和圆二色谱探究胡桃醌对 Pin1构象的影响。再次,利用分子对接预测出潜在的结合位点,并对潜在的结合位点进行了定点突变,构建了H59A,L61A,C113A,S114和S154A等多个突变体,然后通过突变体荧光滴定对结合位点进行了验证。最后,采用分子动力学模拟探究 Pin1与胡桃醌在体外随时间变化的结合信息。申炳俊等探究了胡桃醌与人血清白蛋白的相互作用研究[3],为从分子水平上了解胡桃醌在体内可能的运转、代谢、排泄等提供了信息。本研究将从分子水平上探究胡桃醌与Pin1的相互作用,为阐明胡桃醌的抗肿瘤作用提供参考,为扩大胡桃醌的应用,综合开发利用我国胡桃楸和核桃资源,研发具有防癌、抑癌、治癌功能的保健食品、药品提供相应的科学依据。
1 材料和方法
1.1 材料与仪器
试剂:三羟甲基氨基甲烷(Tris)和二甲基亚砜(DMSO)购买自Sigma公司;胡桃醌(Julgone)购买自源叶公司;胰蛋白胨和酵母提取物购买自OXOID公司;异丙基-β-D-硫代半乳糖苷(IPTG)和氨苄青霉素购买自生工公司;其他化学试剂均为国产分析纯。
仪器:日立F-4700荧光光谱仪,Jasco J-815圆二色谱仪,戴尔T440塔式服务器。
1.2 实验方法
1.2.1 Pin1及其突变体原核表达与纯化
Pin1及其突变体H59A、L61A、C113A、S114和S154A重组质粒pET-19b由实验室保存。首先将重组质粒转化到大肠杆菌BL21(DE3),然后接种在含氨苄青霉素LB液体培养基中,待其长到对数期时,18 ℃,加入IPTG诱导10 h。离心收集菌体,然后重悬菌体,超声破碎,高速离心,弃沉淀,收集上清。将上清液倒入 Ni2+-NTA-Sepharose亲和层析柱中,先用 20 mmol/L咪唑溶液洗脱杂蛋白,再用400 mmol/L咪唑溶液洗脱目的蛋白,最后使用超滤管去除咪唑溶液。
1.2.2 荧光光谱
在石英比色皿中,加入200 μL的5 μmol/L Pin1溶液,每次滴加适量的1 mmol/L胡桃醌溶液,测量荧光光谱,控制胡桃醌终浓度为 0、5、10、15、20和30 μmol/L。内源荧光光谱采用295 nm作为激发波长,扫描波长为 310~400 nm。同步荧光光谱测定使用Δλ=15 nm和Δλ=60 nm,扫描范围分别为270~310 nm和250~310 nm。激发狭缝和发射狭缝分别设置为5和10 nm,激发电压为700 V,扫描速度为1200 r/mim。
1.2.3 圆二色谱
在比色皿中,加入200 μL的10 μmol/L Pin1溶液,每次滴定适量的1 mmol/L胡桃醌溶液,测量圆二色谱,控制胡桃醌终浓度为0、10和30 μmol/L。扫描速度设置为200 nm/min,响应时间设置为2 s,扫描波长为200~260 nm。
1.2.4 分子对接
Pin1的三维结构(PDB_ID:4TNS)下载自PDB蛋白数据库[10]。胡桃醌的三维结构(ZINC_ID:ZINC526257)下载自ZINC数据库[11]。使用ADT工具对Pin1蛋白进行预处理,包括去除配体,去除结晶水,加氢,加电荷以及确定对接盒子。使用AutoDock Vina 1.0软件进行分子对接[12]。
1.2.5 分子动力学模拟
使用GROMACS 4.6.5程序对分子对接之后的结合模型进行分子动力学模拟,使用 pdb2gmx和Ambertools程序分别获取Pin1和胡桃醌参数文件[13]。Pin1与胡桃醌复合物的分子力场选用AMBER99SB,并进行20 ns分子动力学模拟。使用GROMACS 4.6.5自带的工具进行模拟分析。
2 结果与讨论
2.1 荧光发射光谱检测胡桃醌与Pin1相互作用
荧光发射光谱能够监测蛋白结构中发色基团微环境的改变。Pin1蛋白包含三个色氨酸残基和三个酪氨酸残基,具有内源荧光现象。当激发波长为295 nm,主要呈现色氨酸残基微环境变化。如图1a所示,随着胡桃醌浓度的增加,Pin1的内源荧光强度逐渐下降。表明胡桃醌结合到Pin1中,导致Pin1荧光淬灭。
荧光淬灭可以分为两种,动态淬灭和静态淬灭,可以根据Stern-Volmer方程计算淬灭常数(Ksv)和动态荧光淬灭速率常数(Kq)得出。公式如下所示:
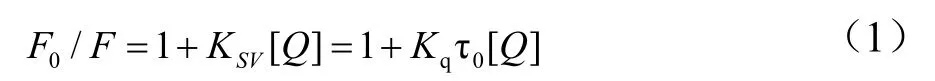
式中,F为有胡桃醌时Pin1的荧光强度;F0为无胡桃醌时Pin1的荧光强度;τ0为胡桃醌不存在时荧光体的荧光寿命,约为10-8s[14];[Q]为胡桃醌浓度。
根据公式 1,以F0/F对[Q]进行线性拟合,做出Stern-Volmer图,根据拟合直线的斜率可以得出不同温度下的Ksv和Kq值。如图1b和表1所示,在293 K,胡桃醌对Pin1淬灭常熟(Ksv)为1.36×104L/mol,随着温度的增加,Ksv值逐渐降低,表明温度升高会导致胡桃醌对Pin1的淬灭程度降低,这是一个典型的静态淬灭特征。此外,在293 K和303 K条件下,Kq值分别为 1.36×1012L/(mol·s)和 0.66×1012L/(mol·s),均远大于最大扩散碰撞淬灭常数2×1010L/(mol·s)[14],进一步表明胡桃醌对 Pin1的荧光淬灭过程是静态淬灭过程。
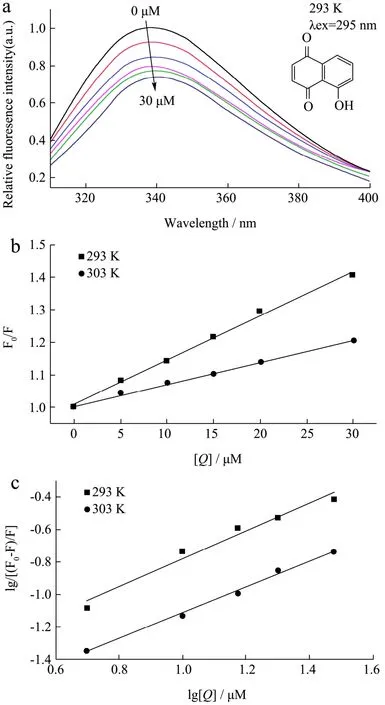
图1 内源荧光光谱图Fig.1 Fluorescence spectra
对于静态淬灭过程,可以使用 Lineweaver-Burk双对数方程计算结合常数(Ka)和结合位点数(n),公式如下所示:

式中,F为有胡桃醌时Pin1的荧光强度;F0为无胡桃醌时Pin1的荧光强度;[Q]为胡桃醌浓度。
根据公式2,以lg[(F0-F)/F]对lg[Q]进行线性拟合,做出 Lineweaver-Burk双对数图,以拟合直线的斜率和截距可以得出不同温度下的n和Ka值。如图1c和表1所示,在293 K条件下,Ka值为2.32×104L/mol,随着温度的增加,Ka值逐渐降低,表明温度升高会导致胡桃醌对Pin1的结合程度降低,这也是静态淬灭的典型特征之一。此外,在293 K和303 K条件下,n值分别为0.85和0.80,均接近1,表明胡桃醌对Pin1的结合只有一个结合位点。

表1 胡桃醌与Pin1相互作用热力学参数Table 1 Thermodynamic parameters between juglone and Pin1
药物与蛋白质之间的作用力主要有氢键,范德华力,疏水作用力和静电作用力,它们可以通过 Van’t Hoff方程计算焓变(ΔH),熵变(ΔS)和吉布斯自由能(ΔG)来判断[15]。公式如下所示:

式中,Ka为公式2中计算的结合常数;T为实验温度;R为气体常数。
根据公式3~5,可以分别计算出ΔH,ΔS和ΔG,结果如表1所示。在293 K和303 K条件下,ΔG分别为-24.49和-22.80 kJ/mol,表明胡桃醌与Pin1的结合是自发结合过程。根据Ross等归纳出来的热力学规律[16,17]:当ΔH>0和ΔS>0时,作用力为疏水作用力;当ΔH<0和ΔS>0时,作用力为静电作用力;当ΔH<0和ΔS<0时,作用力为氢键和范德华力。在293 K条件下,ΔH和 ΔS分别是 12.97 kJ/mol和 127.83 J/(mol·K)。这个结果表明胡桃醌与Pin1的结合过程中,主要的作用力是疏水作用力。此外,胡桃醌化学结构表明其有一个疏水性萘醌环组成,并含有一个羟基。因此,除了疏水作用力,氢键作用也不应该排除,详细的作用力类型将在对接模型和MM/PBSA结合自由能中进一步讨论。
2.2 同步荧光光谱检测胡桃醌对 Pin1构象的影响
同步荧光光谱可以检测蛋白质中色氨酸或酪氨酸微环境构象的变化。当Δλ(Δλ=λem–λex)分别等于15 nm和60 nm时,分别表示色氨酸和酪氨酸同步荧光光谱。如图2a所示,当Δλ=15 nm时,随着胡桃醌浓度的增大,酪氨酸荧光强度逐渐降低,表明胡桃醌可以淬灭酪氨酸内源荧光。并且,最大发射波长从 291 nm轻微红移至293 nm,表明酪氨酸残基周围微环境疏水性降低,极性增加。如图2b所示,当Δλ=60 nm时,随着胡桃醌浓度的增大,色氨酸荧光强度逐渐降低,表明胡桃醌可以淬灭色氨酸内源荧光。与酪氨酸同步荧光类似,最大发射波长从281 nm轻微红移至283 nm,表明色氨酸残基周围微环境疏水性降低,极性增加。

图2 胡桃醌与Pin1相互作用同步荧光光谱。Fig.2 Synchronous fluorescence spectra between juglone and Pin1
2.3 圆二色谱检测胡桃醌对 Pin1二级结构的影响
圆二色谱是最常见的检测蛋白质二级结构变化的技术之一[18,19]。如图3所示,Pin1的圆二色谱在208和222 nm附近有两个负峰,是典型的α-螺旋结构。随着胡桃醌浓度的增加,谱图中负峰强度减弱,表明胡桃醌与Pin1结合会导致Pin1的α-螺旋结构减少。可能是胡桃醌与 Pin1中α-螺旋结构中的氨基酸发生氢键缔合等作用,引起Pin1空间变化,α-螺旋数量下降[20,21]。为了进一步定量α-螺旋含量的变化,使用如下两个公式计算:

图3 胡桃醌与Pin1相互作用圆二色谱Fig.3 Circular dichroism between juglone and Pin1
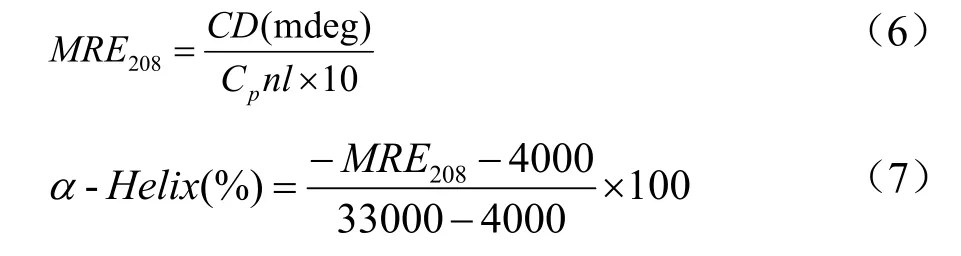
式中,Cp表示Pin1摩尔浓度(10 μM);n表示Pin1氨基酸残基数(163);l表示样品池的厚度(0.1 cm);MRE208表示蛋白质在208 nm处的平均残基椭圆率。
根据公式6和7,计算Pin1中α-螺旋含量。如图3所示,当加入胡桃醌和Pin1的摩尔比分别为1:0、1:1和1:3时,对应的Pin1的α-螺旋含量为23.44%、20.11%和17.82%。表明胡桃醌会导致Pin1中的α-螺旋含量减少。同时谱图形状和峰尖位置没有明显变化,也进一步说明胡桃醌主要影响Pin1中的α-螺旋结构。
2.4 分子对接预测胡桃醌与Pin1的结合模型
分子对接是最常见预测药物和蛋白结合的方法之一[22-24]。利用AutoDock Vina对胡桃醌和Pin1进行分子对接,预测两者结合模型和作用机制。如图4A所示,胡桃醌进入 Pin1疏水空腔中,并且与关键残基His59、Leu61、Cys113、Ser114和Ser154相互接触。为了进一步分析胡桃醌与 Pin1中关键残基作用力类型,详细的结果展现在图4B中,胡桃醌与Cys113、Ser114和Ser154形成三个氢键,以及与Cys113形成一个Pi-Alkyl键(一种疏水作用力),与His59和Leu61形成范德华力。这个结果与热力学参数结论一致,表明胡桃醌与Pin1的作用力类型主要是疏水作用力,氢键和范德华力。

图4 胡桃醌与Pin1相互作用预测结合模型Fig.4 Predicted binding model between juglone and Pin1
2.5 定点突变检测胡桃醌与Pin1的结合残基
为了进一步验证胡桃醌与 Pin1相互作用的结合模型,采用定点突变技术将His59、Leu61、Cys113、Ser114和Ser154突变为丙氨酸残基。然后将胡桃醌滴加到Pin1野生型和突变体中,测量内源荧光光谱。如果突变体荧光滴定结果与Pin1野生型差异较大,表明该残基是胡桃醌主要作用残基,反之,则表明该残基不是关键残基。如图5所示,突变体C113A与Pin1野生型和其它突变体结果差异较大,表明胡桃醌结合的关键残基为Cys113。这个结果与之前文献报道是一致的,进一步揭示胡桃醌结合Cys113残基,导致Pin1酶活降低[7]。

图5 胡桃醌对Pin1及其突变体荧光滴定结果Fig.5 Fluorescence titration between juglone and Pin1 and mutants
2.6 分子动力学模拟
分子动力学模拟可以模拟药物与蛋白在生理状态下,随时间变化的结合情况[25]。均方根偏差(RMSD)可以反映药物与蛋白结合稳定性。如图6a所示,Pin1-胡桃醌(Pin1-Julgone)体系和Pin1体系在20 ns模拟时间中,RMSD值变化幅度不大,表明胡桃醌可以稳定的结合到Pin1中。然而,C113A-胡桃醌(C113A-Julgone)体系在模拟时间内,RMSD值变化幅度明显大于Pin1-胡桃醌和Pin1体系,表明Cys113残基突变会影响胡桃醌对Pin1的结合。这个结果印证了突变体荧光滴定实验,进一步表明胡桃醌结合的关键残基是Cys113。均方根波动(RMSF)可以反映药物与蛋白结合的柔韧性。如图6c所示,Pin1-胡桃醌体系中的His59、Leu61、Cys113、Ser114和Ser154的RMSF明显低于Pin1体系,表明胡桃醌可以稳定的结合到这些关键残基。
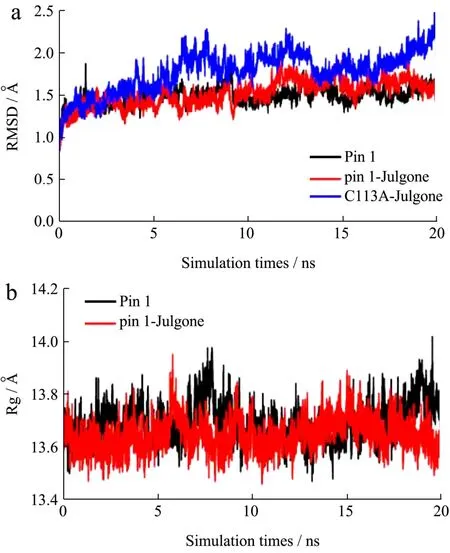
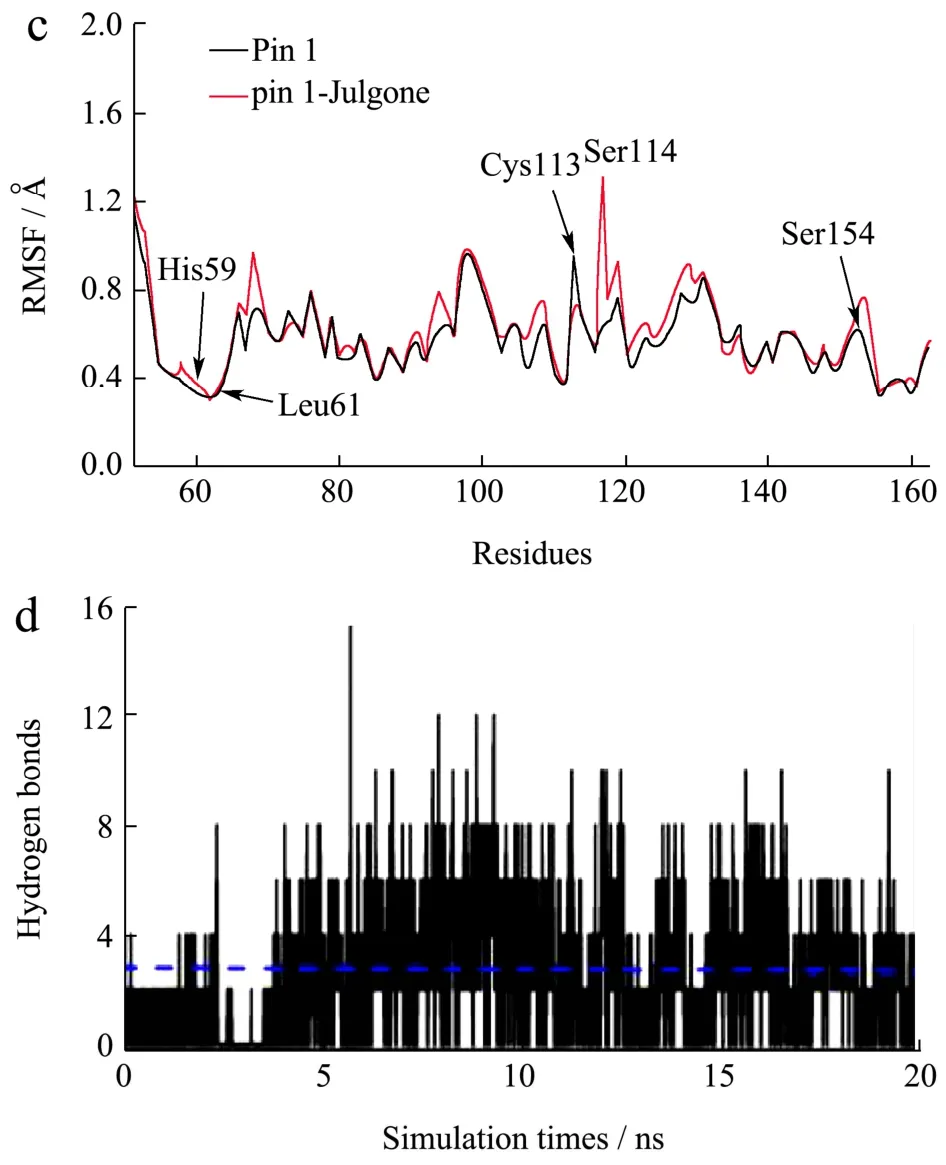
图6 胡桃醌对Pin1的分子动力学模拟Fig.6 Molecular dynamics simulation between juglone and Pin1
蛋白质回旋半径(Rg)能反映药物与蛋白结合的紧凑程度。如图6b,Pin1-胡桃醌体系的Rg值略微低于Pin1体系,表明胡桃醌结合到Pin1,促使其结构变得略紧凑。药物与蛋白结合关键作用力之一是氢键,分析氢键的变化能揭示结合的稳定性。如图6d,Pin1-胡桃醌体系的氢键在模拟时间内一直存在,且平均值为2.51,非常接近对接模型的结果,表明氢键是胡桃醌与Pin1的作用力之一。
使用MM/PBSA方法,预测了Pin1-胡桃醌和C113A-胡桃醌体系结合自由能。如表2所示,Pin1-胡桃醌和C113A-胡桃醌体系的结合自由能(ΔGbind)分别为-62.93和-14.54 kJ/mol,表明Cys113残基突变会显著性减少结合自由能。此外,Pin1-胡桃醌体系中的范德华能(ΔEvdw),电势能(ΔEele),极性溶剂能(ΔGpolar)和非极性溶剂能(ΔGnonpolar)分别为-78.36 kJ/mol,-1.05 kJ/mol,22.69 kJ/mol和-6.38 kJ/mol。表明胡桃醌结合到Pin1过程中,范德华力具有十分重要的作用。此外,Pin1-胡桃醌体系中的非极性自由能(ΔEvdw+ΔGnonpolar)和极性自由能(ΔEele+ΔGpolar)分别为-84.74和21.69 kJ/mol。表明胡桃醌结合到Pin1过程中,非极性自由能利于结合,而极性自由能不利于结合。
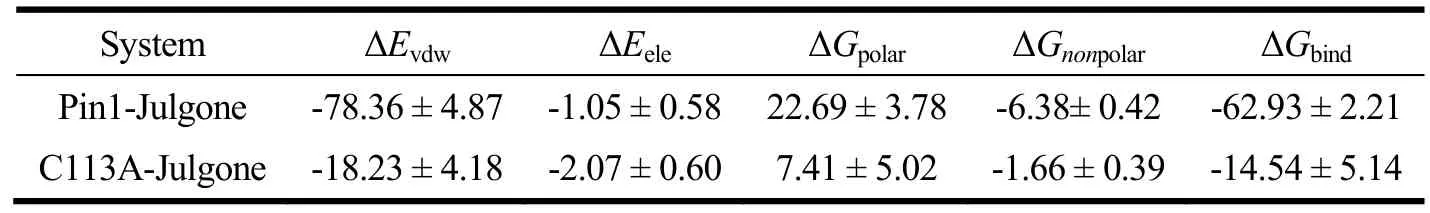
表2 MM/PBSA结合自由能分析(kJ/mol)Table 2 Analysis of binding energy using MM/PBSA method
3 结论
本文通过荧光光谱,圆二色谱,分子对接和分子动力学模拟等技术,研究胡桃醌与Pin1的相互作用。荧光光谱结果表明,胡桃醌对Pin1的荧光淬灭机制是典型的静态淬灭,两者形成Pin1-胡桃醌复合物。同步荧光光谱表明,胡桃醌结合到Pin1过程中淬灭了色氨酸和酪氨酸内源荧光,最大波长轻微红移,导致其构象改变。此外,圆二色谱结果表明,胡桃醌结合到Pin1中,导致α-螺旋含量降低。热力学参数,分子对接和分子动力学模拟结果表明,胡桃醌结合到 Pin1过程中,疏水作用力,氢键和范德华力是最要作用力。对接模型,突变体荧光滴定和分子动力学模拟结果揭示了胡桃醌主要作用于Cys113残基。本研究提供了Pin1与胡桃醌相互作用的一些数据,有助于进一步了解胡桃醌对Pin1抑制机理,为综合利用我国胡桃楸和核桃资源开发功能性食品、药品提供一定的科学依据。

