OGP(10-14)及其类似物G48A对大鼠成骨细胞增殖及cbfa1,IGF-1 mRNA表达的影响
李顺涛,马宇航,梅丽,丁晓颖,彭永德
1.安徽省阜阳市第九人民医院内分泌科,阜阳 236000;2.上海交通大学附属第一人民医院内分泌科
骨质疏松(OP)是一种多病因的疾病,发病机理复杂,目前尚无特效治疗手段。OP的防治药物主要有两大类,即骨转换抑制剂和骨形成刺激剂。骨转换抑制剂只能减少骨质重塑部位,不能很好地改善骨质量。然而,临床上可供选择的骨形成刺激剂的药物较少,效果有限,因而开发促进骨形成的新颖、高效、小分子抗OP活性肽是国内外关注的重要研究方向。骨代谢局部调节因子与其受体、结合蛋白和蛋白酶构成的网络是骨重建部位调节系统的核心[1-4]。活体骨通过成骨细胞的骨形成和破骨细胞的骨吸收持续不断地进行骨重建。在生理状况下,骨髓的成骨和破骨潜能限制在较低的水平。而在骨髓损伤或去除骨髓等病理状态下,伴随骨髓再生,局部及全身性成骨反应增强。因而推测,再生的骨髓可能释放了某种促成骨因子入血循环[5-6]。
Bab等[7]从大鼠胫骨再生骨髓中分离、纯化、鉴定了一种促成骨细胞增殖的生长因子,中文译名为成骨生长肽(OGP)。研究[8-9]发现,OGP羧基端5肽OGP(10-14)(H-Tyr-Gly-Phe-Gly-Gly-OH)具有和全长OGP相同的生物活性,视为OGP的生理活性形式,OGP(10-14)能够呈时间-剂量依赖模式,诱导丝裂原活化蛋白激酶(MAPK)活性,触发胞内级联瀑布式信号转导网络,MAPK家族在调节膜受体和基因表达谱变化之间的关系中发挥着关键作用,参与调节成骨细胞的增殖和间充质干细胞向成骨细胞系的分化[10]。通过受体后信号转导,MAPK磷酸化后被激活,转运至胞核,作用于特定转录因子,尚可调节胰岛素样生长因子(IGFs)的表达。IGFs是一种多功能细胞调控因子,与成骨细胞(OB)和破骨细胞(OC)功能的发挥密切相关。核心结合因子(cbfal)作为成骨细胞分化的特异性转录因子,调控OB发育过程中多个基因的表达,对成骨细胞分化、骨的发育和形成具有关键作用[11-13]。cbfa1可调节破骨细胞分化因子(ODF)mRNA的表达,与cbfa1-/-小鼠颅骨细胞共培养的破骨细胞数量和骨吸收能力均较cbfa1+/+,cbfa1+/-组显著降低,提示cbfa1在调节成骨细胞分化的同时也参与了破骨细胞形成和分化的调节。本组既往的动物研究[14-17]发现,OGP及其羧基端5肽OGP(10-14)通过调控成骨细胞和破骨细胞的增殖与分化,参与调节骨重建两种重要细胞功能偶联平衡。
本研究采用四唑盐(MTT)比色法、碱性磷酸酶(ALP)活性测定和逆转录-聚合酶链反应(RT-PCR)技术观察了OGP(10-14)(G36G)及其类似物G48A[OGP(10-14)分子内位点进行非天然化结构改造,加强对抗酶降解的能力]对OB增殖、分化和IGF-1、cbfa1转录水平的影响,以了解可能参与OGP信号调节网络的其他局部因子的表达情况,为进一步采用基因沉默或特异蛋白抑制剂等技术的研究提供线索。
1 材料与方法
1.1 材料 SD大鼠由上海斯莱克实验动物中心提供。Ⅰ型胶原酶、噻唑蓝、胰蛋白酶、α-MEM为联星实业有限公司产品。PTH(1-34)为Sigma公司产品。牛血清白蛋白(BSA)为Gibco公司产品。胎牛血清为Hyclone公司产品。DNTPs,Rnasin,Taq DNA聚合酶,M-MLV逆转录酶为Promega公司产品。Trizol试剂,Oligo(dT)12-18引物为Invitrogen公司产品。OGP(10-14)(G36G),G48A由中国医学科学院药物研究所王德心教授惠赠。5810R低温高速离心机为德国Eppendorf-Netheler-Hinz GmbH公司产品。PCR扩增仪PE9600为美国PERKIN ELMER公司产品。DH2000生命科学图像分析系统由中国计量科学研究院京华电计量新技术公司提供。Windows 1D Main凝胶图像分析系统由美国AAB公司提供。
1.2 方法
1.2.1 OB的培养和传代 取24 h内新生SD大鼠,无菌取头盖骨,置于α-MEM培养基中,剪成1 mm2大小的碎片。加入0.25%胰蛋白酶,电磁搅拌消化。将骨碎片移入0.1%Ⅰ型胶原酶溶液中,37 ℃搅拌消化3次,每次30 min。100目筛网过滤,将含细胞的消化液离心10 min,弃上清。用α-MEM培养液反复吹打细胞团块,细胞按2×104/mL密度接种于培养板或按2×105/mL密度接种于培养瓶中。待原代OB覆盖培养瓶底80%以上的面积时,加入消化液(0.25%胰蛋白酶与0.2%乙二胺四乙酸混合液),轻摇培养瓶,置瓶于培养箱中消化2~5 min,显微镜下观察,发现胞质回缩,胞体呈原球形,终止消化。培养传代,取3代OB进行试验。
1.2.2 OB的增殖、ALP测定 3代OB以4×103个/孔的密度接种于96孔板,OB同步化培养方案同前。将OB分为10组,更换含有不同处理因素的无血清培养基(含转铁蛋白100 μg/mL,辅胺100 μM,亚硝酸钠30 nM,胰岛素5 μg/mL,BSA 10 mg/mL):(1)G36G:4组培养液中G36G浓度分别为10-7M,10-9M,10-11M,10-13M;(2)G48A:4组培养液中G48A浓度分别为10-7M,10-9M,10-11M,10-13M;(3)甲状旁腺激素(PTH)间刺组:后6 h培养液中PTH浓度为10-8M;(4)CON组:培养液中含1%的BSA。MTT比色法:每6孔细胞作为一组,继续培养48 h后,每孔加入15 μL MTT(5 μg/mL),将培养板置于培养箱中孵育4 h。小心吸弃上清,加入50 μL二甲基亚砜(DMSO),震荡10 min,使结晶物充分溶解。以无细胞的空白孔调零,在酶标仪上(波长570 nm)读取各孔吸光度。ALP测定:每6孔细胞作为一组,继续培养48 h后,半自动生化分析仪检测细胞上清液ALP的水平,以紫外法测定培养液OD280值作为蛋白含量校正系数。
1.2.3 OB超微结构观察 3代OB以2×104个/mL的密度接种于250 mL培养瓶,OB同步化培养方案同前。将OB分为4瓶,更换含有不同处理因素的无血清培养基(含转铁蛋白100 μg/mL,辅胺100 μM,亚硝酸钠30 nM,胰岛素5 μg/mL,BSA 10 mg/mL):(1)G36G组:培养液中G36G浓度为10-11M;(2)G48A组:培养液中G48A浓度为10-13M;(3)PTH组:后6 h培养液中PTH浓度为10-8M;(4)CON组:培养液中含1%的BSA,继续培养48 h后,去除培养瓶中的细胞上清液,磷酸盐缓冲盐溶液(PBS)冲洗1次,加入0.125%胰蛋白酶37 ℃消化3 min,1 000 r/min离心10 min。在沉淀的细胞团块中加入2.5%的戊二醛固定60 min。PBS冲洗后,细胞沉淀团块经1%锇酸固定60 min。PBS漂洗3次。按下列顺序梯度脱水:50%丙酮1次、70%丙酮1次,90%丙酮2次,100%丙酮3次。EPON812树脂包埋,LKB-V超薄切片机切片,醋酸铀和枸橼酸铅双重染色,Philips EM400-ST型透射电镜观察,摄片。
1.2.4 OB总RNA的提取、逆转录和聚合酶链式反应(PCR)扩增 3代OB以2×104/mL密度接种于培养瓶中,在含10%胎牛血清(FBS)的完全培养基中培养46 h后,更换无血清培养基(含转铁蛋白100 μg/mL,辅胺100 μM,亚硝酸钠30 nM,胰岛素5 μg/mL,BSA 10 mg/mL)继续孵育24 h使细胞同步化在G0期。将OB分为4组:(1)G36G组:培养液中G36G浓度为10-11M;(2)G48A组:培养液中G48A浓度分别为10-13M;(3)PTH组:培养中PTH浓度为10-8M;(4)CON组:培养液中含1%BSA。每6孔细胞作为一组,继续培养48 h,提取RNA,将RNA溶解于0.1%焦碳酸二乙酯(DEPC)水中。取部分RNA溶液,测定A260,推算其浓度(A260值×40 μg/mL×稀释倍数);测定A260/A280比值,评价总RNA纯度;甲醛变性琼脂糖凝胶电泳在紫外灯下观察凝胶28S、18S、5S条带的亮度及位置,判断RNA的完整性。模板变性RNA,Oligo(dT)18,DEPC水70 ℃ 5 min,即刻冰浴;逆转录反应Rnasin,dNTP,M-MLV 42 ℃ 60 min;灭活逆转录酶活性70 ℃ 10 min。-20 ℃保存cDNA。
1.2.5 RT-PCR检测OB cbfa1和IGF-1 mRNA表达水平 (1)引物设计:Gene-Runner 3.04软件设计,北京奥科生物技术公司合成。IGF-1引物序列Sense 5’-TTACTTCAACAA GCCCACAG-3’,Antisense 5’-CCTCAAGCAGCAAAGGAT C- 3’,PCR产物长度310 bp。Cbfa1引物序列Sense 5’-CAAGGTTGTAGCCCTCGG AG-3’,Antisense 5’-AATGCGCCCTAAATCACTG-3’,PCR产物长度337 bp。β-actin引物序列Sense 5’-CTATCGGCAATGAGCGGTTC-3’,Antisense5’-CTTAGGAGT TGGGGG TGGCT-3’,PCR产物长度742 bp。(2)PCR分别扩增OB的cbfa1和IGF-1目的片段:Taq酶,CDNA,dNTP,引物等试剂在Eppendorf管中短暂混匀,PCR反应条件如下:95 ℃ 2 min,94 ℃ 30 s,58 ℃ 30 s,72℃ 45 s,72 ℃延伸5 min,取5 μL PCR产物,1.5%琼脂糖凝胶电泳,紫外灯下观察,凝胶图像采集。PCR产物送上海生工生物工程公司测序。
1.3 统计学处理 采用SPSS 17.0软件处理数据。正态分布变量,满足齐性行方差分析,组间比较采用LSD法;方差不齐时,行变量变换或用Dunnett’s T3法。非正态分布变量采用非参数检验。P<0.05为差异有统计学意义。
2 结果
2.1 成骨细胞的培养与鉴定 倒置显微镜下,刚接种的OB呈悬浮的亮球,1 d后多数呈梭形、多角形贴壁,培养3 d细胞增殖旺盛,培养5 d细胞半汇合,培养7 d细胞汇合呈铺路石状,培养9 d细胞重叠生长,培养14~16 d细胞结节形成,基质堆积,培养25 d矿盐沉积,矿化结节形成,ALP染色可见OB胞质内块状灰黑色沉淀。透射电镜下,OB具有典型的蛋白合成结构,含丰富的线粒体、粗面内质网及大量分泌小泡,高尔基器也较发达。G36G组、G48A组、PTH组细胞形状丰满,呈多边形,核膜清晰,部分粗面内质网扩张,高尔基器发育良好,胞浆内分泌颗粒增多。CON组无血清连续培养数天后,多数细胞死亡退变,胞体扁平,胞内部分细胞器丧失。
2.2 不同处理因素对大鼠OB增殖及ALP活性的影响 MTT比色法测定,G36G组在10-7~10-15M浓度范围内,OB细胞数随浓度而波动,10-11M为作用最强浓度;G48A组在10-7~10-15M浓度范围内,OB细胞数呈双峰变化,促进OB形成的最强浓度为10-13M;G36G组与G48A组达最大效应时的OB数目均高于PTH,CON组。G36G组的峰值效应与PTH组相似,高于G48A组的峰值效应;CON组OB增殖能力低于PTH组,G36G,G48A不同浓度组(P<0.05)。ALP活性测定:G36G与G48A不同浓度组,PTH组ALP活性均显著高于CON组(P<0.05)。G48A组在10-9~10-15M的浓度,促进OB ALP活性的效应渐增,其中在10-15M作用最强。G36G组在10-9~10-15M的浓度,促进OB ALP活性的效应呈钟形曲线,峰值浓度在10-13M(P<0.05)。
2.3 不同处理因素对大鼠OB cbfa1 mRNA、IGF-1 mRNA表达的影响 RNA提取纯度和完整性检测,各组细胞RNA提取OD260/OD280值均介于1.7~2.0之间,说明总RNA纯度较高,基本无蛋白质的污染。各组细胞总RNA甲醛变性琼脂糖凝胶电泳结果示,28S与18S电泳条带的吸光度比值为2.0左右,5S条带较弱,RNA的完整性较好,基本无降解(表1)。G36G、G48A、PTH组cbfa1 mRNA与IGF-1 mRNA均显著高于CON组(P<0.05,P<0.01,P<0.01),见表2。
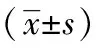
表1 不同处理因素组OB总RNA提取纯度一览表
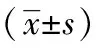
表2 RT-PCR检测不同处理因素对OB的cbfa1、IGF-1 mRNA表达水平的影响
3 讨论
骨质疏松的干预措施包括两大策略,抑制骨吸收与促进骨形成[18-19]。抑制骨吸收只能维持骨量,而促进骨形成可有效地提高和改善骨质量。OGP是近年在大鼠胫骨再生骨髓中发现的一种致有丝分裂的多肽类生长因子[20-21]。研究发现,在骨髓捐献者中,可观察到骨髓抽吸后,骨髓捐献者的血清骨形成生化标志物血清骨钙素(BGP)和ALP水平的上升,以上现象提示再生的骨髓可能产生了某种影响成骨的生长因子。OGP 羧基端5肽[OGP(10-14)]是OGP的生理活性形式,OGP 和OGP(10-14)在骨与骨髓相互关系中的作用已引起广泛关注[22-23]。OGP可以促进成骨细胞系MC3T3 E1、成纤维细胞系NIH3T3和骨髓基质细胞的增殖,调节ALP活性,促进基质矿化[24-25]。不同的细胞类型对OGP剂量依赖反应的浓度区间不同,可能与不同的OGP-OGP受体相互作用机制的差异有关[26]。OGP对成骨细胞系MC3T3 E1细胞达到最佳增殖效应的浓度(0.01~1 pM)较成纤维细胞系NIH3T3(1~100 pM)至少低两个数量级,说明成骨细胞系对OGP更为敏感。
研究报道,OGP刺激大鼠颅盖骨成骨细胞的增殖(峰值效应时OGP浓度为10-11M),促进其骨钙素的表达,胞内及培养液碱性磷酸酶活性上升。已往的体外试验研究表明,PTH能引起OB IGF-1 mRNA的变化,体内试验也已证实PTH间歇性注射能促进骨形成,由此设想,骨形成促进剂OGP是否在调节OB的增殖与分化中,具有与PTH相似的机制,也有IGF-1信号的参与[27-30]。
OSF2/CBFA1是cbfa1基因编码的转录激活因子,在骨形成中发挥重要的角色,称为成骨细胞特异性转录因子/核心结合因子a,属于RUNT结构域家族[31-32]。OSF2/CBFA1一级结构存在三个转录激活区、一个抑制区、一个短的核定位信号,和一个128氨基酸的高度保守区即Runt结构域,是与共同的DNA作用元件5’-PuACCPuCA-3’结合的区域。DNA这一固有的序列存在于细胞不同分化阶段多种表达基因的控制区中,如GM-CSF、IL-3、TGFβ1等细胞因子及其受体的基因,Ⅰ型胶原、骨桥蛋白、骨钙素、骨涎蛋白、骨保护素等成骨细胞特异表达基因的启动子中。有研究发现,OSF2/CBFA1在成年鼠骨组织和成骨细胞有表达,可作为年轻成骨细胞的标志,且表达高峰与鼠胚胎骨骼初期的钙化期相临近。鼠胚骨骼间充质细胞有OSF2/CBFA1的表达,具有成骨细胞系和成软骨细胞系分化的潜力,提示OSF2/CBFA1调控OB发育过程中多个基因的表达。未分化MC3T3E1瞬时转染cbfa1可观察到Ⅰ型胶原、骨钙素表达升高。有研究发现,成纤维细胞在BMP2和BMP7的作用下,在表达成骨细胞特异性基因之前,首先表达OSF2/CBFA1,提示OSF2/CBFA1在BMP诱导成骨细胞分化的级联效应中起到了信号传递的作用。
在本研究中观察了OGP(10-14)及其类似物G48A和PTH对OB 增殖、分化和IGF-1,cbfa1 mRNA表达的影响。参考不同浓度G36G与G48A对OB增殖功能和分化的促进作用,对每种处理因素选取一个浓度观察对OB IGF-1,cbfa1 mRNA表达的影响,结果表明G36G,G48A,PTH间歇刺激组cbfa1,IGF-1 mRNA水平均显著高于CON组,提示cbfa1与IGF-1这两种信息因子表达水平的上调可能与OGP(10-14)及其类似物对OB的生物学作用有关[33-34]。
在OB基因表达水平上,OGP(10-14)及其类似物G48A可在转录水平促进OB IGF-1、cbfa1 mRNA的表达,应用反义核酸技术,通过碱基互补配对与成骨细胞内Cbfa1 mRNA的结合,从而在转录水平特异性抑制Cbfa1的表达,或应用特异IGF-1蛋白抑制剂,阻断两者介导的信号传递以进一步研究cbfa1与IGF-1在OGP 信号转导中所起的作用,有助于了解OGP(10-14)生物活性的调控因素。近年体内外研究提示,OGP能够促进骨形成,加速骨折愈合,且副作用较小[35-37]。如果通过胃肠外途径给予OGP,合理地调控其成骨反应,使之得以被反复地触发,进而改善骨质量,降低远期骨折率,有望成为极具吸引力的抗骨质疏松新药。深入研究OGP(10-14)在骨代谢中的作用机理,可能为将来骨质疏松的防治提供新的研究方向和治疗策略。

