Ⅱ型5α还原酶在代谢综合征SD大鼠前列腺组织中的表达
徐从云,沈德赟,林垚,宣强
中国科学技术大学附属第一医院(安徽省立医院)泌尿外科,合肥 230001
良性前列腺增生症(BPH)作为泌尿系统常见疾病,是中老年男性尿路症状常见问题之一,并且随着年龄的增长发病率增加。有统计显示在超过50岁的男性中BPH发病率超过二分之一,在80岁以上的男性中可达到九成[1]。BPH发生后产生的症状包括排尿困难、泌尿道的感染、泌尿系统易发结石,重者甚至可引发梗阻性肾病、肾功能受损等严重并发症[2]。对于BPH的发生发展因素研究,发现其与雄激素水平以及机体代谢综合征(MetS)之间存在密切联系。文献[3]报道血清的睾酮量和前列腺体积呈负相关,即睾酮浓度越高,前列腺增生风险就会越低。与此同时,也有学者发现睾酮与2型糖尿病、代谢综合征及肥胖之间关系密切,血清当中总睾酮水平越低,患者出现糖尿病风险就会越高,研究表明拥有较低血清睾酮水平的男性罹患糖尿病的风险是拥有正常睾酮水平男性的两倍之多,并且超过一半糖尿病男性睾酮缺乏[4]。睾酮水平低,罹患MetS的风险也会增加。MetS的致病因素包括肥胖、高血压、血脂异常升高、糖尿病等。此外,血清睾酮水平低的患者往往伴有高水平的血清总胆固醇和三酰甘油。也有研究发现MetS患者在接受睾酮替代疗法后,血清总胆固醇水平显著降低[5]。体内内源性的睾酮绝大部分会在5α还原酶 (SRD5A)的作用下而形成双氢睾酮(DHT),研究提示DHT对雄激素受体的亲和力及其生物学活性高于睾酮。
本研究通过高脂高糖饮食诱导SD大鼠发生代谢综合征,并采用去势处理,予以SD大鼠皮下注射睾酮,建立大鼠前列腺增生模型,观察代谢综合征和睾酮水平对SD大鼠前列腺增生的影响,并探讨SRD5A2与SD大鼠前列腺增生的发生发展之间的关系,寻找BPH防治的新思路。
1 材料与方法
1.1 实验动物及分组 健康SPF级SD雄性大鼠64只,购入时4周龄,每只初始体质量约70g,随机分为普通饮食饲养组和高脂高糖饮食饲养组,各32只。普通饲料为标准棒状饲料,高脂高糖饮食饲料在普通饮食饲料的基础之上额外加入高脂的猪油、全脂奶粉,高糖的白砂糖、土豆淀粉和鸡蛋(添加比例分别为10%、10%、7%、2%、6%)。
1.2 手术和药物干预 所有大鼠在术前3 d开始予以适应性喂养,术日采用腹腔注射方式麻醉后(10%水合氯醛,3 mL/kg),普通饲养组分为4组,记为1、2、3、4组,高脂高糖饲养组分为5、6、7、8组。各组均为8只。两组大鼠分别于无菌原则下进行手术操作,手术操作具体分组为:第1、5组为假手术处理组,仅行皮肤切开缝合,第2、3、4、6、7、8组行双侧睾丸切除术。普通饲养组和高脂高糖饮食饲养组的第1、2,5、6组术后分别每天予以皮下注射0.9%氯化钠注射溶液(1 mL),第3、7组行双侧睾丸切除术去势后每天予以皮下注射丙酸睾酮(2 mg/kg)、第4、8组行双侧睾丸切除术去势后每天予以皮下注射丙酸睾酮(5 mg/kg),实验结束前1 d停止注射。40 d后处死实验大鼠,取获前列腺组织,称重并计算各组大鼠的前列腺指数。
1.3 主要试剂 实时定量PCR所使用Trizol试剂盒购自Invitrogen,USA;第一链cDNA合成试剂盒购自ThermoFisher,USA;荧光试剂盒购自TaKaRa,JAPAN;SRD5A2特异性抗体购自abcam,USA;伊红染色剂、免疫组织化学染色所使用试剂盒购自中杉金桥生物公司。
1.4 免疫组织化学 采用甲醛固定前列腺组织,然后依次进行脱水、浸蜡、石蜡包埋处理后切片,用苏木精-伊红染色。切片标本使用脱蜡、水化、抗原修复、封闭后,加一抗液4 ℃过夜,二抗室温1 h;DAB显色、苏木精复染;脱水、透明、封片处理。
1.5 实时定量PCR 前列腺组织剪碎、研磨后利用Trizol抽提、纯化组织总RNA;逆转录成cDNA模板;检测SRD5A2表达水平,所使用SRD5A2引物(F:GTGCGGTTTAGCTTTGGTGTC,R:ATCTCGCCCAGGAAATTGGC)、GADPH引物(F:CGGAGTCAACGGATTTGGTCGTAT,R:AGCCTTCTCCATGGTGGTGAAGAC)采用2-△△CT法计算mRNA的相对表达倍数。
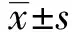
2 结果
2.1 各组大鼠前列腺大小 发现高脂高糖饮食饲养组大鼠(5、6、7、8组)体质量高于普通饲养组(1、2、3、4组),差异有统计学意义(P<0.05)。同时伴随高脂高糖饮食饲养组大鼠体质量的增加,其前列腺质量、前列腺指数评分也随之升高(1组比5组),而在去势大鼠组前列腺重量和前列腺指数差异无统计学意义(2组比6组)。给予皮下注射睾酮(2 mg/kg),解除去势状态,前列腺重量、前列腺指数较前升高(3组与7组比2组与6组)。增加睾酮注射量(5 mg/kg)后,大鼠的前列腺重量及前列腺指数表现下降趋势(4组与8组比3组与7组),见图1。
注:1组为普通饲养-假手术处理;2组为普通饲养-去势;3组为普通饲养-去势-注射低剂量睾酮;4组为普通饲养-去势-注射高剂量睾酮;5组为高脂高糖饲养-假手术处理;6组为高脂高糖饲养-去势;7组为高脂高糖饲养-去势-注射低剂量睾酮;8组为高脂高糖饲养-去势-注射高剂量睾酮。
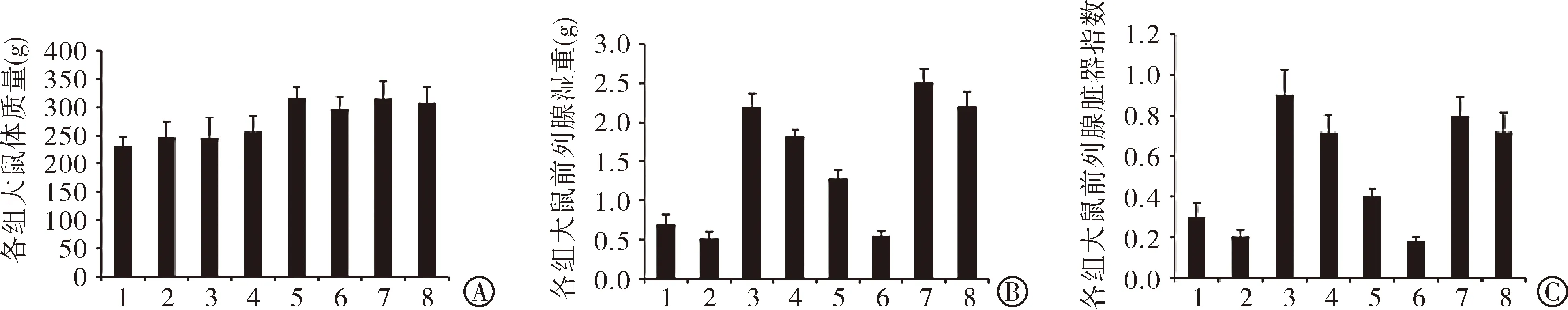
注:1组为普通饲养-假手术处理;2组为普通饲养-去势;3组为普通饲养-去势-注射低剂量睾酮;4组为普通饲养-去势-注射高剂量睾酮;5组为高脂高糖饲养-假手术处理;6组为高脂高糖饲养-去势;7组为高脂高糖饲养-去势-注射低剂量睾酮;8组为高脂高糖饲养-去势-注射高剂量睾酮。
2.2 前列腺组织内SRD5A2 mRNA表达量 发现高脂高糖饮食饲养组大鼠前列腺组织的SRDA2表达量显著增加(1组比5组)。去势大鼠前列腺组织SRD5A2的表达水平差异无统计学意义(2组比6组)。给予皮下注射适量睾酮后,扭转去势效应,前列腺内SRD5A2的表达水平较前升高(3组与7组比2组与6组)。予以增加睾酮的注射量,前列腺重量及前列腺指数呈下降趋势(4组与8组比3组与7组)。SRD5A2在大鼠前列腺中的表达与前列腺的增生程度呈正的关联关系,见图2。
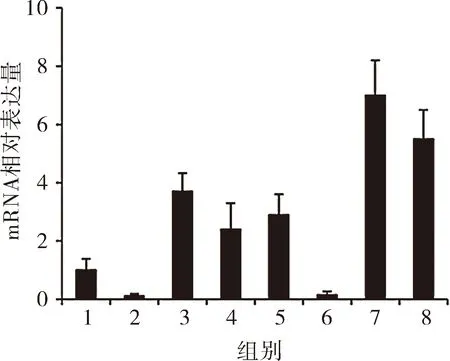
2.3 前列腺组织HE染色 普通饲养大鼠,假手术处理组前列腺腺体组织未见明显增生,腺上皮呈单层柱状或立方样改变,管腔无明显的扩大,腺体内的分泌物在HE染色下表现粉红色样变。普通饲养组大鼠去势后前列腺腺体无增生,管腔未见扩大。普通饲养组大鼠去势后注射低剂量睾酮,发现前列腺腺体的体积明显增大,腺体层次增多,呈乳头样增生,接近腺腔短径1/3至1/2,腺体内管腔增大,排列拥挤,间质变薄,腺体小叶增多,分泌功能亢进。普通饲养去势后注射高剂量睾酮后大鼠前列腺腺体前列腺增生,见单层柱状上皮改变,可见乳头状增生,管腔增大,分泌旺盛。高脂高糖饲养组下前列腺腺体增生更加活跃。其中高脂高糖饲养去势注射低剂量睾酮后出现腺体“搭桥”现象。见图3。
图3 各组处理大鼠前列腺组织结构(HE染色):A为普通饲养-假手术处理;B为普通饲养-去势;C为普通饲养-去势-注射低剂量睾酮;D为普通饲养-去势-注射高剂量睾酮;E为高脂高糖饲养-假手术处理;F为高脂高糖饲养-去势;G为高脂高糖饲养-去势-注射低剂量睾酮;H为高脂高糖饲养-去势-注射高剂量睾酮
2.4 免疫组织化学染色检测SRD5A2的表达 SRD5A2在正常前列腺组织和增生的前列腺组织内均可表达,且SRD5A2主要表达在前列腺腺上皮,在腺体的基底细胞、间质细胞SRD5A2表达较少。SRD5A2在增生前列腺中较正常组织高表达,且分布不均匀,而SRD5A2在增生性前列腺结节内的表达要高于周围组织。见图4。
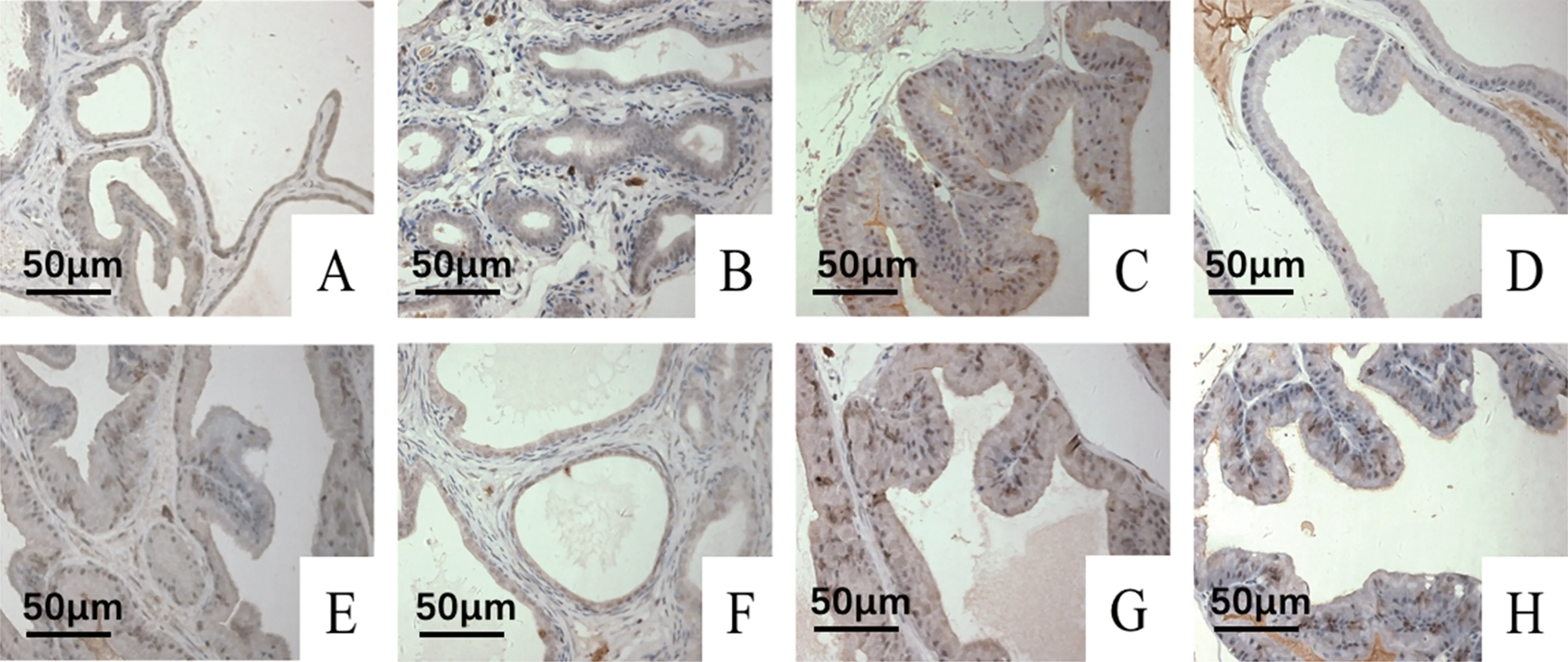
图4 各组大鼠前列腺免疫组织化学染色所示SRD5A2表达情况:A为普通饲养-假手术处理;B为普通饲养-去势;C为普通饲养-去势-注射低剂量睾酮;D为普通饲养-去势-注射高剂量睾酮;E为高脂高糖饲养-假手术处理;F为高脂高糖饲养-去势;G为高脂高糖饲养-去势-注射低剂量睾酮;H为高脂高糖饲养-去势-注射高剂量睾酮
3 讨论
随着人口老龄化的进展,我国日益成为人口老龄化负担较重的国家。同时饮食结构发生改变,各种营养代谢性疾病逐渐高发。研究[6]发现MetS和前列腺增生之间存在密切的相关性。高脂高糖饮食所致的MetS,引起胰岛素抵抗,进而促进前列腺增生的发生发展。有学者[7]发现血清胰岛素水平与患者前列腺的体积大小具有明显的相关性,血清胰岛素水平是BPH进展的独立危险因素。本研究通过高脂高糖饮食诱导SD大鼠发生MetS,并且观察到实验组大鼠的前列腺体积增大,腺体层次增多,分泌亢进等表现。
BPH的发病与体内多种激素水平相关。雄激素已被证实是影响前列腺生长的关键激素。正常生理状态下体内雌/雄激素水平处于平衡状态,共同调节前列腺细胞的生长,当雌激素增加或雄激素减少都会导致雌/雄激素比例增高,前列腺上皮细胞的增殖和凋亡的平衡被打破后,前列腺表现腺体增生。
BPH的发病率随年龄的增长而上升,但是年龄的增长会导致雄激素水平的下降,所以作为雄激素拮抗剂的雌激素可能在预防BPH中发挥着关键作用[8]。本研究结果提示,低剂量外源性睾酮的补充可以诱发去势SD大鼠前列腺增生,进一步提高外源性睾酮剂量观察到去势大鼠前列腺增生程度有所减轻,有研究发现补充外源性睾酮,能使机体内雌/雄激素保持平衡,预防前列腺增生[9]。基于以上机制,通过改变体内雌/雄激素的比例,人们已经成功地在小鼠、大鼠、狗等动物模型上成功诱导了前列腺增生的发生。
SRD5A是一种膜结合酶,胞内定位于细胞的微粒体。SRD5A有三种亚型-SRD5A1、SRD5A2和SRD5A3。同工酶SRD5A1/2在前列腺疾病中发挥重要的作用,对SRD5A3的研究较少,可能在蛋白质糖基化中发挥重要作用[10]。本研究所建立的前列腺增生模型中SRD5A2高表达。在高睾酮情况下,SRD5A2表达较低睾酮组减弱,SRD5A2在前列腺组织的表达和前列腺增生程度正相关,猜想前列腺增生的发生可能与高脂高糖饮食通过直接作用于前列腺细胞以及改变SRD5A2表达及活性有关,因此提示可以将SRD5A2作为前列腺增生早期诊断指标。
本研究显示高脂高糖饮食所诱发的MetS,可以引起前列腺增生。外源性睾酮在引起前列腺增生的同时导致前列腺组织SRD5A2的表达水平显著升高。临床上SRD5A2特异性抑制剂、SRD5A1/2的双重抑制剂-保列治,目前广泛用于治疗BPH。根据本研究结果,猜想在男性患者中雄激素的增高可能引起SRD5A高表达导致促进BHP的进程,所以推测MetS引起胰岛素抵抗可导致前列腺组织中SRD5A高表达。有研究发现在2型糖尿病大鼠中,胰岛素抵抗可引起血浆高胰岛素血症,进而通过提高前列腺组织中SRD5A2的活性,引起局部DHT含量增高,进而促进BPH的发生和进展[11],佐证胰岛素抵抗可能为连接高脂高糖饮食同BPH和MetS两种疾病重要病因学纽带。目前已有报道胰岛素增敏剂可改善MetS以治疗雄激素过剩而引起的多囊卵巢综合征[12]。据此下一步可用胰岛素增敏剂,或胰岛素增敏剂联合SRD5A抑制剂,在连接BPH和MetS两者的病因入手,通过早期改善胰岛素抵抗,提出一个防治BPH的新方向。
本研究认为高脂高糖饮食所诱发的MetS,可能通过胰岛素抵抗引起高胰岛素血症,上调前列腺组织SRD5A2的表达,使得前列腺局部DHT含量增高,引起BPH。

