抑制Yes-相关蛋白表达促进芬太尼诱导乳腺癌细胞凋亡的研究
侯海涛,尚翠霞,邓景元,崔延超,赵昭,陆鹏,沈剑南,马姣,姚力
西安交通大学第一附属医院,a 康复医学科,b 胸外科,西安 710061
尽管近十年来乳腺癌的治疗取得了巨大进步,但仍有许多晚期乳腺癌患者遭受着癌痛带来的身体、精神-社会相关的痛苦[1]。因此,镇痛治疗已成为乳腺癌治疗的一个重要组成部分[2]。芬太尼为人工合成的μ受体激动阿片类强镇痛药物,广泛应用于癌症围手术期止痛或缓解晚期癌痛或放化疗引起的疼痛[3]。越来越多的证据表明芬太尼对癌症患者的长期预后有潜在的影响。然而,关于阿片类药物对乳腺癌复发和转移的影响存在争议[4]。这可能是因为在不同乳腺癌亚型中,芬太尼能选择性地促进或抑制各异的基因/蛋白表达,从而影响乳腺癌进展。因此,针对不同机制进行更有针对性的研究,对于阐明芬太尼在乳腺癌发生发展过程中的具体作用十分必要,从而为乳腺癌的预防和治疗提供相关证据。
Yes-相关蛋白(YAP)作为一种转录共激活因子,其过表达或激活多被认为是促进乳腺癌生长、血管生成和转移的致癌因子[5],但也有研究表明YAP1可以通过促进凋亡、调节免疫而发挥抑瘤作用[6]。YAP的表达与乳腺癌分子亚型、肿瘤细胞成分及所处微环境相关。所以针对Hippo信号通路相关的靶向药物治疗现已成为乳腺癌治疗的研究热点[7]。YAP的激活主要通过Hippo信号通路、机械应力、G蛋白偶联受体(GPCR)信号通路、蛋白质相互作用以及转录后修饰等途径调控[8]。最重要的是,最近在乳腺细胞系中发现了YAP信号通路的胞外调节因子,如溶血磷脂酸(LPA)、鞘氨醇-1-磷酸(S1P)、雌激素和儿茶酚胺。这些细胞外调节因子作为配体,通过结合不同的GPCR,激活或者抑制YAP/TAZ表达[9-11]。有趣的是芬太尼激活的μ受体也是一种GPCR,其能否调控YAP信号通路从而影响乳腺癌的生长?
本研究将通过研究芬太尼在乳腺癌细胞系中对YAP的调控作用及作用机制,讨论不同YAP表达下芬太尼对乳腺癌发展的影响。
1 实验方法
1.1 细胞系及细胞培养 人乳腺癌细胞MCF-7购于中国科学院典型培养物保藏委员会细胞库。细胞培养基成分为:RPMI 1640培养基、10%胎牛血清(FBS,Thermo Fisher,中国,上海)、0.3 g/L谷氨酰胺和100 IU /mL青霉素和100 μg/L链霉素的 (Invitrogen,MA,USA)。培养箱条件为37 °C,一氧化碳(CO)浓度为5%。对照shRNA及YAP下调shRNA由上海吉凯基因医学科技股份有限公司构建,转染过程按照厂家指导进行。使用芬太尼(2.0 μg/L)干预细胞时,对细胞进行去血清培养16 h。小分子MOR抑制剂cyprodime hydrochloride及Gi蛋白抑制剂Pertussis toxin均购于R&D公司,对MCF-7细胞进行预处理浓度及时间分别为10 nM作用2 h和100 μg/L作用16 h。
1.2 细胞增殖试验(MTT) 将MCF-7细胞接种于密度为2×103/孔的96孔板中24 h,然后用芬太尼处理或作为对照。孵育72 h后,每孔取20 μL MTT溶液(5 mg/mL),再孵育4 h,弃去培养基,将甲瓒沉淀溶解于DMSO中。使用微滴度平板阅读器测定在570 nm和630 nm(背景)吸光度。细胞活力表示为活细胞相对于对照的百分比。所有的实验均重复3遍。IC50由每个细胞系的剂量-反应曲线产生。
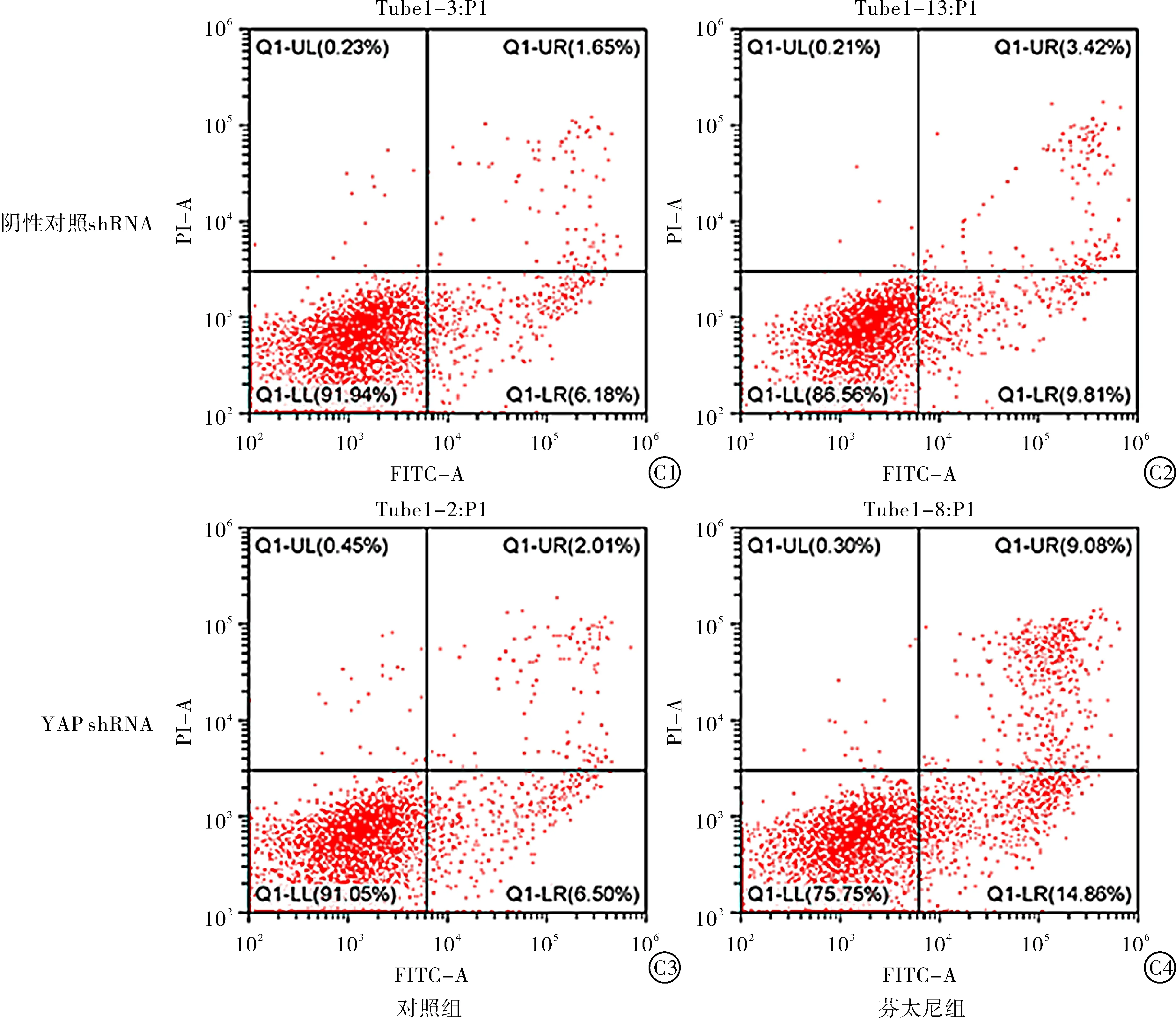
1.3 细胞流式实验 Annexin V-FITC和碘化丙啶(PI)试剂盒(Roshe Applied Science,Germany)检测细胞凋亡。将3×105个细胞接种于6孔板中,用shRNA处理6 h。用accutase酶消化细胞,用冰冷PBS洗涤2次,然后在HEPES缓冲液中重悬细胞,并同时加入标记有annexin v-荧光素和PI的抗体。避光孵育后,流式细胞仪(BD Biosciences)分析细胞凋亡率。
1.4 Western Blot 用RIPA buffer (Beyotime,China)提取GBM细胞总蛋白。采用BCA蛋白测定试剂盒(中国Beyotime公司)测定蛋白浓度。然后用SDS-聚丙烯酰胺凝胶电泳分离蛋白,转到PVDF膜(Millipore,USA)上。用5%脱脂牛奶封闭PVDF膜。然后将一抗phospho-YAP、YAP、pMST1/2、MST1/2、pLATS1、LATS1、Survivin和Bcl2(均购于Santa Cruz)在4 ℃孵育过夜;二抗(1∶10 000稀释)室温孵育1 h后TBST洗3次后显影。采用ECL化学发光试剂盒和Quantitative-one软件检测分析蛋白表达水平。
1.5 体外成瘤实验 雌性裸鼠(Balb/c-nu/nu)来自西安交通大学动物中心。小鼠(4~6周)饲养于无菌级实验动物房。40只小鼠成长至8周后分为2组,每组20只,分别接种YAP正常表达及YAP敲除MCF-7细胞: 5×106个细胞加入生长因子降低的Matrigel (Becton、Dickinson和Company)以1∶1(v∶v)比例悬浮,皮下注射至右侧。植入7 d后,将上述两组小鼠再随机分为0.9%氯化钠注射溶液治疗组和芬太尼治疗组(每24 h皮下注射0.02 mg/kg) (n=10),第40天颈椎脱位处死。剥除植入肿瘤并测量。肿瘤体积按公式计算:体积=长×宽2/2。所有动物实验均通过西安交通大学伦理评审委员会批准。
1.6 免疫组织化学 切除荷瘤小鼠皮下肿瘤,石蜡包埋,4 μm连续切片,在二甲苯中脱蜡,在浓度梯度酒精中水化。PBS洗涤载玻片,3% H2O2室温孵育10 min,阻断内源性过氧化物酶活性。用山羊血清在室温下孵育30 min,阻断非特异性结合,然后在4 ℃湿盒中孵育一抗过夜。用PBS洗涤后,在室温下孵育生物素化二抗15 min。然后链霉亲和素-过氧化物酶复合物孵育,用DAB试剂盒显影。显微镜下观察并拍照。
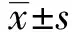
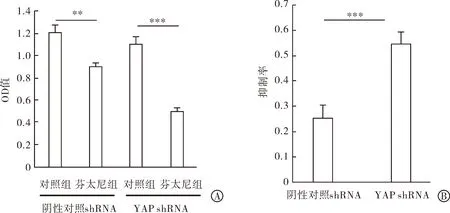
注:**P<0.01,***P<0.001;YAP为Yes-相关蛋白。
2 结果
2.1 下调YAP可促进芬太尼诱导的乳腺癌细胞凋亡 首先,本组研究了芬太尼在乳腺癌MCF-7细胞增殖中的作用。如图1A所示,MTT检测结果显示无论在YAP正常表达组还是YAP低表达组,芬太尼干预后细胞的OD值均显著降低(P<0.01,P<0.001),提示芬太尼可以抑制MCF-7细胞的增殖能力。计算抑制率后本组发现,芬太尼对YAP shRNA组细胞具有更高的抑制率(图1B,P<0.001)。细胞增殖能力的降低主要是由于细胞凋亡的作用增强。因此,本研究进一步检测了芬太尼对正常YAP表达及YAP低表达MCF-7细胞的凋亡作用,如图1C所示,流式细胞结果证实,芬太尼可以促进MCF-7细胞的凋亡,当YAP表达受抑制后,这种促进凋亡的作用显著增强(表1,图1C,P<0.01)。
表1 流式细胞检测芬太尼对不同YAP表达MCF-7细胞凋亡率的影响
2.2 芬太尼促进乳腺癌细胞中YAP去磷酸化 YAP蛋白的活化主要表现为其丝氨酸127位(Serine 127)残基的去磷酸化(dephosphorylation)。因此,本研究检测了芬太尼是否影响MCF-7细胞中YAP的表达或磷酸化。如图2A所示,芬太尼显著抑制了磷酸化YAP的表达(t=4.769,P=0.041 3)。既往研究显示,非磷酸化的YAP只有进入细胞核内才能作为共转录激活因子参与调节细胞的增殖。因此,本研究进一步检测了细胞核中YAP的表达,结果显示芬太尼显著提高乳腺癌细胞核中YAP蛋白的表达(图2B,t=48.66,P=0.000 4)。
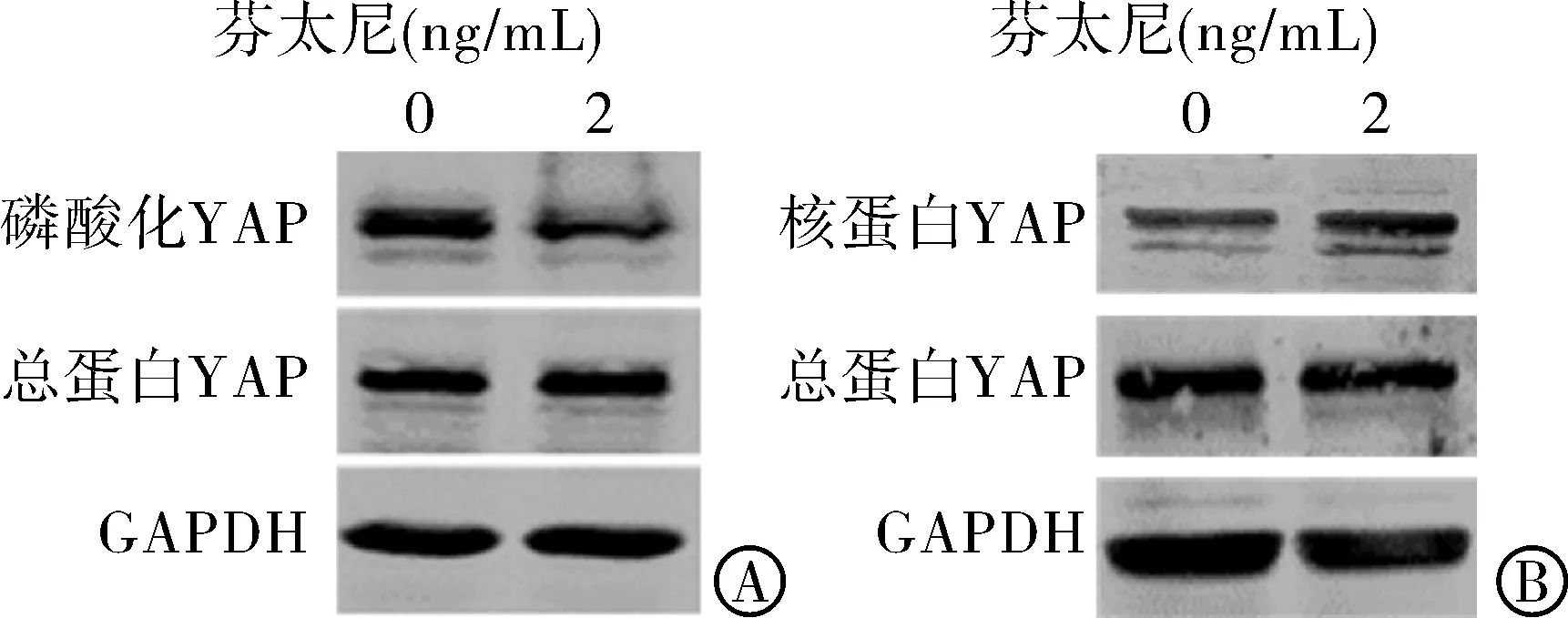
注:YAP为Yes-相关蛋白。
2.3 MOR-Gi通路介导芬太尼诱导YAP去磷酸化 由于芬太尼是μ阿片受体(MOR)的强激动剂,本研究验证了MOR是否参与芬太尼诱导的YAP去磷酸化。采用选择性MOR抑制剂cyprodime hydrochloride对MCF-7细胞进行预处理。cyprodime hydrochloride可以显著消除芬太尼诱导的YAP去磷酸化 (图3A,表2)。此外,Gi蛋白抑制剂Pertussis toxin(PTX)也可以抑制芬太尼诱导的YAP去磷酸化(图3B,表3)。
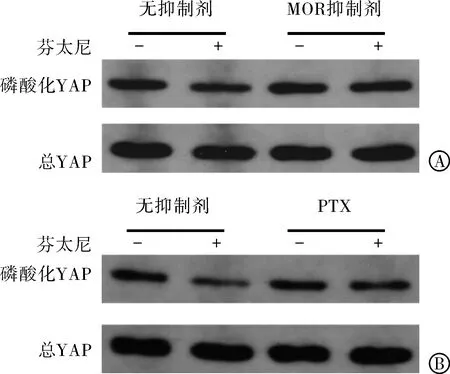
注:YAP为Yes-相关蛋白;MOR为μ阿片受体。
表2 MOR受抑制后芬太尼对磷酸化YAP的表达影响减少
表3 Gi蛋白受抑制后芬太尼对磷酸化YAP的表达影响减少
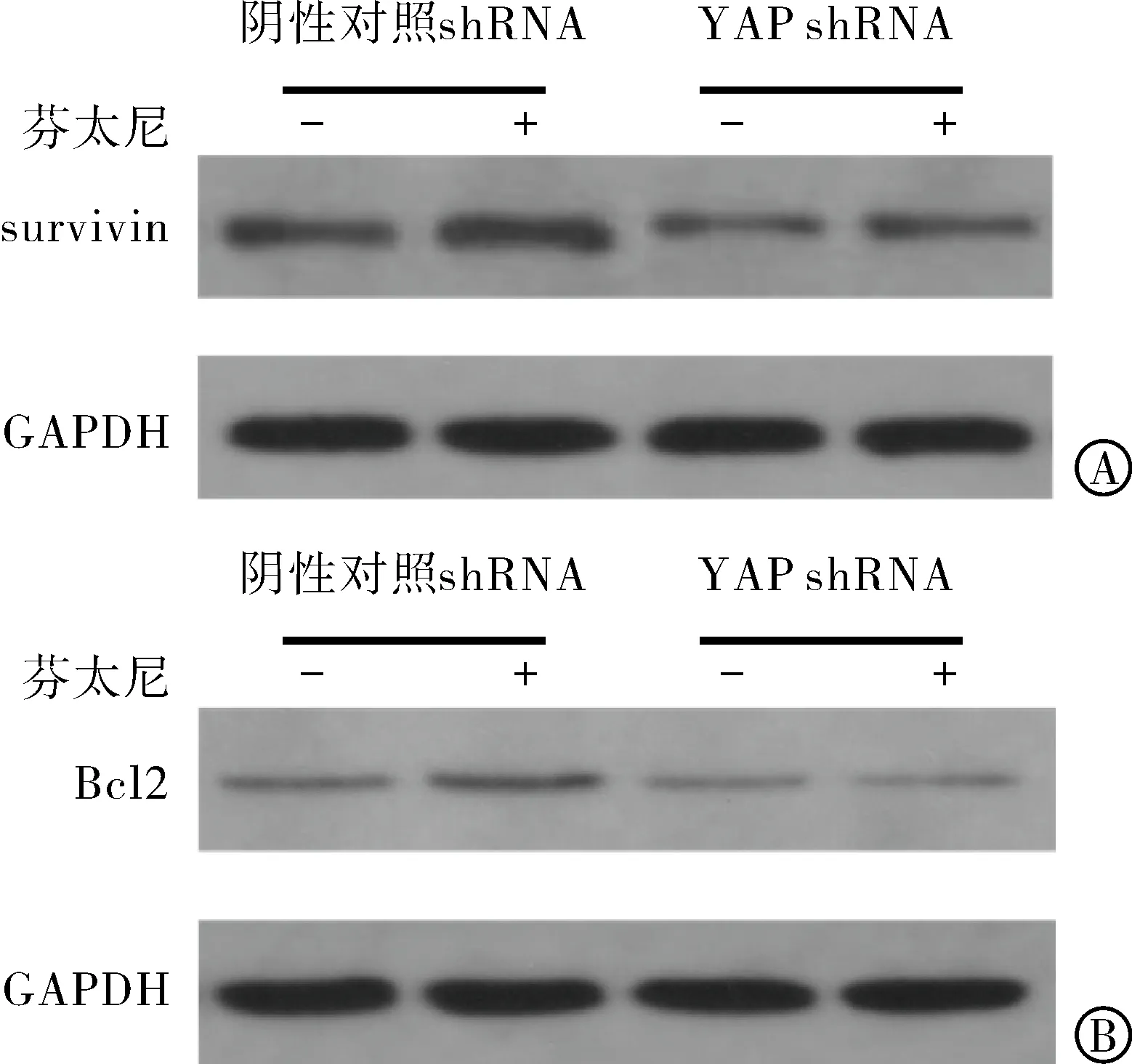
2.4 芬太尼诱导YAP下游因子Survivin及BCL2表达 活化的YAP可以促进抗凋亡基因 (如Survivin,BCL2) 转录,抗凋亡基因高表达与成瘤性相关[12],所以我们进一步测试了芬太尼与Survivin和Bcl2表达的关系。如图4所示,芬太尼显著增加了MCF-7细胞中Bcl2 和survivin的蛋白表达(图4)。同时,当在MCF-7细胞中敲除YAP后,消除了芬太尼诱导的Bcl2和survivin高表达(图4,表4,表5)。
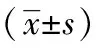
表4 YAP受抑制后芬太尼对其下游蛋白survivin的表达影响减少
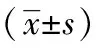
表5 YAP受抑制后芬太尼对其下游蛋白Bcl2的表达影响减少
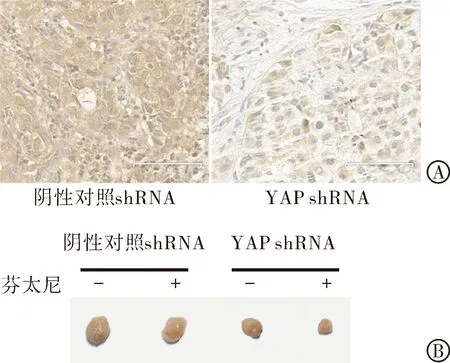
2.5 体内研究下调YAP对芬太尼抑制乳腺癌生长的影响 为了研究YAP和芬太尼对肿瘤生长在体内的作用,我们使用未敲除YAP的MCF-7细胞作为对照组细胞,YAP敲除MCF-7细胞作为实验组,在BALB/cnu/nu裸小鼠体内皮下成瘤。本研究通过免疫组织化学试验,验证肿瘤中YAP的表达(图5A)。
注:YAP为Yes-相关蛋白。
注:YAP为Yes-相关蛋白。
与体外实验结果一致,图5B所示,在YAP敲除组中,芬太尼可显著降低的肿瘤体积[(405±123)mm3比(251±96)mm3,t=6.622,P=0.022],而在对照组细胞中,芬太尼对乳腺肿瘤的生长影响较小[(589±102)mm3比(501±81)mm3,t=0.911,P=0.458]。
3 讨论
癌症镇痛为癌症治疗重要组成部分,而研究表明,麻醉及围手术期镇痛干预可能影响乳腺癌细胞行为并与肿瘤复发相关[2]。
芬太尼家族为鸦片类受体合成镇痛剂,现已越来越被广泛应用于晚期乳腺癌患者的镇痛[13]。但芬太尼对乳腺癌的转移及侵袭作用仍存在争议,比如有研究发现芬太尼可以通过Wnt信号通路介导的α1.6-岩藻糖基化,促进MCF-7和MDA-MB-231干性及EMT,从而促进肿瘤形成[14-15]。而赵海燕等[16]研究发现芬太尼可以抑制MCF-7的转移及侵袭,同时有研究认为芬太尼可以抑制NK细胞等免疫功能,影响肿瘤周围免疫微环境,从而促进肿瘤的生长及转移[17]。也有研究表明鸦片类药物使用与乳腺癌复发并无临床相关性[18],因此阐明芬太尼是否促进乳腺癌的发生、发展及其机制,对临床乳腺癌患者能否应用芬太尼止痛具有十分重要的意义。
本研究发现,镇痛浓度的芬太尼(2.0 μg/L)在体外能促进乳腺癌MCF-7细胞的凋亡,从而有效抑制乳腺细胞增殖。在探讨其机制时,本组发现,当MCF-7细胞中YAP的表达抑制后,芬太尼显示出了更强的抑制作用。YAP是一种共转录激活因子,其信号活化可以通过稳定细胞骨架、促进细胞黏附、血管生成、促进EMT,提高乳腺癌干细胞的干性等各个方面促进乳腺癌转移[19]。因此,本研究这一发现提示,在特定条件下,芬太尼作用于乳腺癌细胞时有可能出现不同的生物学表现。比如,当乳腺癌细胞中YAP高表达时,芬太尼可能激活YAP,从而促进乳腺癌细胞增殖的作用。
YAP的激活主要通过Hippo信号通路、机械应力、G蛋白偶联受体(GPCR)信号通路、蛋白质相互作用以及转录后修饰等途径调控[8]。当YAP被磷酸化后可被进一步降解,是去其活性。只有去磷酸化的YAP可以进入核内,结合TEAD并活化下游靶基因转录,调控细胞凋亡、细胞增殖等作用,调节器官大小、参与肿瘤形成[7]。现研究不断发现,YAP的激活受到多种细胞外分子的调控,包括LPA、葡糖糖、胰高血糖素、肾上腺素、S1P、凝血酶、雌激素等[20]。本研究发现,芬太尼也可以调控YAP的活化,其调控机制为GPCR信号通路,即芬太尼-MOR-Gi-YAP信号通路。本研究再次丰富了YAP调控的细胞外信号分子。
相同的信号通路可以根据细胞形态、所处位置及周围微环境不同发挥多种调控作用[20]。本研究发现芬太尼抑制了乳腺癌的增殖并促进乳腺癌细胞的凋亡,但在机制研究中,芬太尼可以通过使YAP去磷酸化而活化YAP,促进其下游抗凋亡蛋白Survivin和BCL2的表达,从而具有促进成瘤作用。但当敲除YAP后这种促进成瘤作用消失,说明只有在特定条件下(如YAP高表达),芬太尼才具有潜在的促进乳腺癌成瘤的作用。此外,也有研究显示,阿片类药物可以通过AKT-NFκB信号通路抑制乳腺癌干细胞性和EMT从而抑制肿瘤生长[21],同时也有实验发现芬太尼可抑制乳腺癌形成[22],这些结果表明,芬太尼通过不同信号通路在乳腺癌中发挥不同的作用,而本研究进一步证实抑制YAP后可促进芬太尼诱导的乳腺癌细胞凋亡,为芬太尼在乳腺癌镇痛治疗中的应用提供坚实的理论基础。

