IL-1β、IL-6、TNF-α 在慢性HBV 感染不同临床病程中的临床意义
李彩东, 张旭强, 雷志萍, 陈俏丽, 陈 璐, 田鹏飞, 段正军
(1.兰州市第二人民医院肝病研究所,甘肃 兰州 730046;2.甘肃省科学技术情报研究所,甘肃 兰州 730000)
细胞因子对乙型肝炎的作用很复杂,辅助性T细胞(helper T cell,Th)是分泌细胞因子的主要细胞,可分为Th1亚群和Th2亚群,在调节免疫反应中起重要作用。急性乙型肝炎病毒(hepatitis B virus,HBV)感染中Th1类细胞因子主要介导细胞免疫,慢性HBV感染则由Th2类细胞因子介导体液免疫,Th1/Th2失衡可能是HBV感染慢性化的机制之一[1]。关于HBV患者Th1、Th2细胞因子的研究是目前HBV发病机制研究的热点。白细胞介素(interleukin,IL)1主要由单核巨噬细胞和T淋巴细胞产生,在调节免疫炎症反应中有重要价值。IL-6可通过抑制巨噬细胞产生IL-1和肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)来保护细胞,从而发挥抗炎作用,是炎性介质网络的关键细胞因子[2]。TNF-α主要由血管内皮细胞和单核细胞分泌,在HBV感染患者肝硬化及肝癌演变过程中发挥关键作用[3]。本研究拟分析IL-1β、IL-6和TNF-α水平与慢性HBV感染患者不同临床病程的相关性,为研究细胞因子在慢性HBV发生、发展中的作用机制提供一定的依据。
1 材料和方法
1.1 研究对象
选取2017年9月—2019年5月兰州市第二人民医院住院及肝病门诊收治的H B V 感染患者240例,其中男181例、女59例,年龄(45.38±12.72)岁。依据《慢性乙型肝炎防治指南(2015年版)》[4]中的肝病临床进程,将患者分为乙型肝炎病毒携带(asymptomatic hepatitis B virus carrier,ASC)组、慢性乙型肝炎(chronic hepatitis B,CHB)组、乙型肝炎肝硬化(liver cirrhosis,LC)组和原发性肝癌(hepatocellular carcinoma,HCC)组,每组60例,所有患者排除其他肝炎病毒感染等疾病。另选取同期兰州市第二人民医院体检中心健康体检者60名,其中男30名、女30名,年龄(39.15±14.95)岁,排除各型肝炎病毒感染和心、肺等脏器的疾病,肝功能均正常。
1.2 样本采集和处理
采集所有对象空腹静脉血4 mL,室温静置2 h后,2 506×g离心5 min,分离血清待测。
采用酶联免疫吸附试验检测IL-1β、IL-6、TNF-α,试剂盒购自美国R&D公司,检测仪器为ST-360酶标仪(上海科华公司)。采用实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)检测HBV DNA载量,试剂盒购自湖南圣湘生物科技有限公司,检测仪器为Step One Plus实时荧光定量PCR仪(美国ABI公司)。丙氨酸氨基转移酶(alanine aminotransferase)、天门冬氨酸氨基转移酶(aspartate aminotransferase)、总胆红素(total bilirubin,TB)及白蛋白(albumin,Alb)检测试剂盒均购自兰州创新生物技术开发有限公司,检测仪器为AU680全自动生化分析仪(美国贝克曼库尔特公司)。所有项目均重复检测3次。
1.3 统计学方法
采用SPSS 17.0及Origin 8.5软件进行统计分析。呈正态分布的数据以±s表示,组间比较采用最小显著差异法。以P<0.05为差异有统计学意义。
2 结果
2.1 各组IL-1β、IL-6及TNF-α水平比较
ASC组、CHB组、LC组和HCC组IL-1β、IL-6及TNF-α水平均显著高于正常对照组(P<0.01)。HCC组IL-1β、IL-6水平显著低于ASC组、CHB组、LC组(P<0.01),ASC组TNF-α水平显著低于LC组(P<0.01),其他指标各组间差异均无统计学意义(P>0.05)。见表1。
表1 各组IL-1β、IL-6及TNF-α水平比较 ±s
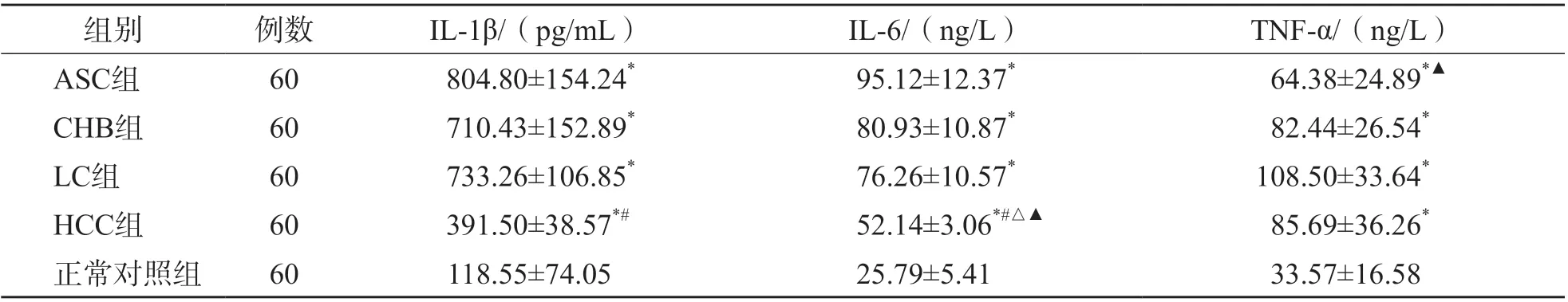
表1 各组IL-1β、IL-6及TNF-α水平比较 ±s
注:与正常对照组比较,*P<0.01;与ASC组比较,#P<0.01;与CHB组比较,△P<0.01;与LC组比较,▲P<0.01。
组别 例数 IL-1β/(pg/mL) IL-6/(ng/L) TNF-α/(ng/L)ASC组 60 804.80±154.24* 95.12±12.37* 64.38±24.89*▲CHB组 60 710.43±152.89* 80.93±10.87* 82.44±26.54*LC组 60 733.26±106.85* 76.26±10.57* 108.50±33.64*HCC组 60 391.50±38.57*# 52.14±3.06*#△▲ 85.69±36.26*正常对照组 60 118.55±74.05 25.79±5.41 33.57±16.58
2.2 慢性HBV感染各组外周血细胞因子与HBV DNA载量及肝功能指标的相关性
ASC组、CHB组IL-1β、IL-6、TNF-α与HBV DNA载量、ALT、AST、TB、Alb均无相关性(P>0.05)。LC组除IL-6与ALT呈负相关(r=-0.314,P<0.05)外,其他各项指标之间均无相关性(P>0.05)。HCC组除TNF-α与HBV DNA载量呈负相关(r=-0.348,P<0.05)外,其他各项指标之间均无相关性(P>0.05)。见表2~表5、图1、图2。
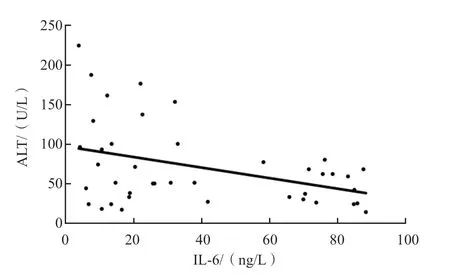
图1 LC组IL-6与ALT的相关性
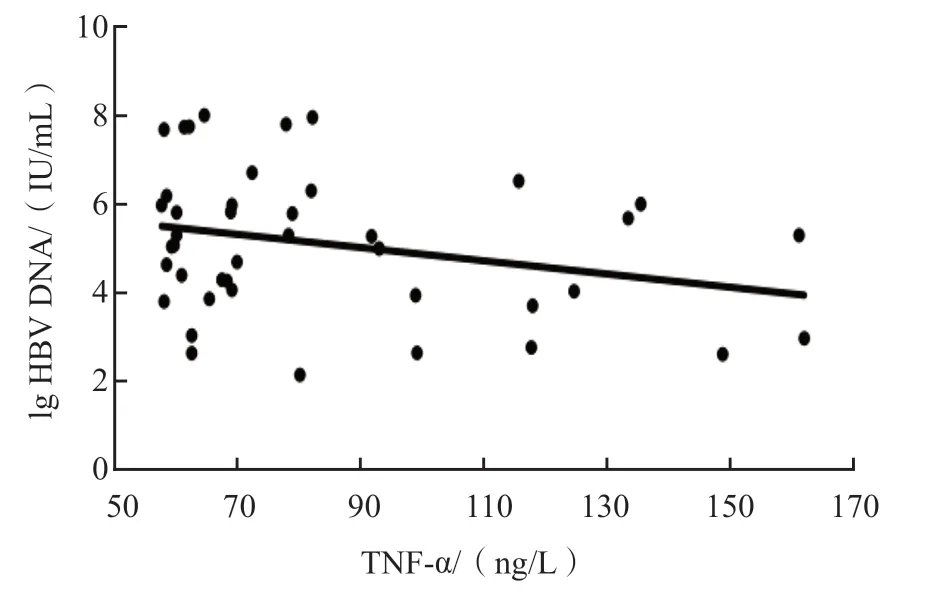
图2 HCC组TNF-α与HBV DNA载量的相关性

表2 ASC组IL-1β、IL-6、TNF-α与HBV DNA载量、ALT、AST、TB、Alb的相关性
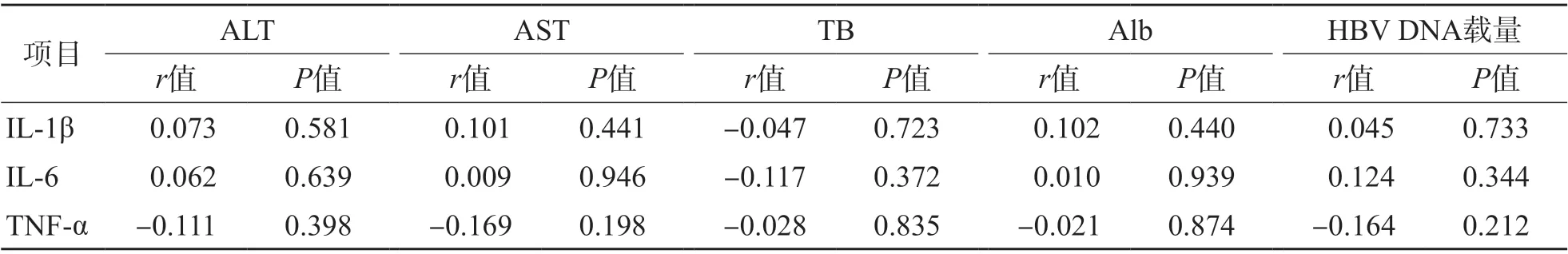
表3 CHB组IL-1β、IL-6、TNF-α与HBV DNA载量、ALT、AST、TB、Alb的相关性
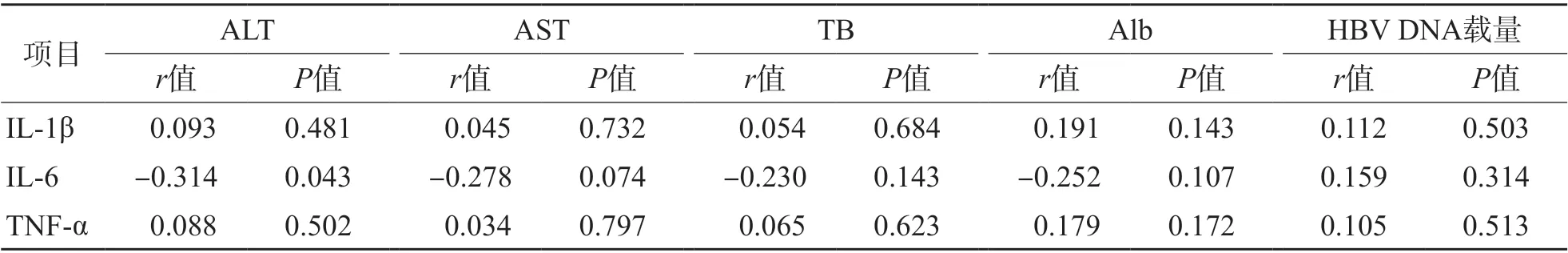
表4 LC组IL-1β、IL-6、TNF-α与HBV DNA载量、ALT、AST、TB、Alb的相关性
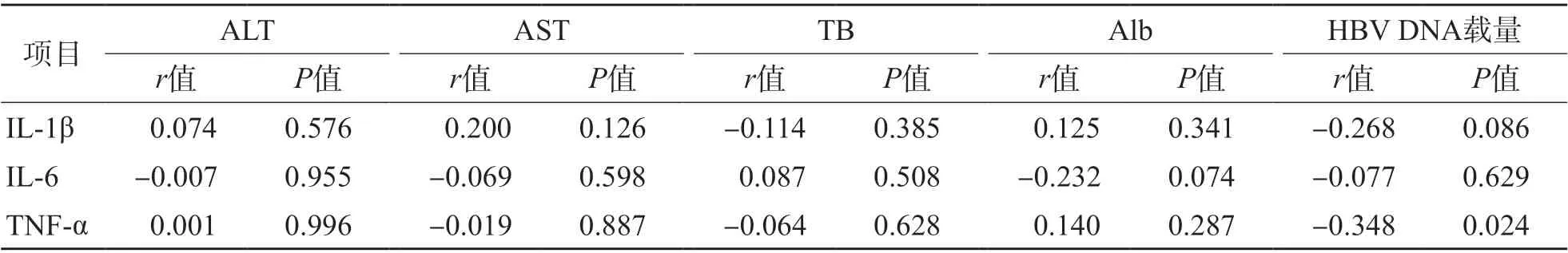
表5 HCC组IL-1β、IL-6、TNF-α与HBV DNA载量、ALT、AST、TB、Alb的相关性
3 讨论
Th分泌的细胞因子参与了人体免疫和炎症反应的调节,是维持机体发挥正常免疫的前提[5-6]。慢性HBV感染是一个复杂的过程,涉及多种免疫细胞和细胞因子。
IL-1可以分为IL-1α和IL-1β 2种亚型,IL-1α由159个氨基酸组成,IL-1β由153个氨基酸组成,由不同的基因分别编码,虽然IL-1α和IL-1β的氨基酸序列仅有26%的同源性,但IL-1α和IL-1β以同样的亲和力结合于相同的细胞表面受体,发挥相同的生物学作用[7]。柴晓哲等[8]的研究结果显示,CHB患者血清IL-1β水平为(64.36±21.53)ng/mL,明显高于IL-1α[(15.15±11.57)ng/mL](P<0.05),说明在CHB患者体内,IL-1β是起主要作用的IL-1蛋白。本研究结果显示,与正常对照组比较,ASC组、CHB组、LC组和HCC组外周血IL-1β水平均显著升高(P<0.01),提示IL-1β作为肝细胞损伤的介质,参与了乙型肝炎的免疫病理损伤过程,表明IL-1β与慢性HBV感染患者肝炎发生、发展的病理生理过程密切相关。当HBV入侵肝脏时,肝细胞会过度分泌IL-1,参与肝脏的免疫损伤和炎症活动,促进HBV感染向CHB、LC和HCC发展[9]。本研究结果还显示,HCC组IL-1β水平明显低于ASC组、CHB组和LC组(P<0.01)。李天驹等[10]的研究结果显示,HBV蛋白可影响肝脏固有免疫,HBV蛋白及其末端蛋白(terminal protein,TP)区通过调节核因子-κB(nuclear factor-kappa B,NFκB)信号通路和核苷酸结合寡聚化结构域样受体3(nucleotide binding domain-like receptor protein 3,NLRP3)炎症小体信号通路,以抑制脂多糖诱导的半胱氨酸天冬氨酸特异性蛋白酶1(cysteine-containing aspartate-specific protease-1,Caspase-1)的激活,减少活化IL-1β的生成及分泌,提示HCC患者较ASC、CHB和LC患者有更高的HBV蛋白活性,从而导致其IL-1β水平降低。由此可见,HCC细胞可通过下调自身IL-1β受体及微环境中IL-1β的水平来降低IL-1β水平,从而逃避IL-1β对其生长的抑制作用。
IL-6主要由单核巨噬细胞产生,其在机体免疫调节中起关键作用,具有多种生物学特性,是一种多功能炎症因子[11]。有研究结果表明,HBVX基因编码的X蛋白可以激活IL-6,产生的IL-6又可以调节HBV的表达和复制[12]。IL-6还可以通过细胞毒性T淋巴细胞和致敏B淋巴细胞等途径来损伤肝细胞,与肝细胞坏死及肝纤维化程度密切相关[13-14]。本研究结果显示,ASC组、CHB组、LC组和HCC组IL-6水平均显著高于正常对照组(P<0.01),提示IL-6与慢性HBV感染患者的炎症病理过程密切相关。本研究中,LC组IL-6水平与ALT水平呈负相关(r=-0.314,P<0.05),这可能与IL-6是一种多功能炎症因子有关,其在LC患者体内也可作为一种抗炎因子存在,可平衡炎症因子引起的损伤效应,从而对肝细胞起到一定的保护作用[2,11]。本研究ASC组、CHB组和HCC组IL-6水平与ALT水平均无相关性(r值分别为0.103、0.062、-0.007,P>0.05),这与文献报道[15]有所不同,可能与本研究样本量较少有关,具体原因还有待扩大样本量进一步研究。
TNF-α主要由肝脏产生,肝脏中也存在着大量TNF-α的受体[16]。有研究发现,肝炎患者体内TNF-α大量积累,其水平变化与LC和肝癌的发展联系紧密[17]。还有研究发现,TNF-α水平的升高与肝纤维化的严重程度有关[比值比(odds ratio,OR)值为3.39,P<0.001][18]。本研究结果显示,与正常对照组比较,ASC组、CHB组、LC组和HCC组外周血TNF-α水平均显著升高,其中LC组TNF-α水平最高,ASC组最低,提示HBV刺激可能会直接导致TNF-α水平升高,且慢性HBV感染者体内存在不同程度的炎症反应。慢性肝损伤最终的病理改变是LC的形成,TNF-α可能在较早阶段就参与了肝纤维化及肝癌的发生过程。本研究结果还显示,HCC组TNF-α水平与HBV DNA载量呈负相关(r=-0.348,P<0.05),提示在末期肝病的发生、发展过程中,TNF-α可能也扮演着重要角色。而ASC组、CHB组和LC组TNF-α水平与HBV DNA载量均无相关性(r值分别为0.117、-0.164、0.105,P>0.05),说明TNF-α可能对ASC、CHB和LC患者疾病进展中的病毒复制影响较小。
邹绮明[19]在研究不同临床病程(ASC、CHB、LC、HCC)慢性HBV感染者与HBV DNA载量及ALT水平的相关性时,将患者分为不同乙型肝炎病毒血清标志物(hepatitis B virus serum marker,HBV-M)表达模式[HBeAg(+)、HBeAg(-)]组,结果显示,不同临床病程患者HBV DNA载量及ALT水平与不同HBV-M表达模式具有较好的相关性。本研究结果显示,IL-6水平与ALT水平仅在LC患者中呈负相关(r=-0.314,P<0.05),TNF-α水平与HBV DNA载量仅在HCC患者中呈负相关(r=-0.348,P<0.05),这可能也与纳入患者的HBV-M表达模式有关。因此,后续研究将会探讨不同HBV-M表达模式下IL-6及TNF-α水平与肝功能损伤指标及HBV DNA载量的相关性。
综上所述,血清IL-1β、IL-6和TNF-α水平或可用于评估慢性HBV感染患者病情的严重程度。IL-1β、IL-6和TNF-α在HBV感染不同临床病程中的作用机制还有待更深入的研究。

