三种贝类不同部位维生素D3的分布及含量比较研究
张肖瑕,刘欣妍,许 艳,贾 喆,宋 茹
(浙江海洋大学食品与药学学院,浙江 舟山 316022)
维生素D是重要的脂溶性维生素之一,它分为维生素D2(麦角钙化醇)和维生素D3(胆钙化醇),维生素D2主要来源于植物、真菌、某些无脊椎动物[1],维生素D3主要来源于动物,如水产动物体、鱼类、动物肝脏、蛋类等[2]。维生素D可调节机体对钙磷的代谢,提高人体免疫功能的作用[3],缺乏维生素D导致儿童产生佝偻病,成人引起软骨病及其他症状[4,5]。维生素D3(Vitamin D3),分子式C27H44O,由于维生素D3与阳光有直接关系,所以又称为“阳光维生素”[6]。David等[7]报道澳洲肺鱼维生素D3含量达到10.7μg/100 g,大西洋鲑鱼维生素D3含量5.8 μg/100 g。目前国内对于贝类中维生素D3的分布及含量鲜见报道。本研究以白蛤、花蛤和青蛤3种不同贝类(图1)为研究对象,分别提取蛤肉和内脏维生素D3,对3种贝类维生素D3的分布及含量进行比较研究,旨在为后续贝类维生素D3的活性研究及综合利用奠定基础。

图1 3种贝类
1 材料与方法
1.1 材料
1.1.1 材料与试剂 新鲜活白蛤、花蛤、青蛤于2019年12月购自舟山市定海区华润万家超市,冻藏备用;考马斯亮蓝G-250、分析级石油醚(30~60℃沸程)、甲醇均购于国药集团;色谱级无水甲醇购于上海阿拉丁生化科技股份有限公司;维生素D3标准品(纯度98%)购于上海阿拉丁生化科技股份有限公司。
1.1.2 主要试验设备 TM-767搅拌机,中山市海盘电器有限公司;Thermo He高速冷冻离心机,赛默飞世科技有限公司;SHA-B型双功能水浴恒温振荡器,金坛市岸头良友实验仪器厂;Vortex QL-861漩涡振荡器,海门市其林贝尔仪器有限公司;EYELA MGS-2200氮吹仪,上海五久自动化设备有限公司;SM800酶标仪,上海永创医疗器械有限公司;Agilent 1260 Infinity高效液相色谱仪,德国安捷伦科技有限公司。
1.2 方法
1.2.1 维生素D3的提取 冷冻贝类用流动水解冻,手动分别剥取蛤肉和内脏,绞碎,蛤肉和内脏样品取适量,分置于50 mL离心管中,按照1∶2(m∶V)比例加入(30~60℃沸程)石油醚,根据样液体积加入抗坏血酸(终浓度为0.012 5%),37℃水浴振荡(200 r/min),避光提取3 h,然后7 500 r/min离心15 min(4℃),取石油醚萃取层,氮气吹干,加入无水甲醇复溶,涡旋振荡至充分溶解,然后定容至2 mL,经0.22μm微孔滤膜过滤,滤液备用。
1.2.2 总维生素D3含量的测定 参照Sazali等[8]高效液相色谱法测定维生素D3含量,具体条件如下。色谱柱:ZORBAX SB-C18(4.6 mm×250 mm,5μm),柱温40℃,进样量10μL,流动相为100%甲醇,流速0.6 mL/min,检测波长264 nm。在相同条件下,测定不同浓度维生素D3标准品(0.1、0.5、1、2、6、10μg/mL)洗脱情况,以维生素D3浓度为横坐标(μg/mL),峰面积为纵坐标,绘制维生素D3标准曲线。样品峰面积带入维生素D3标准曲线,计算出样品中维生素D3浓度(μg/mL),根据式(1)计算样品中维生素D3含量。

式中,c为提取液中维生素D3浓度,μg/mL;v为提取液体积,mL;m为样品质量,g。
1.2.3 蛋白质定性及含量测定 考马斯亮蓝G-250染色液呈蓝绿色,与蛋白质分子中的酰胺基通过分子间范德华键结合,使溶液变为蓝色[9,10],常用于蛋白质的定性及定量分析。样品液与考马斯亮蓝G-250试剂按照1∶5比例混合,充分反应15 min,测定595 nm处吸光度。不同浓度牛血清白蛋白(0~400 μg/mL)与考马斯亮蓝试剂反应后,测定595 nm处吸光度,以蛋白质浓度为横坐标(x),吸光度为纵坐标(y),绘制出蛋白质标准曲线y=0.001 5x+0.040 3,R2=0.920 7,用于样品提取液中蛋白质浓度测定。
1.3 数据统计
试验结果用平均值±标准差(n=3)表示,采用Origin 2019软件绘制图形,用SPSS 19.0软件对组间差异性进行比较。
2 结果与分析
2.1 维生素D3标准曲线制作
图2结果表明,在0~10μg/mL维生素D3浓度与峰面积呈现良好的线性关系,回归方程为y=28.557x+4.339 2,R2=0.998 9,可用于本试验提取液中维生素D3浓度测定。
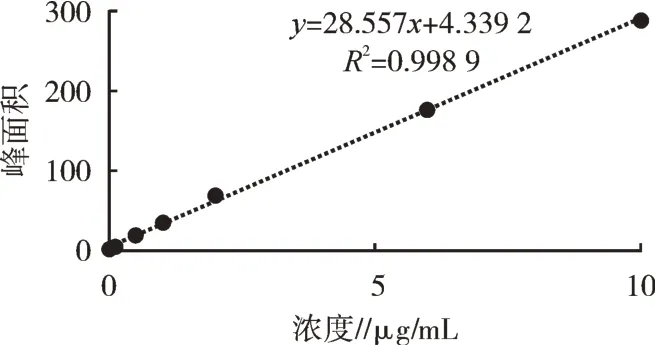
图2 维生素D3标准曲线
2.2 贝类不同部位维生素D 3分布及含量比较
2.2.1 不同蛤肉中维生素D3分布比较 白蛤、花蛤、青蛤的蛤肉中维生素D3分布情况见图3。维生素D3标准品在洗脱时间19 min出现特征吸收峰,根据洗脱时间来定性。由图3可知,白蛤肉在18.5 min有特征吸收峰,花蛤肉和青蛤肉均在18.6 min处有特征吸收峰出现(箭头所示),但同时也能看出,蛤肉除了在18.5~18.6 min处有特征吸收外,在其他时间段也出现264 nm特征吸收峰,推测可能与提取液中含有蛋白质、肽、维生素D3衍生物及其他复合产物有关,有待于进一步研究。由图3还可以看出,3种贝类的蛤肉在17~25 min出峰时间比较类似,表明3种贝类除了含有维生素D3外,还可能含有其他类似物。
2.2.2 不同蛤内脏中维生素D3分布比较 白蛤、花蛤、青蛤的蛤内脏中维生素D3分布比较见图4。由图4可以看出,白蛤内脏、花蛤内脏、青蛤内脏均在18.7 min出现特征吸收(箭头所示),说明含有维生素D3。与蛤肉的色谱图相似,3种贝类内脏提取液同样在其他时间段也出现类似吸收峰,说明这3种贝类内脏提取液中含有大量类似物。
2.2.3 3种贝类提取液中蛋白质定性和定量分析维生素D3在264 nm处有特征吸收[8],蛋白质中肽键、酪氨酸、苯丙氨酸及色氨酸在220~280 nm也有吸收[11]。对3种贝类肉和内脏提取液中蛋白质进行定性和定量分析,结果见图5。由图5可知,3种贝类肉和内脏提取液中均含有蛋白质,即考马斯亮蓝溶液被染色呈蓝色,说明图3和图4分离的色谱峰中含有蛋白质类物质存在。进一步对3种贝类肉和内脏提取液的蛋白质浓度进行定量分析,花蛤肉提取液中蛋白质浓度达到519.20μg/mL,显著高于白蛤肉和青蛤肉中蛋白质浓度(P<0.05)。而3种贝类内脏提取液中,花蛤内脏蛋白质浓度显著高于白蛤和花蛤内脏提取液的蛋白质浓度(P<0.05)。由此可见,3种贝类肉和内脏提取液中蛋白质浓度不同。推测该部分蛋白质可能具有较强的疏水性或与脂类结合在一起,结果被石油醚萃取出来。因此,这3种贝类肉和内脏提取液的维生素D3纯化后续需要经过脱蛋白处理。
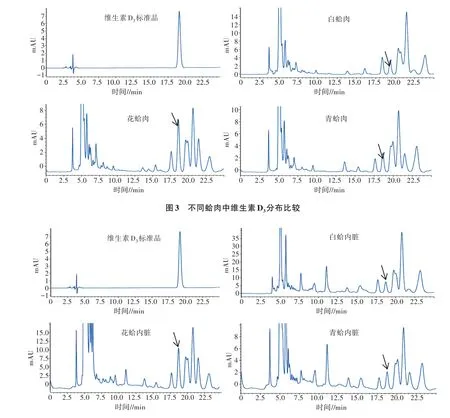
图4 不同蛤内脏中维生素D3分布比较
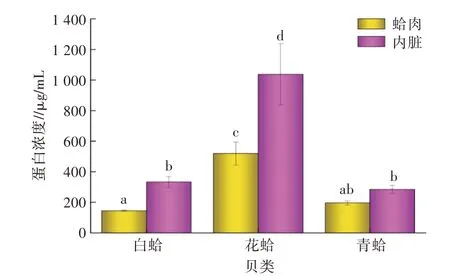
图5 3种贝类提取液的蛋白质定性及定量分析
2.2.4 不同蛤肉和内脏维生素D3含量比较 进一步比较了3种贝类的蛤肉和内脏维生素D3含量及维生素D3总量,结果见图6。由图6(a)可以看出,白蛤肉中维生素D3含量显著低于花蛤肉维生素D3含量(P<0.05),花蛤肉维生素D3含量高达到10.90±0.74 μg/g。而在内脏中,花蛤内脏的维生素D3含量显著高于白蛤和青蛤内脏中维生素D3含量,其中青蛤内脏维生素D3含量最低为2.10±0.24μg/g。此外,图6(a)结果显示白蛤肉和内脏的维生素D3含量无统计学上差异,而花蛤和青蛤肉中维生素D3含量均显著高于其内脏维生素D3含量。
比较图6(b)维生素D3总量可知,花蛤的维生素D3总量最高,达到19.30±0.72μg/g,比青蛤维生素D3总量高出3倍。Bourre等[12]报道,贝类牡蛎中维生素D3含量达8.0 mg/100 g,William等[13]报道,海鲈鱼中维生素D3含量为0.73 mg/100 g。本研究中白蛤、花蛤和青蛤的维生素D3总量与文献报道的水产品维生素D3含量范围具有一致性。
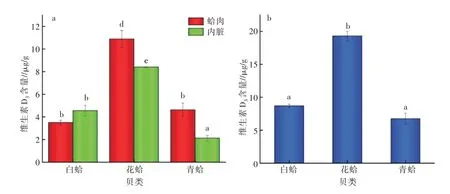
图6 3种贝类维生素D3含量比较
3 结论
3种贝类肉和内脏中均含有维生素D3,但是含量差异较大,其中花蛤内脏及肉中维生素D3含量最高,青蛤维生素D3总量最低。高效液相色谱法及蛋白质定性和定量分析表明,3种贝类提取液中除了含有维生素D3外,还有蛋白质等其他干扰物质,因此从贝类提取维生素D3需要进一步纯化处理,其他洗脱峰的特性也需要深入研究,为后续维生素D3的活性及应用研究奠定基础。

