HPLC-ESI-MS/MS法同时测定血必净注射液中11种有效成分的含量*
王 红,刘 玲,苏联麟,郭志花,崔永伟**
1 南京市溧水区中医院 药剂科,南京 211200;2 南京中医药大学 药学院,南京210046
血必净注射液是以清代医家王清任的血府逐瘀汤为底方研制而成,是于2004 年批准上市的中药二类新药,具有活血化瘀、清热解毒、扶正固本的功效,临床常用于治疗因感染诱发的全身炎症反应综合征,也可作作多器官功能失常综合征的脏器功能受损期配合治疗[1]。其组方为红花、川芎、赤芍、当归、丹参5 味中药,其含有多个明确的药理药效。主要次生代谢产物如羟基红花黄色素A、阿魏酸、芍药苷、丹酚酸A 等[2~5],其与药理药效对应关系见图1。

图1 血必净注射液中次生代谢产物与药理药效关系
血必净注射液作为常见中药注射剂在临床使用过程中易导致皮疹、瘙痒、呼吸困难、心悸,甚至过敏性休克等过敏现象[6]。其含有的次生代谢产物在注射给药过程中有着较为明确的过敏反应,如含绿原酸中药注射剂临床使用中是最易致敏的有效成分[7]。丹酚酸A、B 可能与黄疸等胆红素相关不良反应有关[8]。藁本内酯则可能引发药物代谢酶诱导效应[9],导致代谢性药物相互作用的发生。监测以上成分的含有量及含量的稳定性显得尤为重要。
基于对血必净注射液的功效物质基础、临床疗效及其体内物质基础的研究,采用液相色谱与三重四级杆质谱联用法,建立准确灵敏的血必净注射液中11 种化学成分含量测定的方法。其化学结构见图2。
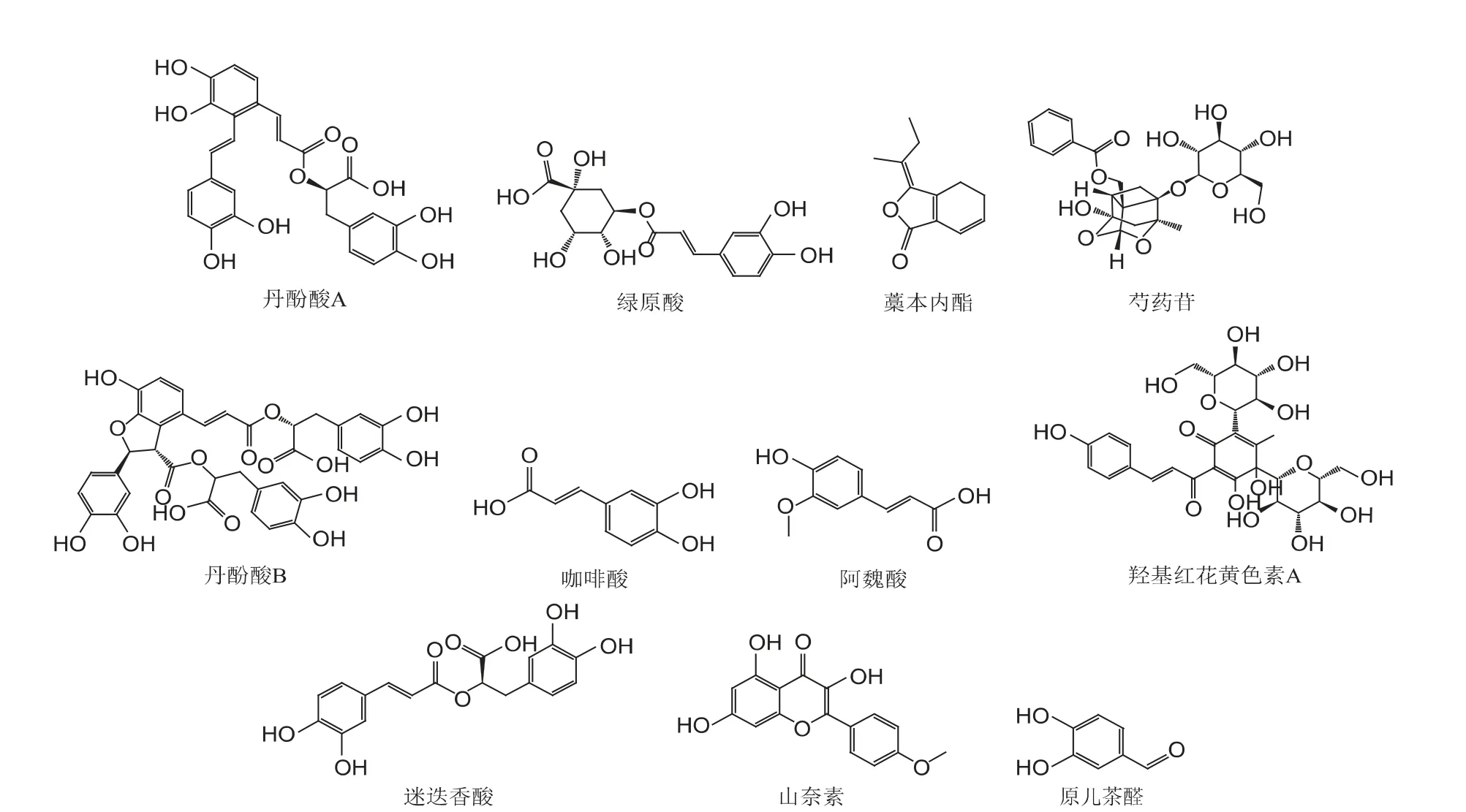
图2 血必净注射液中11 种化合物结构式
1 仪器与药品、试剂
1.1 仪器
Shimadzu 30A 超高效液相色谱系统(岛津公司,日本);AB Triple Quad TM 5500 质谱系统(AB SCIEX 公司,美国);MS-105D 型十万分之一天平(Mettler Toledo 公司,瑞士)。
1.2 药品与试剂
对照品:绿原酸(批号Y22M8K36544,纯度≥98%)、原儿茶醛(批号TO1013FB14,纯度≥98%)、羟基红花黄色素A(批号R17D10F106127,纯度≥98%)、咖啡酸(批号W16O10B100366)、芍药苷(批号L07M9Q60533,纯度≥98%)、阿魏酸(批号L03A9D57744,纯度≥98%)、迷迭香酸(批号Y06A9K67402,纯度≥98%)、丹酚酸A(批号Z23D10X106625,纯度≥98%)、丹酚酸B(批号P20J10F93457,纯度≥98% )、山奈素(批号Y14M11H109733,纯度≥98%)、藁本内酯(批号R19D10F106243,纯度≥98%)均购自上海源叶生物科技公司;血必净注射液(批号:1903291、1906181、1911251、1911261、1911271、2002211,规格10 mL,天津红日药业)。乙腈、甲醇、甲酸均色谱纯;超纯水。
2 方法与结果
2.1 色谱条件
色谱柱:Agilent Extend-C18(2.1 mm×100 mm,1.8 μm);柱温:35 ℃;流动相:0.1%甲酸水(A)-乙腈(B)(相同梯度洗脱程序:0~1 min,15%B;1~3 min,15%~40%B;3~4 min,40%~70%B;4~5 min,70%~98%B;5~6 min,98%B);每次进样预平衡5 min,流速:0.3 mL·min-1;进样量:5 μL。
2.2 质谱条件
三重四级杆质谱仪配置电喷雾离子源(ESI),采用动态多反应监测(MRM)模式进行正负离子扫描,优化质谱参数如下:离子源温度550 ℃;气帘气压力25 psi;喷雾气压力55 psi;辅助气压力55 psi;去溶剂氮气流速为15 L·min-1;去溶剂气体温度为450 ℃。11 种成分用于定量分析的质谱检测参数见表1;各成分提取离子流色谱图见图3。

图3 对照品(A)和血必净样品(B)中各成分的提取离子流色谱图

表1 各成分质谱参数
2.3 溶液的配制
2.3.1 对照品溶液分别精密称取绿原酸、原儿茶醛、羟基红花黄素色A、咖啡酸、芍药苷、阿魏酸、迷迭香酸、丹酚酸A、丹酚酸B、山奈素、藁本内酯的对照品适量,分别置于5 mL 量瓶中,加50%甲醇溶解并稀释至刻度,摇匀,制成各对照品储备液。精密量取上述各储备液适量,加50%甲醇稀释至刻度,摇匀,即得含绿原酸0.500 μg·mL-1、原儿茶醛0.800 μg·mL-1、羟基红花黄色素A 8.000 μg·mL-1、咖啡酸0.800μg·mL-1、芍药苷8.000μg·mL-1、阿魏酸0.500μg·mL-1、迷迭香酸0.100 μg·mL-1、丹酚酸A 0.800 μg·mL-1、丹酚酸B 0.500μg·mL-1、山奈素0.800 μg·mL-1、藁本内酯0.800 μg·mL-1的混合对照品溶液。
2.3.2 供试品溶液本品以超纯水稀释300 倍,摇匀,经0.22 μm 微孔滤膜滤过,得供试品溶液。
2.4 方法学考察
2.4.1 检测限、定量限精密量取“2.3.1”项下的混合对照品溶液1.0 mL 至100 mL 量瓶中,加50%甲醇稀释至刻度,摇匀,按照“2.1”与“2.2”检测条件进样分析,记录色谱图,同时不断稀释已知质量浓度的对照品溶液,以信噪比为3∶1 和10∶1 分别计算检出限和定量限,结果见表2。
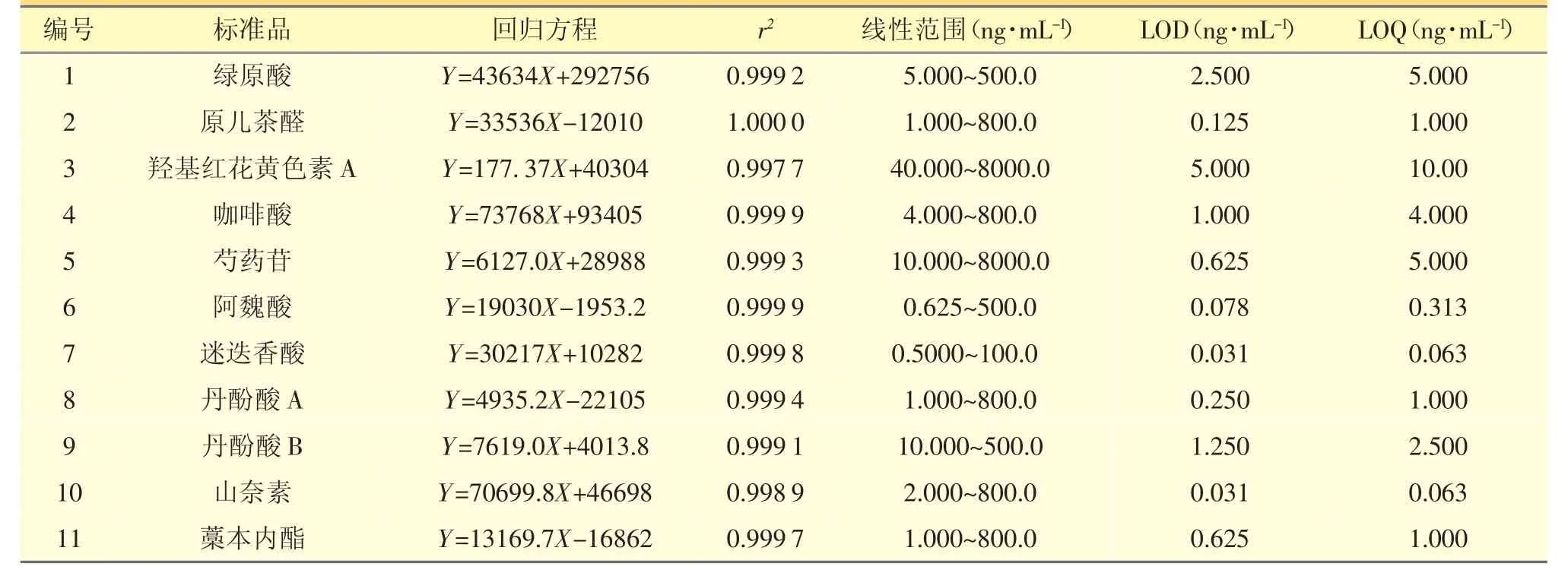
表2 各成分线性关系、检测限和定量限
2.4.2 线性关系将对照品储备液用50%甲醇逐级 稀释,配制成不同质量浓度的混合对照品溶液,按“2.1”和“2.2”检测条件测定,以质量浓度为横坐标(X),峰面积为纵坐标(Y)作线性回归。结果表明,被测11 种成分在相应范围内线性关系良好,见表2。
2.4.3 精密度试验取批号为1911251 样品,按“2.3.2”项下方法制备供试品溶液,连续进样6 次,记录色谱图,测得各成分峰面积RSD 分别为绿原酸3.1%、原儿茶醛2.5%、羟基红花黄色素A 1.6%、咖啡酸3.1%、芍药苷2.2%、阿魏酸2.7%、迷迭香酸5.7%、丹酚酸A 3.4%、丹酚酸B 3.5%、山奈素4.8%、藁本内酯5.1%。表明该方法有较好的精密度。
2.4.4 重复性试验取批号为1911251 样品,按“2.3.2”项下方法制备供试品溶液6 份,按“2.1”和“2.2”项下检测条件测定,记录色谱图,测得各成分含量RSD 分别为绿原酸3.2%、原儿茶醛2.2%、羟基红花黄色素A 2.1%、咖啡酸3.7%、芍药苷2.4%、阿魏酸3.0%、迷迭香酸5.1%、丹酚酸A2.9%、丹酚酸B 3.6%、山奈素4.7%、藁本内酯4.8%。表明本方法的重复性良好。
2.4.5 稳定性试验取批号为1911251 样品,按“2.3.2”项下方法制备供试品溶液,分别于0、2、4、6、8、12h 进样,记录色谱图,测得各成分峰面积RSD 分别为绿原酸2.1%、原儿茶醛2.8%、羟基红花黄色素A 2.0%、咖啡酸1.9%、芍药苷1.5%、阿魏酸2.0%、迷迭香酸5.3%、丹酚酸A 3.6%、丹酚酸B 3.6%、山奈素4.9%、藁本内酯4.8%。表明供试品溶液在12h 内稳定。
2.4.6 加样回收率试验精密量取已知含量的血必净注射液样品(批号为2002211)6 份,分别加入等体积混合对照品溶液,按“2.3.2”项下制备供试品溶液,进样5 μL 测定含量,计算加样回收率,平均加样回收率在97.01%~102.70%,结果见表3。

表3 血必净中11 种成分的加样回收率(n=6)
2.5 样品含量测定
精密量取6 份不同批次的血必净注射液样品,每批3 份,按“2.3.2”项下方法制备供试品溶液,按“2.1”和“2.2”检测条件进样测定,计算被测成分的含量,结果见表4。

表4 不同批号血必净中11 种成分的含量(ng·mL-1,n=3)
由表4 看出,血必净中羟基红花黄色素A 含量最高,平均6884.21 ng·mL-1;其余依次为芍药苷5212.11 ng·mL-1>阿魏酸110.24 ng·mL-1>原儿茶醛47.05ng·mL-1>丹酚酸B 29.33ng·mL-1>绿原酸22.79ng·mL-1>丹酚酸A 17.44 ng·mL-1>咖啡酸14.72 ng·mL-1>藁本内酯2.99 ng·mL-1>山奈素2.78 ng·mL-1>迷迭香酸1.10 ng·mL-1。除迷迭香酸含量波动外,6 批血必净注射液中其他10 种成分的测定含量均较一致。
3 讨论
3.1 色谱条件的选择
分别考察了0.1%甲酸水-甲醇、0.1%甲酸水-乙腈、0.1%乙酸水-甲醇、0.1%乙酸水-乙腈作为流动相时的色谱分离效果及峰形情况[10],发现0.1%甲酸水-乙腈为流动相时,各被测成分均能在6 min 内出峰,且能与该离子通道下的其他干扰峰有效分离,峰形良好,可用于定量分析。
3.2 检测模式的考察
根据血必净注11 种指标成分的化学性质和色谱行为,考察了正、负离子扫描模式下被测成分的响应值[11],结果发现,正离子模式下藁本内酯产生的碎片离子响应值高且稳定,而其余10 种成分在负离子模式下响应较好。本实验采用同一分析周期内、同一梯度洗脱下正、负离子同时监测,既兼顾被测成分的质谱碎裂性质,又极大缩短分析的时间。
3.3 样品含量分析
从表4 看出,除迷迭香酸外,其余10 种被测成分在6 个批次的血必净注射液样品中含量差异较小,说明被测成分从原料制备成血必净注射液,其制剂工艺稳定可控。
参考有关文献,迷迭香酸在丹参根中含量范围为0.11%~0.74%,可见其在血必净注射液原料丹参中的含量相对较低,再经过提取、纯化、制剂等多个步骤,导致迷迭香酸在6 个不同批次样品中的含量差异较大,同时也不排除丹参在采挖、加工炮制、贮藏方式等方面所致的损耗。
易导致过敏的成分如丹酚酸B、绿原酸、丹酚酸A和藁本内酯在血必净注射液中含量在2.73~31.99ng·mL-1,含量较低,但浓度低并不能代表其致敏能力低;且文献并未提及的化合物仍然存在致敏性的可能性,还有待后期的试验研究去证实。
本研究通过HPLC-ESI-MS/MS 多组分快速测定,结合化学模式识别技术,建立血必净注射液中化学成分的定量分析,该方法准确可靠,可为进一步规范其质量控制提供参考,为后期血必净注射液有效成分致敏原筛查提供研究基础。

