食管宁复方中药汤剂对反流性食管炎的治疗效果:大鼠模型研究
段冰霞,陈宏慈, 徐安,萧闵,田代志
(湖北中医药大学:1中医临床学院,3中医药实验中心,武汉 430065;2湖北省中医院老年病科,武汉 430061)
胃内容物反流入食管产生症状或并发症时,称胃食管反流病(gastroesophageal reflux disease,GERD),酸(碱)反流导致的食管黏膜破损称反流性食管炎(reflux esophagitis,RE)[1]。GERD在全世界普遍存在,其患病率不断升高,且疾病负担正在增加[2]。西医认为GERD是食管下括约肌(lower esophageal sphincter,LES)松弛、胃酸反流、黏膜屏障受损等原因所致, 治疗以抑酸、促胃肠动力为主[3]。治疗药物以质子泵抑制剂(proton pump inhibitor,PPI)、H2受体阻滞剂、促胃肠动力药等为主,虽然有疗效,但容易复发。中医药治疗RE有一定的特色和优势。食管宁为临床治疗RE过程中总结出的经验方,临床疗效佳。本实验以食管宁经验方为基础,观察其对RE大鼠胃动素(motilin,MTL)、白细胞介素-17(interleukin-17,IL-17)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)mRNA的影响,探讨食管宁治疗RE的作用机制。
1 材料与方法
1.1 实验动物及分组
雄性SD大鼠60只,体质量(180±20)g,购自三峡大学,合格证号:SCXK(鄂)2017-0012,按随机数表法分为5组:假手术组(sham组)、模型组(M组)、食管宁高剂量组(H组)、食管宁低剂量组(L组)和西药组(W组),每组12只;饲养于湖北中医药大学SPF级动物房,每日光照时间12 h,温度(25±1)℃,相对湿度45%~60%。自由进食饮水。购入后适应性饲养7 d。
1.2 实验试剂及仪器
基因美大鼠胃动素酶联免疫分析试剂盒(货号:JYM0376Ra);CFX96实时荧光定量PCR仪(BIO-RAD, 美国伯乐公司)、EDC-810型PCR仪(北京东胜创新生物科技有限公司)、Bx-60型olympus光学显微镜(日本奥林巴斯公司)。全自动图象分析仪:01ymPusBX-50显微摄影系统、PalardoDMCI数码相机、HUMAIS-2000医学图文分析系统(武汉千屏影像技术有限责任公司)。
1.3 实验药物
食管宁由北沙参、桔梗、炙杷叶、柴胡、香橼皮、全瓜蒌、枳实、厚朴、苏梗、郁金、香附、牛膝构成,经湖北省中医院药剂科煎煮、浓缩、消毒,制备成分别含1,2 g/ml生药的浓缩汤剂。于4 ℃冰箱保存备用。
埃索美拉唑镁肠溶片20 mg/片,给药前稀释为0.24 mg/ml的混悬液,于4 ℃冰箱保存备用。使用前均先常温放置1 h。
1.4 造模方法
术前禁食不禁水24 h,10%水合氯醛腹腔注射(3 ml/kg)麻醉,行常规备皮(2 cm×2 cm范围)及消毒铺巾,手术过程严格无菌操作。
M组、H组、L组和W组行“不全幽门结扎+食管下括约肌切开术”[4],于食管-胃交界右前壁处做一长约0.5 cm纵行切口,同时避开血管和神经,完全切开胃食管交界区平滑肌,使胃黏膜及食管黏膜充分外露,分离至黏膜层完全暴露于视野中,分离前用血管钳夹住胃-食管交界处的胃左动脉分支,后外置幽门部分结扎,将直径为4 mm的金属棒放置胃幽门处外侧,将金属棒连同幽门一并结扎,并避开血管,结扎完毕后,将金属棒抽出后关腹。sham组只行开腹后暴露食管-胃交界处,夹住胃左动脉分支约10 min后关腹。
关腹前每只大鼠腹腔内注入硫酸庆大霉素2万U,创口予以碘伏消毒。术后可饮5%葡萄糖氯化钠溶液,禁食24 h。
1.5 实验步骤
常规喂养1周后,参考黄继汗等药物等效剂量换算标准[5]。M组、sham组予0.9%氯化钠溶液;H组和L组分别予食管宁汤剂2,1 g/ml;W组予埃索美拉唑镁肠溶片混悬液0.24 mg/ml。每次1.5 ml/100 g,均灌胃,1次/d,共2周。
1.6 取材
2周后,实验大鼠均予10%水合氯醛腹腔注射(3 ml/kg)麻醉,行常规备皮(2 cm×2 cm范围)及消毒铺巾。抽取腹主动脉血液5 ml,并离心(2000~3000 转/min,20 min,2 ℃~8 ℃)取上清液。自胃食管交界上0.5 cm处向咽喉部截取1 cm食管组织,分为3部分,一部分置于4 ℃ 4%多聚甲醛中保存,余2部分储存于-80 ℃冰箱。
1.7 观察指标和方法
1.7.1 大鼠一般状态 观察各组实验大鼠一般状态,如毛发色泽及脱落、活跃,进食水量、大便量及性状、体质量等。
1.7.2 食管黏膜病理学观察 食管组织经4 ℃ 4%多聚甲醛常规固定、脱水、石蜡包埋,连续切片,每个标本4张(厚度约5 μm),苏木精-伊红染色,光镜下观察大鼠食管黏膜组织切片并进行RE病理分级,正常、轻度、中度、重度按照0、1、2、3计分。食管黏膜组织病理分级采用中华医学会消化内镜分会(2003年)的RE诊断标准[1]。
1.7.3 血浆胃动素含量测定 离心血浆按基因美大鼠MTL试剂盒使用说明书检测步骤逐步进行。
1.7.4 食管组织IL-17和TNF-α mRNA的表达 实时荧光定量聚合酶链式反应检测食管组织IL-17 和TNF-α mRNA的表达。Trizol法提取RNA,并将总RNA置于-80 ℃冰箱内保存备用;逆转录成cDNA,10倍稀释,行实时荧光定量聚合酶链式反应检测,反应条件为50 ℃ 2 min,95 ℃ 10 min;95 ℃ 30 sec,60 °C 30 sec,40圈。行溶解曲线,最终数据以2-△△Ct进行分析。引物序列见表1。
1.8 统计学处理

2 结 果
2.1 异常情况
因术后胃肠胀气,sham组、H组、L组和W组各剔除1只。因食物反流明显入肺窒息死亡,H组剔除1只,M组剔除2只。
2.2 一般情况
造模及灌胃期间,5组均有不同程度的毛发色泽变暗、活动减少、进食水量下降、稀水样便、体质量减轻等表现。其中sham组上述表现恢复最快,M组恢复最慢,且上述表现最明显。
2.3 各组RE大鼠病理积分、血浆胃动素、食管组织IL-17 mRNA及TNF-α mRNA的比较
光镜下发现,sham组实验大鼠的食管黏膜组织切片无明显炎性改变,偶见上皮细胞层内少许炎症细胞。其余实验大鼠均见基底层、棘层鳞状上皮不同程度增生,鳞状上皮基底细胞可见细胞核增大,染色质增粗,固有层乳头延伸。M组大鼠黏膜固有层可见明显中性粒细胞浸润,甚至可见溃疡灶。与M组相比较,H组、L组和W组3组实验大鼠的炎症改变均较轻,均未见明显溃疡灶,或仅见上皮细胞层内炎症细胞浸润(图1)。
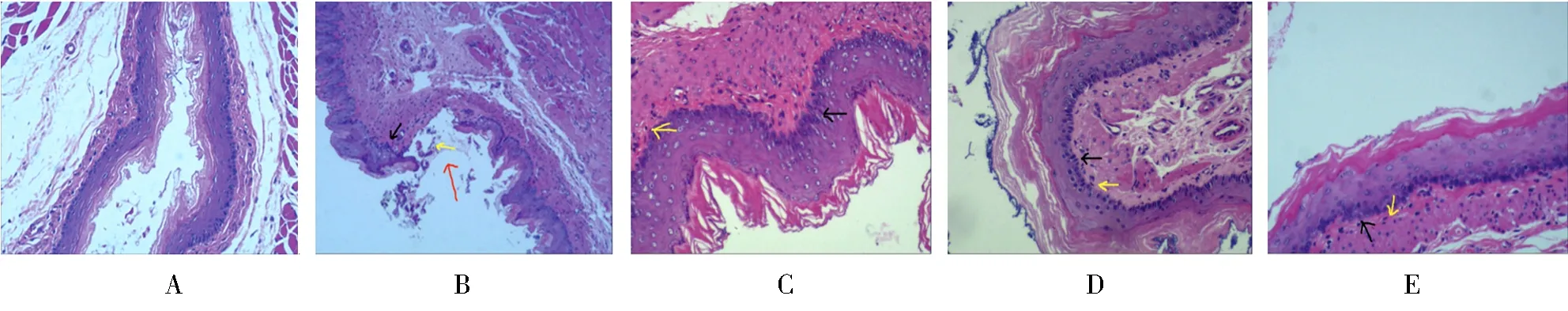
图1 大鼠食管黏膜组织切片苏木精-伊红染色
实验大鼠食管黏膜组织切片病理分级积分分析发现,sham组积分最低,与M组、H组和L组3组进行比较差异有统计学意义(P<0.05),sham组与W组比较无差异(P>0.05)。M组积分最高,与H组、L组和W组比较差异有统计学意义(P<0.05)。M组血浆MTL含量最低,与sham组、H组、L组和W组相比差异有统计学意义(P<0.05)。sham组IL-7 mRNA表达量最低。M组IL-7 mRNA表达量最高,与sham组、H组、L组和W组相比差异有统计学意义(P<0.05)。H组与其余4组比较差异有统计学意义(P<0.05)。Sham组TNF-α mRNA表达量最低。M组TNF-α mRNA表达量最高,与sham组、H组、L组、W组相比差异有统计学意义(P<0.05)。详见表2。
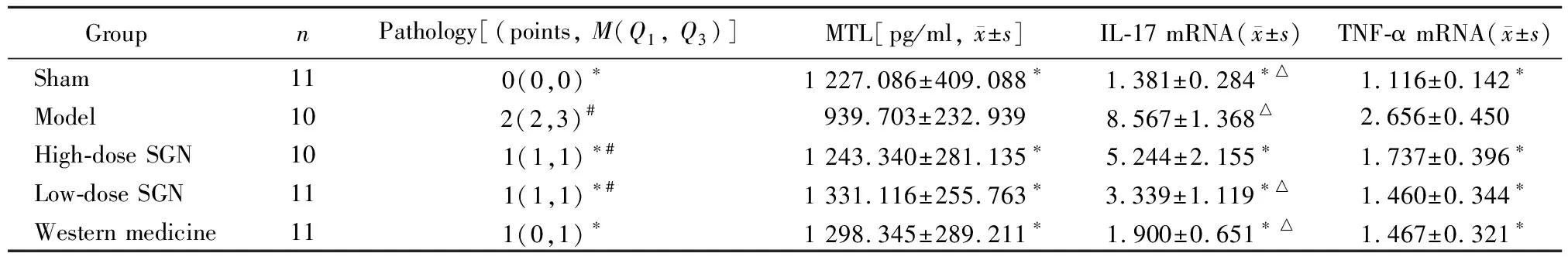
表2 病理积分、血浆胃动素、食管组织IL-17 mRNA及TNF-α mRNA结果比较
3 讨 论
在中医领域,RE根据症状多归属于食管瘅、噎膈、反胃、嘈杂和痞满等疾病范畴。RE的病位在食管和胃,与脾、肝、胆、肺密切相关。基本病机为胃失和降,胃气上逆。“禀赋不足、脾胃虚弱”为RE的发病基础。RE以疏畅气机为要。临床多见肝郁之象,因而常以疏肝和胃降逆为治疗大法。食管宁经验方根据中医气机升降理论,结合RE多气虚气郁的致病特点总结得出。该方不仅补虚,还宣上(宣肺气)、畅中(疏肝气、降胃气)、通下(引热下行、润肠通便),调理全身气机升降。方中北沙参益气养阴;桔梗、炙杷叶宣通肺气;柴胡、香橼皮疏肝行气,以治肝安胃,从而调理脾胃气机;瓜蒌、枳实、厚朴宽中下气,疏通肠道气机;全方调理全身气机使之通畅,以治疗RE。
PPI为治疗RE首选药物,多项研究表明埃索美拉唑镁肠溶片治疗RE疗效确切[6-8]。本研究H组和L组食管黏膜组织病理积分较M组低,与W组比较无显著差异;说明食管宁能明显改善RE大鼠食管黏膜损伤,且与埃索美拉唑镁肠溶片疗效相当。
食管下括约肌压力(lower esophageal sphincter pressure,LESP)降低为导致GRED重要原因;LESP越低,反流越严重[9]。MTL为小肠Mo细胞分泌的胃肠道肽激素,可作用于LES的MTL受体[10],在LES的收缩中发生作用,增加LESP[11]。RE患者血清MTL水平较健康人低[12],且RE患者血浆MTL与LESP正相关。MTL降低可降低LESP,与RE关系密切[13]。本研究显示,食管宁能上调RE大鼠血浆MTL含量,进而增加LESP,从而治疗RE。
LESP下降,胃酸反流入食管致其黏膜损伤。有研究表明GRED中反流的胃液并不直接损伤食管, 而通过刺激细胞因子调控的炎症反应机制引起食管损伤[14]。GERD是细胞因子介导的炎症反应, 并非反流物的直接化学性损伤。彭林艳等[15]研究认为RE患者存在全身炎症反应,RE跟炎症关系密切。
IL-17为辅助性T细胞17细胞最主要效应因子,其可以诱导IL-6、一氧化氮和前列腺素E2产生,同时上调TNF-α基因表达,促进局部炎症进展、扩大[16]。IL-17诱导炎症方面的功能非常强大[17]。目前IL-17 mRNA表达与RE相关的报道较少,但是多项研究中都显示无论与假手术组还是与正常组相比,RE大鼠食管组织IL-17 mRNA表达均升高;说明在RE发生发展中IL-17 mRNA表达有一定作用[18,19]。食管黏膜受到酸反流刺激时活性氧会过量,氧自由基会聚集。食管黏膜损伤与局部氧自由基聚集关系密切[20]。TNF-α为多核巨细胞产生的细胞因子,在介导炎症过程、组织损伤等病理生理反应中发挥作用[21,22]。且TNF-α能刺激、诱导中性粒细胞产生活性氧,这种作用与食管黏膜损伤也密切相关[22]。急性RE大鼠食管黏膜中TNF-α含量会增高[23,24]。此外有研究表明RE大鼠食管组织TNF-α mRNA表达升高,且其表达与RE大鼠炎症分数正相关[25]。本研究M组IL-17 mRNA及TNF-α mRNA表达最高,说明M组大鼠炎症最严重。经高、低剂量食管宁治疗后的RE大鼠,IL-17 mRNA及TNF-α mRNA表达均较M组低。食管宁可能通过下调IL-17 mRNA及TNF-α mRNA表达而改善RE炎症。此外,本研究还发现H组的IL-17 mRNA表达与L组相比差异有统计学意义,H组的IL-17 mRNA表达更高,说明低剂量的食管宁抗炎效果更好。
综上所述,本研究在动物实验水平验证食管宁作用于RE大鼠的机制可能与上调血浆MTL含量、下调IL-17 mRNA及TNF-α mRNA的表达相关。

