蟹类干制标本制作方法
韩志豪 , 李松林 , 黄旭雄
(1.上海海洋大学 农业农村部鱼类营养与环境生态研究中心 , 上海 浦东 201306;2.上海海洋大学 水产科学国家级实验教学示范中心 , 上海 浦东 201306)
动物标本种类繁多,按照制作方法可将动物标本分为剥制标本、浸制标本、骨骼标本、干制标本(Dry specimen)和玻片标本等[1]。不同的标本制作方法适用于不同的动物类群,如鸟和兽类大多采用剥制方法,而昆虫和甲壳类则大多制成干制标本。
蟹类干制标本是高等农业院校水生生物学教学中的重要教学材料,具有直观、生动、不受季节和区域限制的优点,能让学生更深刻的了解蟹类外部结构。现在蟹类标本的制作大多都是使用浸制法,此法可方便、快速、长时间的保存蟹类标本,但是该方法存在以下缺点:使用的浸制液多为5%~10%的福尔马林溶液或95%的乙醇溶液,浸制液的挥发会对人体健康产生危害;同时,因为标本在浸制液中保存,所以很难对其进行定型,并且运输困难、成本高;标本长时间保存于福尔马林浸制液中往往会有多聚甲醛形成,使浸制液体变的浑浊,影响观察[2]。相比之下,干制标本就仅需拿标本针将其固定在标本盒中就可四处携带。若螃蟹标本后期遇到损伤或蟹腿脱落等问题,干制标本用适当方法就可进行修复,而浸制标本很难进行后期修复。最重要的是,浸制标本中无论使用哪一种浸制液都会对蟹类甲壳中的色素造成溶解,标本会随着浸泡时间的增长体色越来越淡,会误导观看者对蟹类体色的认知。目前常用的标本干制方法主要有以下2种:(1)使用防腐粉的干制法:将防腐粉放入蟹类体内,抑制蟹类的腐烂,从而达到长期保存的目的,但是该方法不能彻底去除甲壳内肌肉,导致标本做成之后粘附在甲壳内部的肌肉氧化后变黑、变臭,大大影响观赏效果;(2)旧壳定型法:利用螃蟹自身新陈代谢脱下来的壳,将其定型干燥即可。此法虽然方便且壳中几乎没有肌肉,但是标本外壳硬度极低,甲壳中色素含量也少,只能供观看者了解该蟹的大致形状,且标本不易保存,极易造成标本的不可修复性损伤。使用范围窄,仅当有蟹脱壳时才能使用。
为克服上述弊端,本文介绍了一种新型蟹类干制标本制作方法,可使蟹类标本甲壳中的色素得以最大保留,标本也可呈原生形态展现给观众,标本硬度高,且不易损坏,有助于推动国内蟹类标本制作的发展。
1 材料与方法
1.1 试验材料与器材 螃蟹、切割垫板、牙签、棉签、标本针(根据螃蟹大小而改变)、白乳胶(标本粘胶)、1 mL注射器(带针头)、纸巾、泡沫板、速干胶(UHU德国产)、小刷子、死皮钳、细头镊、吹风机、樟脑、活性炭、大小适宜的标本盒、手术刀(或壁纸刀)、亮油、金刚喷剂(承中牌)、锡丝、KOH(分析纯)、胰蛋白酶(10万单位)以及75%乙醇溶液。
1.2 标本制作之前的准备
1.2.1 观察并测量螃蟹 在制作任何蟹类干制标本之前,首先应该在网络、书籍中尽可能多的观察其自然形态的照片以及视频(图1、2、3)。例如,螯足和步足在自然状态下的姿势;眼睛在自然情况下与眼窝的相对位置;螃蟹正视图中眼睛与头胸甲之间的角度;这些参数在后期整姿中发挥着巨大的作用,甚至还要了解它们的生活习性以便设计标本姿态[3]。若观察活体时,尽可能多的在不同角度进行拍照,以方便后期整姿。

图1 中华绒螯蟹(Eriocheir sinensis)形态模式图[4]1: 头胸甲; 2: 螯足; 3: 第2步足; 4: 第3步足; 5: 第4步足; 6: 第5步足

图2 中华绒螯蟹(Eriocheir sinensis)的步足[4]1: 长节; 2: 腕节; 3: 前节; 4: 指节
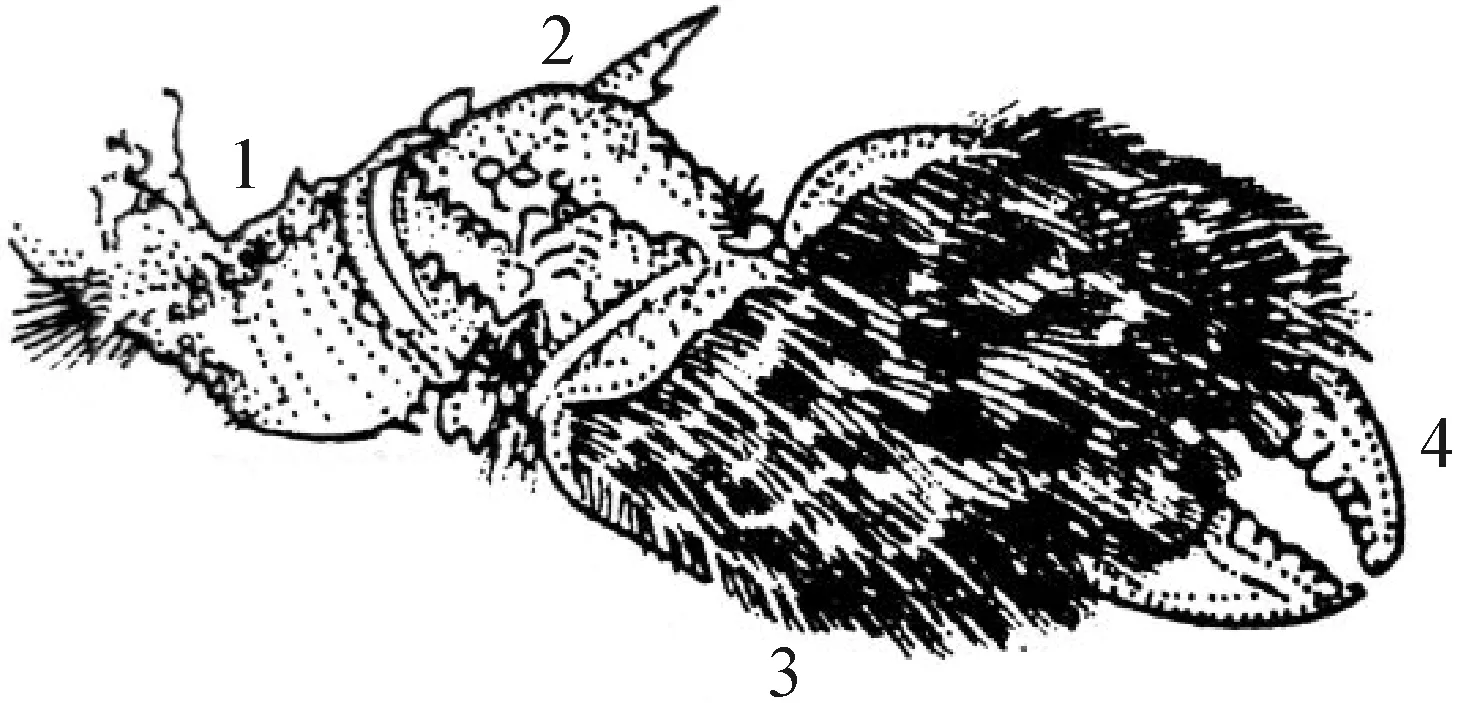
图3 中华绒螯蟹(Eriocheir sinensis)的螯足[4]1: 长节; 2: 腕节; 3: 掌节; 4: 指节
1.2.2 定种及标签的制作 借助书籍、网络和询问蟹类专家,以获得该蟹基本信息[5],如中文名、俗名等。在Word文档中,插入文本框,中文用宋体5号,加粗;英文用宋体5号,加粗(拉丁学名需用斜体),设置文本框边框线条颜色为黑色,粗细为2磅(标签如图4)。将其打印出来,进行过塑,沿标签边缘5 mm剪下,与螃蟹标本配套存放。

图4 标签模板
注意:如有添加特殊内容可自行更改标签格式。
1.2.3 相关溶液的配制 胰蛋白酶溶液配制方法:50 mL水中加入2 g胰蛋白酶(10万单位),然后在100 mL容量瓶中定容后转移至烧杯中,用KOH溶液调节至pH8(胰蛋白酶溶液需现配现用)。在肌肉溶解过程中最好放入38 ℃的恒温箱,可加速肌肉溶解。在肌肉溶解时应多观察,不能过度浸泡,防止组织连接部分也被溶解,对后期粘连造成麻烦。
5%KOH溶液的配制方法:50 mL水中加入5 g KOH固体(分析纯),然后将其转入 100 mL容量瓶,用水添加至刻度线,塞上塞子,摇匀,转移至烧杯即可使用。
1.3 标本制作前螃蟹的处理
1.3.1 蟹的麻醉 将螃蟹放入冰水混合物中浸泡10~20 min,待抓起后无剧烈反抗,即可进行下一步操作。
1.3.2 杀蟹 用1 mL注射器吸取1 mL 95%乙醇溶液,找到螃蟹嘴部偏下的位置,用注射针头轻轻试探(勿伤及螃蟹口前板结构)。当发现有一处针头可轻松插入时,将针头快速插入并将1 mL乙醇溶液完全注射其内,螃蟹1 min左右死亡,这时可能会有螃蟹肢体掉落,属正常现象,对掉落肢体进行标记即可。若为死蟹,当时却无条件制作标本,可用塑料器皿加水没过螃蟹进行冷冻,待有条件时,在自来水流冲刷下进行解冻,解冻后立即进行标本制作[6]。
1.3.3 固定 将已经死亡的螃蟹放入75%乙醇溶液中浸泡至少24 h,进行固定,防止后期长时间制作时腐烂。
1.4 螃蟹的肢解
1.4.1 螯足、步足(泳足)与胸部腹甲之间的分离 参照图5,有一条环绕于附肢的浅沟(也就是蟹类每受到危险时,螃蟹会有断腿现象的分离点),用手术刀的尖端刻该浅沟,然后尝试轻掰是否能断。如果不能则重复上述步骤,此方法可以轻易地将附肢分离,而且分离处边缘十分整齐,有利于后期无缝粘合。

图5 蟹类步足基部折断处[4]1: 分解前; 2: 分解后
注意:因为螃蟹步足的大小、形态极其相似,所以一定要记住每个螃蟹步足的位置,切忌混淆,以防给后来的粘合环节造成极大的困扰。务必在肢解下每一个步足时做好标记(例如左1、左2、右1、右2等)。因为肢解后要继续泡在酒精中,所以可通过腿上绑绳的颜色和圈数来辨识是螃蟹哪个部位的步足。例如:红色绳子代表右边,白色绳子代表左边;绑1圈代表是从上往下第1个步足,绑2圈代表是从上往下第2个步足,以此类推。
1.4.2 头胸甲与胸部腹甲的分离及胸部腹甲和腹脐的分离 固定螃蟹头胸甲,将螃蟹胸部腹甲轻轻掰开,当发现有裂缝出现时,用手术刀尖端轻轻插入将里面链接头胸甲和胸甲的薄膜组织全部划断。此时用手可以更轻松的将其掰开,再用手术刀将腹脐左右两端的连接处割断,再将腹脐从胸部腹甲上慢慢地剥离。
注意:分离时,切勿损坏螃蟹各个部位,螃蟹的每个部位都可能会是粘合的重要部位,若其破碎将会给标本的整体效果带来严重的不良影响。
1.5 螃蟹甲壳中肌肉的去除
1.5.1 螯足、步足及泳足中肌肉的去除 分别在步足上的长节、腕节、前节以及指节连接处可找到类似薄膜的半透明组织(都是成对存在的,每个连接处上下都有,一般上面的较小,下面的较大),用手术刀将其划开,沿着垂直关节运动方向慢慢进行手掰(力量渐增,不可用力一下掰开,这样会对关节结构有较大的破坏,不利于之后的粘合)。然后使用尖头镊、大头针、棉签以及纸巾将里面肌肉尽可能地剔除干净,在胰蛋白酶溶液中浸泡约6 h,观察其中是否还有肌肉残留,若有,适当增加浸泡时间,最后用清水冲洗干净,螯足的肌肉去除环节就完成了。螯足的肌肉去除与步足处理方法相同。若是泳足则需相同的方法处理长节、腕节和前节,指节则直接浸泡胰蛋白酶溶液处理即可。
1.5.2 头胸甲中肌肉的去除 先拿捏子将其肝胰腺与胃剔出来,再拿牙刷将附着在头胸甲内部的黑色物质尽可能地刷干净,然后将其放入胰蛋白酶溶液中约6 h,再拿牙刷清洗,待无明显杂质后,拿清水冲洗干净即可。
注意:头胸甲处理后尽快进行硬化及亮化,这样头胸甲中的色素才能最大程度保持不变。
1.5.3 胸部腹甲中肌肉的去除 拿死皮钳沿鳃生长的地方连同下面的几丁质一同剪去,注意不要破坏边缘以及嘴外部的两片甲,尽量将容易去除的肉去除,然后放入5%KOH溶液24 h,视情况增加时间,待胸甲内部无明显肌肉时,将其拿出,用尖口镊将其中已化为黏液状的肌肉剔除,用清水冲洗干净即可。
1.6 螃蟹的拼接
1.6.1 胸部腹甲与腹脐的拼接 用速干胶填满腹脐内部的腹甲沟,然后将腹脐镶嵌于胸部腹甲,用吹风机将胶吹干,再用白乳胶把胸部腹甲与腹脐之间的缝隙涂1遍,再用吹风机将其烘干。
注意:如果腹部甲片僵硬变白,可以将其放在75%乙醇溶液泡5 min拿出,可以达到软化的效果,使其更好的嵌合胸部腹甲(本文中提到的所有的“用吹风机吹干”的步骤完全可以由“自然风干”代替)。
1.6.2 头胸甲与胸部腹甲的拼接 用速干胶将头胸甲与胸甲接触的边缘涂满,将其粘合,嘴部用白乳胶覆盖一层使其粘紧密,用吹风机吹干,然后用白乳胶填涂连接边缘的缝隙,用吹风机吹干即可。
1.6.3 螯足、步足及泳足散肢拼接 将速干胶打入各个部位(指节除外),打1/3即可,然后将锡丝插入,再将另一部分插入锡丝的另一端。以此类推,将步足、泳足和螯足拼装好,最后再到各个连接处涂一层白乳胶加固,用吹风机吹干即可。
1.6.4 附肢与胸甲的拼接 往胸部腹甲与附肢分离处的洞,打入速干胶然后插入适当长度的锡丝(可视情况多放几根锡丝,多放的锡丝要比最长的那根短),将锡丝另一端再插入附肢中(插锡丝时,插入胸甲一端再无延伸空间时,再将另一端插入附肢中),用白乳胶将拼接处涂抹平整,用吹风机吹干,此步骤重复至少2次。为之后的整姿提供足够的韧性,防止整姿时附肢掉落。
1.7 标本的整姿
1.7.1 眼睛的整姿 眼睛较短的蟹类保持眼睛在眼窝之外即可,用标本针固定眼部之后在眼窝处加满白乳胶,保持姿势自然风干即可。眼睛较长的蟹类制作同上,唯一注意的是眼睛与头胸甲之间的角度,最好遵照本品种螃蟹活体状态下的样子进行制作(例如,日本大眼蟹为72°左右)。
1.7.2 螯足的整姿 正常状态下的螯足的指节与掌节要处于闭合状态,螯足的长节、腕节和掌节也尽量的与头胸甲粘连在一起;攻击状态下的螯足的指节与掌节处于张开状态(张开角度一般都为20°~30° 为宜,特殊品种可视情况改变角度),螯足的长节可与头胸甲相连(也可与头胸甲不相连,视个人喜好改变)腕节,掌节不与头胸甲粘连。
1.7.3 步足的整姿 长节与腕节要保持一定的角度,范围为120°~170°(一般为135°左右)。腕节与前节一般保持180°,指节与前节之间角度范围为90°~150°(一般为135°左右)。最后保证在正面观看下螃蟹是水平的,俯视观看下尽可能对称,造型可从网络寻找同品种螃蟹图片,自行微调。
1.8 硬化与亮化
1.8.1 硬化 使用金刚喷剂,喷口距标本约20 cm,在通风处喷一层薄漆(作业过程中需戴手套、口罩),放置6 h,再重复以上操作1次,即可达到硬化效果。
1.8.2 亮化 在标本外表均匀涂一层亮油,待其自然风干即可。
注意:长绒毛处不要涂亮油,此举会大大影响整体效果,例如:中华绒螯蟹、中华虎头蟹等;还有绒毛或刚毛较多的品种直接无需涂亮油,例如:红毛蟹、棉蟹等。
2 结果
经过本法制作的细纹爱洁蟹干制标本,由于不同部位使用不同化学特性的溶液进行处理,含有色素较多的部位得以保护,减少了色素的溶解,故使细纹爱洁蟹的甲壳得以最大程度的保持原色(中插彩版图6~8);适当的硬化及亮化措施使细纹爱洁蟹标本增加了表光面的亮度和饱满度,标本眼部水灵、饱满、炯炯有神(中插彩版图6、7);白乳胶配合锡丝粘连标本的各个部分,不仅将断裂处几乎恢复至原样(中插彩版图8),而且关节处有锡丝的支持,可以将其整形至自然形态(中插彩版图6),犹如刚从水中拿出来一般栩栩如生。

图6 细纹爱洁蟹(Atergatis reticulatus)干制标本正面观

图7 细纹爱洁蟹(Atergatis reticulatus)干制标本背面观

图8 细纹爱洁蟹(Atergatis reticulatus)干制标本腹面观
3 讨论
3.1 本法对其他甲壳生物的通用性 本法在适用于蟹类的同时,也同样适用于制作甲壳层较厚生物的干制标本,例如:螯虾类、龙虾类以及具足虫类等;但对制作甲壳层较薄生物的干制标本的方法还正处于一个研究阶段。例如:米虾类、长臂虾类等。
3.2 标本的后期维护 蟹类干制标本的附肢连接处都十分脆弱,很容易折断,因此运输时要把标本放入标本盒内,还有标本不宜放在阳光直射的地方,以防标本褪色[7],还要注意不宜放在潮湿、不通风的地方,以免受潮发霉[8]。放标本的地方要适量放入活性炭和樟脑丸,防止标本生虫、长霉。
标本在保存过一段时间后,若发现附肢有破裂,拿白乳胶涂抹在破裂处风干即可,视破裂程度可增加上述操作次数。若发现附肢断裂,拿速干胶涂抹在断面口,然后在缝隙中插入细锡丝,将锡丝固定好,插入断裂端附肢,晾干后,再涂一层白乳胶,风干即可。
3.3 与国内外传统方法的比较及本方法的优点 首先在使用药品方面,本方法使用的药品成本低,方便易得,无毒无味,安全环保,而国内传统方法中的浸制法,因其主要采用福尔马林等对人体有刺激危害的溶液,且在保存过程中易生成多聚甲醛(白色沉淀)的化学性质,需每年更换浸制液,大大增加了标本后期维护的人力与物力。干制标本因为不使用浸制液,所以可以将其近距离手持观察,根据形态差异初步辨别中华绒螯蟹和日本绒螯蟹[9-10]。标本装裱后也可作为家中高档艺术装饰品。在整姿方面,本方法结合锡丝与白乳胶进行连接,加强了标本关节处的机械强度,可按照自己喜好的姿势进行整姿。
肌肉去除是蟹类干制标本中最为重要的环节之一,甲壳中肌肉去除的是否干净直接影响到整个标本的整体效果,在肌肉去除时一定要去除彻底,不然后期残余肌肉腐烂,会导致甲壳变黑,产生刺激性气体,滋生细菌与蛆虫,减短其保存时间,大大降低标本整体效果[3]。与国内一些使用防腐粉法制作蟹类干制标本相比,本法规避以上缺点并且本法采用不同部位使用不同处理方法,头胸甲因其甲壳中虾青素和色素含量较多,故使用化学性质较温和的2%胰蛋白酶溶液处理,胸部腹甲因其虾青素和色素含量较少,故用化学性质较强烈的5%KOH溶液处理。此法对甲壳损伤小,比人工剔肉节省时间,无毒无味,并且使用的试剂成本低,容易获取,安全环保,具有广阔的推广应用价值,可作为以后蟹类干制标本方法的新标杆。

