不同品种绿豆中代谢产物的分离鉴定及代谢机制分析
张丽媛,于英博,赵子莹,于润众,李志江,4,张东杰,3,5,*
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.黑龙江八一农垦大学电气与信息学院,黑龙江 大庆 163319;3.北大荒现代农业产业技术省级培育协同创新中心,黑龙江 大庆 163319;4.黑龙江省杂粮加工及质量安全工程技术研究中心,黑龙江 大庆 163319;5.国家杂粮工程技术研究中心,黑龙江 大庆 163319)
绿豆在我国已有2 000多年的栽培史,绿豆中营养成分丰富[1-2],消化生理实验证明[3],绿豆中的许多低肽不仅能提供人体生长、发育所需营养物质与能量,还具有防治疾病、调节人体生理机能功能[4-6]。绿豆不仅膳食纤维含量较高[7],其所含淀粉在65~90 ℃时表现出较高的膨胀性及显著的热糊黏度稳定性[8]。绿豆还具有降血脂、降胆固醇、抗过敏、抗菌、抗肿瘤等功效[9]。但绿豆性寒凉,泄泻者慎食[10],所有这些功效都与绿豆内部成分和代谢过程有关。
代谢是生命活动中所有(生物)化学变化的总称[11]。代谢活动是生命活动的本质特征和物质基础[12],是多学科交叉[13]的科学,通过研究相对分子质量小于1 000的所有内源性代谢物,从而揭示生命个体代谢活动的本质。到20世纪90年代末,随着基因组学的发展,Oliver在1997年提出代谢组学的概念后[14-15],很多植物学家随之开展了相关的研究[16]。Nicholson等[17]提出了一种新的基于核磁共振的代谢组学法,旨在通过测量对异生物所暴露出的基因组学和蛋白质组学的反应信息,进行进一步的增强和互补,并定义为“定量测量生命系统对病理生理刺激或遗传修饰的动态多参数代谢反应”。进行代谢物整体水平的检测分析[18-19]:必须依赖分析化学中的各种谱学技术获取代谢组数据[20-21],从而提取代谢特征整体变化轨迹[22]。另外,通过代谢组变化获取的“生物标志物簇”也只是代谢组学研究的一个初级阶段性目标,而建立代谢特征或代谢时空变化规律与生物体特性变化之间的有机联系,才是代谢组学研究的根本目标。
大明绿豆品质优良,质地纯正,色泽墨绿,呈圆柱状,富含淀粉和多种营养成分,含脂肪19.8%,含蛋白质40.1%,并含有6 种人体必需的氨基酸,味甘性寒,九鲤湖绿豆颗粒饱满,皮薄圆润,色泽青绿,含丰富的蛋白质和脂肪,口感清甜,有淡香气。本实验通过使用非靶向代谢组学技术分离鉴定2 个品种绿豆的代谢产物,进一步分析了代谢途径差异,并对不同品种绿豆的代谢机制差异探索,以期通过对绿豆代谢产物的分析,为不同品种绿豆的特性差异提供参考,为绿豆的品质改善提供基础信息。
1 材料与方法
1.1 材料与试剂
在黑龙江八一农垦大学寒地杂粮食品安全控制及全程追溯实验教学示范中心食品质量追溯实验室种植获得的绿豆样品,品种分别为大明绿豆(DM)、九鲤湖绿豆(JLH),在相同种植和管理条件下同时生长,同时收获,贮藏在-80 ℃冰箱备用,3 个生物学重复用于代谢产物测定。
2-氯-L-苯丙氨酸、N,O-双(三甲基硅基)三氟乙酰胺(N,O-bis(trimethylsilyl)trifluoroacetamide,BSTFA)上海麦克林生化科技有限公司;吡啶(色谱级,≥99.9%)上海阿拉丁生化科技股份有限公司;甲醇(色谱级)美国Fisher公司。
1.2 仪器与设备
三重四极杆型GC-MS-TQ8040气相色谱-质谱仪(配备电子电离源) 日本岛津技术有限公司;AOC-5000自动进样器、CR3i multifunction型离心机、1 000、200 μL移液枪 赛默飞世尔科技有限公司;DGG-9140A型电热恒温鼓风干燥箱、DRP-9082型电热恒温培养箱上海森信实验仪器有限公司;MTN-2800D氮吹浓缩装置天津奥特塞恩斯仪器有限公司。
1.3 方法
1.3.1 样本预处理
分别取适量样品放入研磨机进行研磨并过100 目筛处理。按四分法进一步取样后分别称取50 mg粉末于2 mL的EP管中,加入800 μL甲醇和10 μL内标(2-氯苯丙氨酸),快速混匀1 min。随后置于4 ℃、12 000 r/min离心15 min,吸取200 μL上清液,转入进样小瓶中氮气吹干。所有实验做3 个平行样。
1.3.2 衍生化处理
取30 μL甲氧铵盐酸吡啶溶液加入氮气吹干以至浓缩后的样品中,快速混匀完全溶解,置于37 ℃恒温箱90 min,取出后加入30 μL的N,O-双(三甲基硅基)三氟乙酰胺,然后置70 ℃烘箱1 h。
1.3.3 色谱条件
色谱柱为Rxi-5Sil MS(30 m×0.25 mm,0.25 μm);升温程序:80 ℃保持2 min;以10 ℃/min升到320 ℃,保持6 min,运行时长32 min;柱温80 ℃,进样口温度240 ℃,进样模式为分流,流量控制模式为恒定线速率,载气为氦气,柱流量为1.20 mL/min,线速率为40.4 cm/s,分流比15∶1。
1.3.4 质谱条件
离子源温度230 ℃,接口温度300 ℃,溶剂切割时间2 min,采集模式Q3 Scan,质量扫描范围m/z45~550。
1.4 数据分析与绘图
实验数据与美国国家标准与技术研究所(National Institute of Standards and Technology,NIST)标准谱库进行对比分析,代谢物信息在京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库中进行搜索,并采用Origin绘图工具制图。
2 结果与分析
2.1 气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)对代谢产物的分离与鉴定
2 种不同品种的绿豆GC-MS总离子流图如图1、2所示,可以看出,样品中各组分分离良好,基线稳定。2 个不同品种绿豆的总离子流图较为相似,但也略有不同。
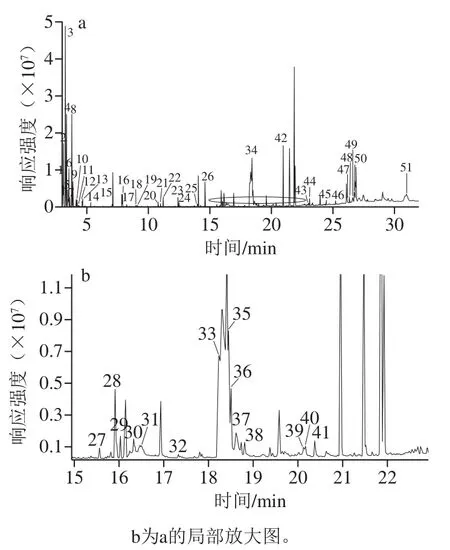
图1 DM代谢产物的总离子流图Fig. 1 Total ion current chromatogram of metabolites in Daming mung beans

图2 JLH代谢产物的总离子流图Fig. 2 Total ion current chromatogram of metabolites in Jiulihu mung beans
数据经过NIST标准谱库进行对比分析,从而确定了代谢产物的结构,分离检测了样品共有67 种代谢产物,其中DM代谢产物有40 种,JLH代谢产物有50 种,包括有机酸、脂肪酸、糖及其衍生物、氨基酸和中间产物,如表1所示。有机酸主要有丁酸、乳酸、2-丁烯二酸、苹果酸、酒石酸、磷酸、柠檬酸、奎宁酸;脂肪酸中含有棕榈酸、亚油酸、亚麻酸、硬脂酸、13-二十碳烯酸、花生酸等;检测到的糖及其衍生物包括D-呋喃果糖、塔罗糖、D-松醇、葡萄糖、β-D-呋喃半乳糖、D-半乳糖、D-甘露糖、蔗糖、β-乳糖、乳糖、2-α-甘露二糖、麦芽糖;氨基酸有L-正缬氨酸、L-缬氨酸、L-脯氨酸、丝氨酸、L-苏氨酸、苯丙氨酸、天冬酰胺、L-谷氨酸、L-苯丙氨酸;醇类包括乙二醇、丙二醇、甘油;糖醇有山梨醇;植物甾醇有菜油甾醇、豆甾醇、β-谷甾醇;中间产物包括氨基甲酸、2-哌啶酸、3-氨基-2-哌啶酮、4-叔丁基-2,6-二甲氧基苯酚、呋喃半乳糖醛酸、月桂酰胺、5-甲基尿苷、肌醇、亚油醇乙醇胺、单硬脂酸甘油酯、甜菜苷、D-生育酚、棕榈酰、2-亚麻酰基-rac-甘油;检测到有机合成化合物萘普生。在DM中氨基酸的总相对含量占10.05%,醇类的总相对含量占1.62%,有机酸的总相对含量占4.97%,糖类的总相对含量占8.98%,脂肪酸的总相对含量占8.99%,植物甾醇的总相对含量占2.24%,中间产物的总相对含量占15.97%;在JLH中氨基酸的总相对含量占19.06%,醇类的总相对含量占2.3%,糖醇的总相对含量占0.05%,有机酸的总相对含量占9.84%,糖类的总相对含量占10.66%,脂肪酸的总相对含量占4.96%,植物甾醇的总相对含量占3.13%,中间产物的总相对含量占9%。根据2 种绿豆各个代谢物种类相对含量的对比发现,DM只有中间产物的相对含量占比高于JLH,其余种类相对含量的占比均低于JLH,JLH绿豆更适合产生有益代谢产物。
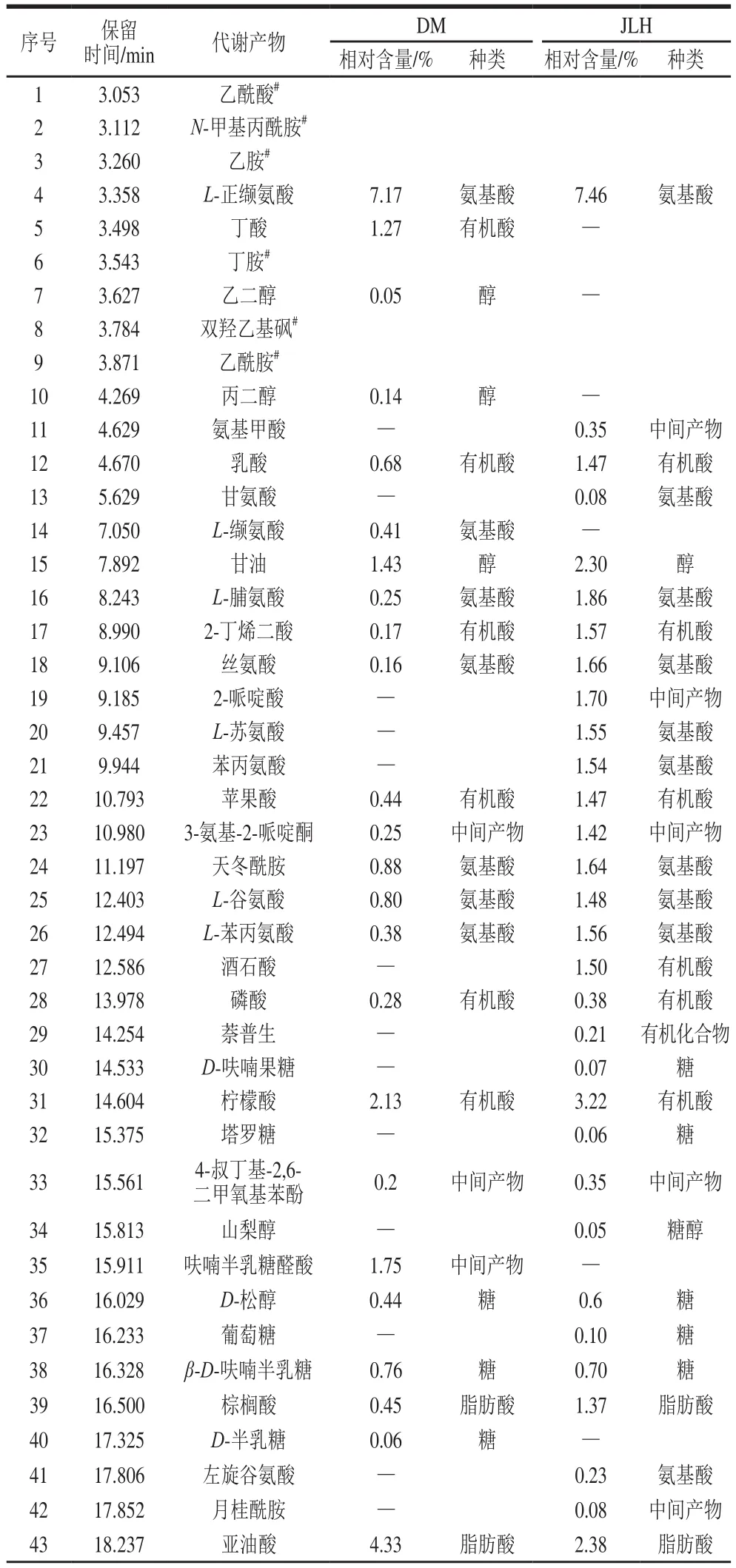
表1 DM和JLH中代谢产物的相对含量Table 1 Contents of metabolites in two cultivars of mung beans
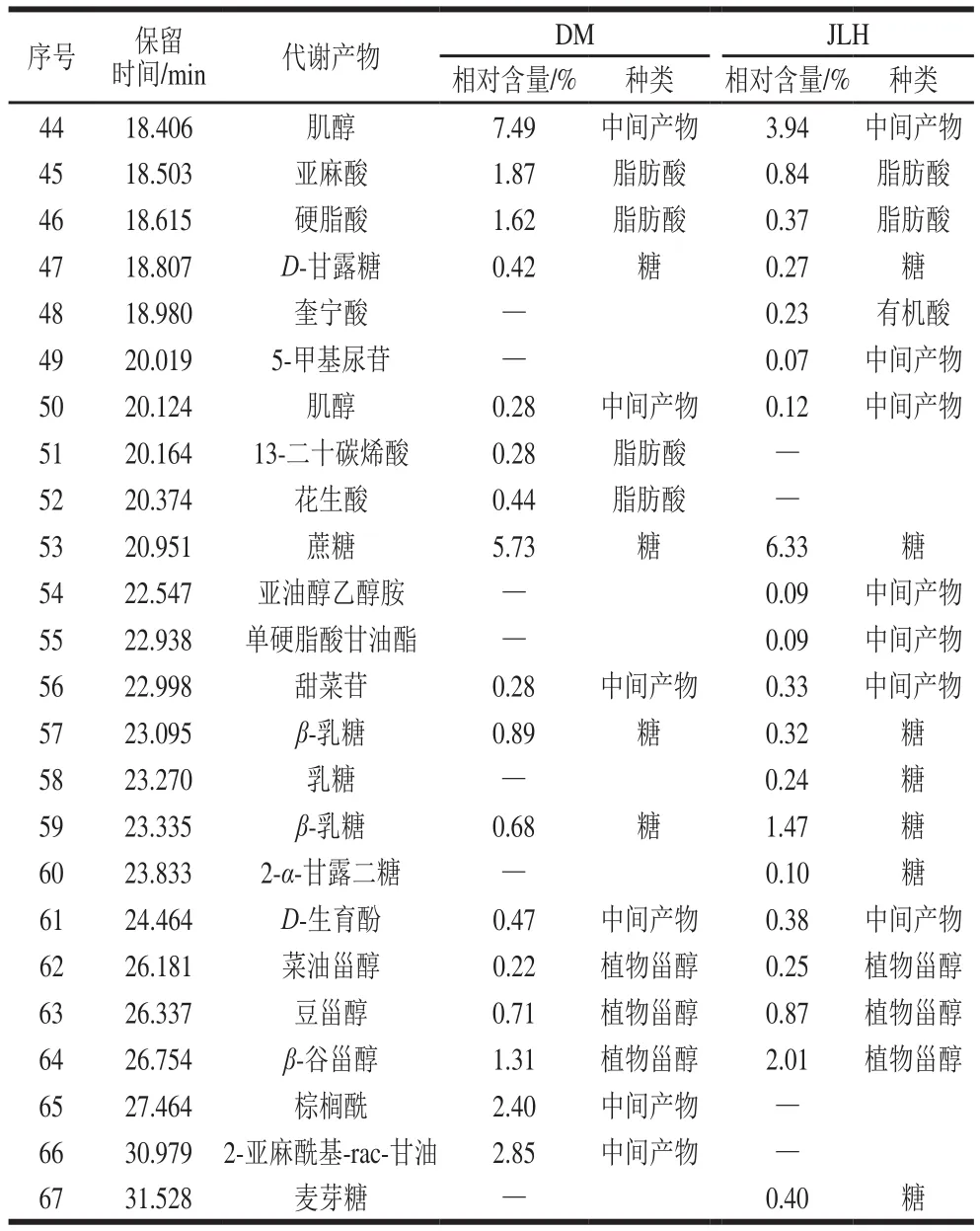
续表1
在被鉴定的全离子分析物中,乙酰酸、N-甲基丙酰胺、乙胺、丁胺、双羟乙基砜、乙酰胺为衍生化试剂形成,在此不作讨论。
2.2 差异代谢物的相对含量及代谢途径分析
2.2.1 DM的差异代谢物及代谢途径分析
如表2所示,通过与JLH的代谢产物对比分析得出,DM共有10 个差异代谢物,分别为丁酸、乙二醇、丙二醇、L-缬氨酸、呋喃半乳糖醛酸、D-半乳糖、13-二十碳烯酸、花生酸、棕榈酰、2-亚麻酰基-rac-甘油。
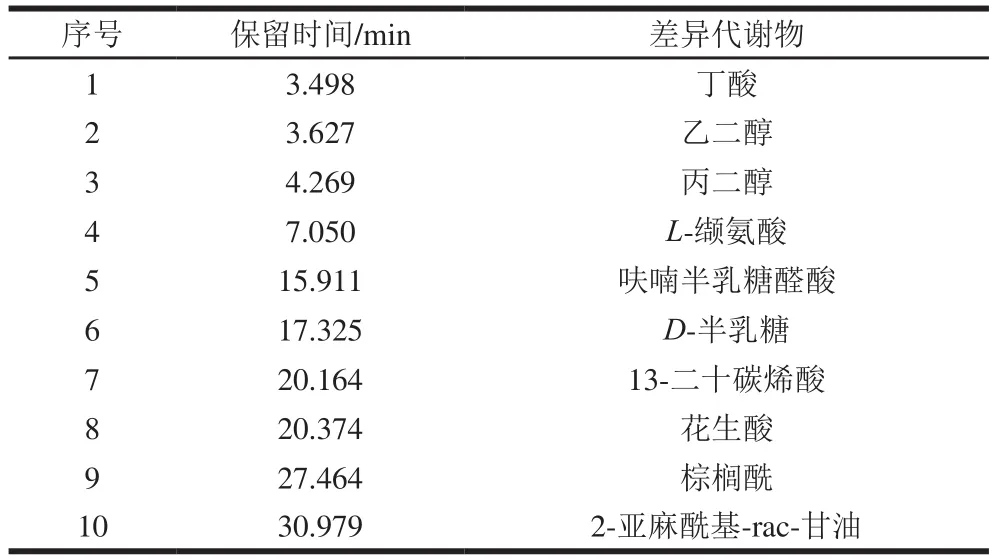
表2 DM的差异代谢物Table 2 Retention times of differential metabolites in Daming mung beans
如图3所示,2-亚麻酰基-rac-甘油、棕榈酰相对含量较高,达到2%以上。
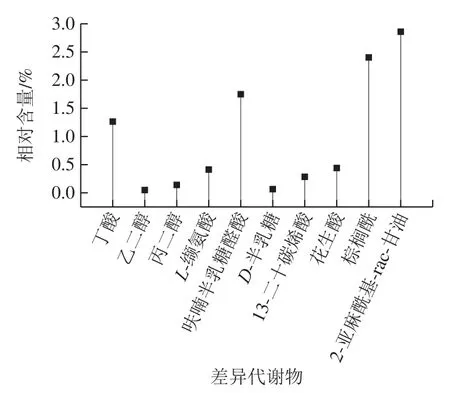
图3 DM的差异代谢物Fig. 3 Relative contents of differential metabolites in Daming mung beans
L-丙氨酸、L-缬氨酸通过氨基酸代谢途径形成;丁酸、2-亚麻酰基-rac-甘油、棕榈酰、花生酸、13-二十碳烯酸、乙二醇、丙二醇通过脂肪代谢途径形成;绿豆细胞内脂肪酸氧化分解为乙酰CoA之后,在乙醛酸体内生成琥珀酸、乙醛酸和苹果酸等代谢产物;此外琥珀酸可用于糖的合成,绿豆内部含有乙醛酸体,在萌发时存在着能够将脂肪转化为糖的乙醛酸循环。
2.2.2 JLH的差异代谢物及代谢途径分析
通过与DM代谢产物对比分析得出,JLH共有20 个差异代谢物,如表3所示,分别是氨基甲酸、甘氨酸、2-哌啶酸、L-苏氨酸、苯丙氨酸、酒石酸、萘普生、D-呋喃果糖、塔罗糖、山梨醇、葡萄糖、左旋谷氨酸、月桂酰胺、奎宁酸、5-甲基尿苷、亚油醇乙醇胺、单硬脂酸甘油酯、乳糖、2-α-甘露二糖、麦芽糖。
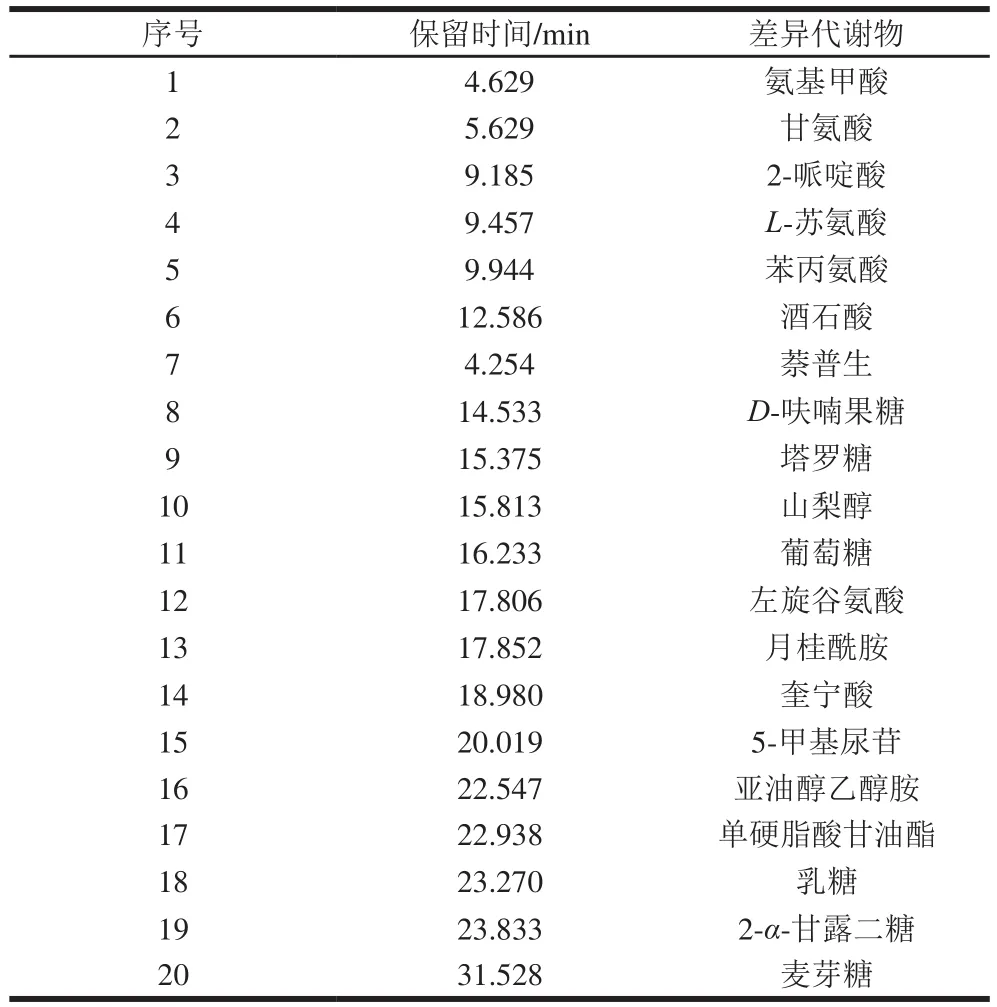
表3 JLH的差异代谢物Table 3 Retention times of differential metabolites in Jiulihu mung bean
如图4所示,2-哌啶酸相对含量最高,其次是L-苏氨酸、苯丙氨酸、酒石酸含量较高,相对含量均达到2%以上。
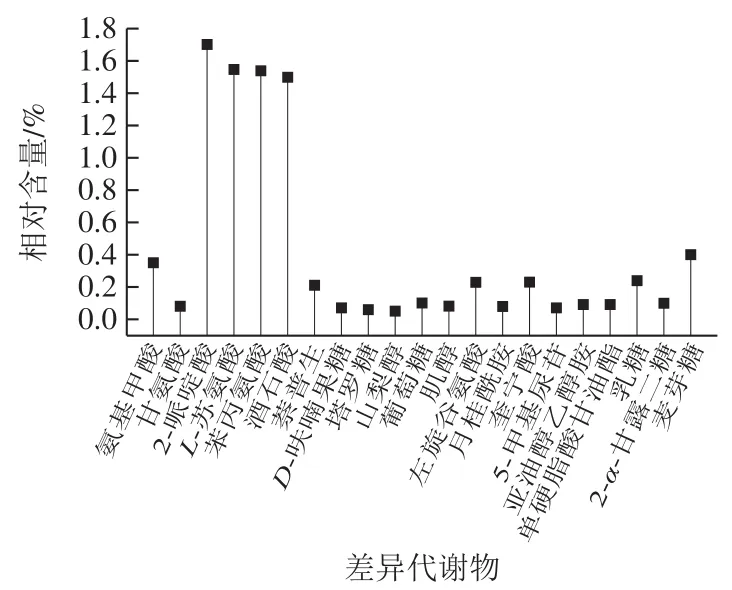
图4 JLH的差异代谢物Fig. 4 Relative contents of differential metabolites in Jiulihu mung beans
在20 种代谢产物中,参与脂类代谢途径的有3 种:月桂酰胺、亚油醇乙醇胺、单硬脂酸甘油酯。磷脂酸与取代基团代谢生成单硬脂酸甘油酯,磷脂酸可由糖和脂转变生成的甘油和脂肪酸生成[23]。乙醇胺是植物中天然存在的脂质生物活性化合物[24],通过氨解二乙醇绿豆体内还有的油脂类物质而得,在油脂的聚氨酯分子骨架上引入绿豆油脂分子,利用油脂中双键醇胺在催化的作用下生成亚麻油酰胺。单硬脂酸甘油酯则推测是通过绿豆内油脂中含有的磷脂酸与取代基团代谢生成单硬脂酸甘油酯。其中磷脂酸可由糖和脂转变生成的甘油和脂肪酸生成。
参与氨基酸代谢途径的有9 种:氨基甲酸、甘氨酸、2-哌啶酸、L-苏氨酸、苯丙氨酸、酒石酸、左旋谷氨酸、奎宁酸、5-甲基尿苷。因为植物的生长需要甘氨酸等多种氨基酸,在组织培养中,植物不能自身合成,必须得有原料。而甘氨酸是很多种氨基酸在生物体内合成的前体物质,在脱氨基转氨基作用时都会用于合成其他物质,因此推测甘氨酸是多种氨基酸脱氨时的代谢物,是绿豆体内胺类物质水解的中间产物。2-哌啶酸是一种非天然氨基酸,由于2-取代衍生物是哌啶酸最常见的衍生物,其是一种经过修饰的非天然氨基酸,常常表现出有效地生物活性,在这些化合物中,4-甲基-2-哌啶酸乙酯是一个关键中间体。因此推测2-哌啶酸可能是通过4-甲基-3,4-烯-6-哌啶酸乙酯的氢化还原4-甲基-2-哌啶酸乙酯而得到[25]。苏氨酸是通过绿豆体内蛋白质水解产生,L-苏氨酸是其具有活性的一类,其在体内的分解代谢中,是唯一不经过脱氨基作用和转氨基作用,而是直接通过苏氨酸脱水酶、苏氨酸脱氢酶和苏氨酸醛缩酶催化转变为其他物质的氨基酸,例如苏氨酸可转变成丁酰辅酶A、琥珀酰辅酶A、丝氨酸、甘氨酸等[26]。苯丙氨酸氨解酶是豆类植物苯丙酸类化合物代谢过程中的一个关键酶,它催化L-苯丙氨酸氨解生成反式苯丙烯酸,依据此酶特异的催化反应降低肿瘤细胞生长所需的苯丙氨酸[27]。
酒石酸即二羟基琥珀酸,是三羧酸(tricarboxylic acid,TCA)循环中的积累形成的。奎宁酸是高等植物特有的脂环族有机酸,奎宁酸还发现在许多植物组织中作为绿原酸等的缩酚酸类组成成分,在植物体内经莽草酸途径作为一种芳香族氨基酸生物合成的前体物质[28],但在代谢上的作用仍未阐明。5-甲基尿苷是生产抗艾滋病药物AZT和d4T的主要原料,可以采用化学合成法和生物合成法生产[29],该代谢产物是鸟苷和胸腺嘧啶在酶的作用下形成的。
参与糖类代谢途径的有7 种:D-呋喃果糖、塔罗糖、山梨醇、D-葡萄糖、乳糖、2-α-甘露二糖、麦芽糖。其中塔罗糖可由葡萄糖或甘露糖经化学反应获得。果糖最常见的六碳酮糖,广泛存在于绿豆中。山梨醇是这些植物的主要光合产物,也是碳水化合物的运输形式和一种可溶性的贮藏碳水化合物,其合成和分解由多种不同的酶经多种途径催化进行,其代谢调节着植物的库源转变和库源强度[30]。在多元醇途径中,葡萄糖经醛糖还原酶催化还原成山梨醇,后者在山梨醇脱氢酶的作用下转变为果糖。塔罗糖、山梨糖醇均是单糖,推测其由葡萄糖或甘露糖经醛糖还原酶催化还原而成。乳糖是由葡萄糖和半乳糖组成的双糖。2-α-甘露二糖于β-1,4-甘露聚糖降解的中间物,麦芽糖是由2 个葡萄糖单位经由α-1,4-糖苷键连接而成的二糖,此外,在本样品差异代谢产物中还发现有萘普生存在,萘普生是一种非甾体抗炎药物[31],在绿豆生化代谢途径中并无该物质的产生,考虑到萘普生常用作化工合成青霉素合成酶抑制剂原料,据此推测此品种绿豆在生长过程中可能因外界药物作用使萘普生最终残留于绿豆中。
2.3 相同代谢产物分析
如图5所示,2 个样品中共有30 种相同代谢产物,其中L-正缬氨酸、肌醇、蔗糖含量较高(>7%)。在30 种代谢物中参与氨基酸代谢途径的有6 种:L-正缬氨酸、L-脯氨酸、丝氨酸、天冬酰胺、谷氨酸、L-苯丙氨酸。
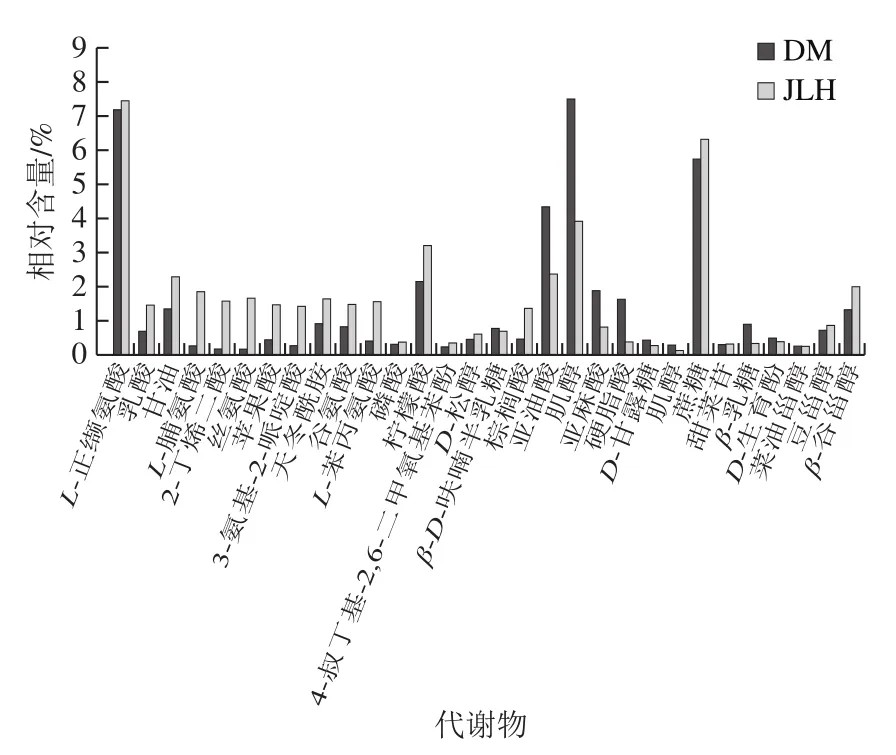
图5 2 种样品的相同代谢产物Fig. 5 Metabolites common to two cultivars
正缬氨酸是缬氨酸的同分异构体,也是一种非蛋白质支链氨基酸,L-正缬氨酸是其具有活性的一类,推测其是由于氨基腈通过水解及脱苄产生。L-脯氨酸是蛋白质组成成分之一,微生物体内的脯氨酸合成途径有2 种,一是以谷氨酸为前体,另一种则以鸟氨酸为前体。绿豆体内L-脯氨酸的生物合成主要是以L-谷氨酸为前体,通过B-proA-pro途径合成的脯氨酸用于合成蛋白质;而在外界高渗透压环境的胁迫下,L-脯氨酸的合成则主要通过proJ-proA-proH途径产生[32]。
参与脂类代谢途径的有5 种:甘油、棕榈酸、亚油酸、亚麻酸、硬脂酸。已有研究[33]说明植物种子中储存的脂肪酸常以三酰甘油酯,即以在甘油骨架上附连3 个脂肪酸的形式存在。而脂肪酸成分主要是16~18碳或含1~3 个双键的脂肪酸,如本实验样品中出现的棕榈酸(C16:0)、硬脂酸(C18:0)、油酸(C18:1)、亚油酸(C18:2)和亚麻酸(C18:3)等。
参与糖代谢途径的有7 种:β-D-呋喃半乳糖、肌醇、D-甘露糖、蔗糖、甜菜苷、β-乳糖、D-松醇。其中肌醇是广泛存在于植物中的一种物质[34],结构类似于葡萄糖,绿豆中的肌醇常为游离状态,是一种由葡萄糖水解产生的碳水化合物。
2-丁烯二酸、苹果酸、柠檬酸参与TCA循环,该循环不仅是糖代谢的重要途径,也是脂肪、蛋白质和核酸代谢的最终氧化成CO2和H2O的重要途径,如糖酵解中形成的磷酸烯醇式丙酮酸可不转变为丙酮酸,而是在磷酸烯醇式丙酮酸羧化酶催化下形成草酰乙酸,草酰乙酸再被还原为苹果酸,苹果酸可经线粒体内膜上的二羧酸传递体与无机磷酸(Pi)进行交换进入线粒体衬质,可直接进入TCA循环;苹果酸在衬质中,也可在苹果酸酶的作用下脱羧形成丙酮酸,或在苹果酸脱氢酶的作用下生成草酰乙酸,再进入TCA循环,可起到补充草酰乙酸和丙酮酸的作用。乳酸则是绿豆在进行无氧过程中的积累。因为DM与JLH所处环境的不同,最终表现出的特性有差异,不同基因型绿豆具有不同开花节位各功能叶片的衰老与活性氧代谢特性,而绿豆叶片衰老和活性氧代谢会直接影响TCA循环的代谢产物。在TCA循环中,由于活性氧代谢的差异性,两者在相同的代谢过程中虽然能产生相同的代谢物,但是代谢物的产量却有差异。
菜油甾醇、豆甾醇、β-谷甾醇参与了类固醇生物合成,植物甾醇是存在于植物中的一大类化学物质的总称,其结构与胆固醇相似,几乎存在于所有的植物性食物中[35],通过在数据库中搜索发现,菜油甾醇由亚甲基胆固醇通过固醇还原酶代谢而成,并且通过类固醇22-α-羟化酶代谢出22-α-羟基樟脑醇,谷甾醇由异岩藻甾醇通过固醇还原酶代谢而成。
3 结 论
本实验基于GC-MS的代谢组学技术对两不同种绿豆中的代谢产物进行分离与鉴定。共鉴定67 种代谢物,DM绿豆有40 种代谢产物,JLH绿豆有50 种代谢产物。而且实验结果发现,DM的代谢产物中氨基酸、糖类、有机酸、脂肪酸、植物甾醇相对含量占比均低于JLH,中间产物相对含量占比较JLH高,可见,JLH相比于DM更容易代谢出有益的代谢产物。其中2 种样品绿豆相同代谢物有30 种,在DM中L-正缬氨酸、亚油酸、肌醇、L-正缬氨酸、蔗糖、亚油酸含量较高,2-丁二烯酸、丝氨酸、4-叔丁基-2,6-二甲氧基苯酚、菜油甾醇含量较低;在JLH中L-正缬氨酸、柠檬酸、肌醇、蔗糖含量较高,D-甘露糖、甜菜苷、β-乳糖、菜油甾醇含量较低。由于样品绿豆种类不同,基因也不完全相同,所得到的代谢产物也存在一定的差异性。在分析2 种样品的差异代谢产物的代谢途径时,DM的差异代谢物中参与脂肪代谢途径的有2 种,参与氨基酸代谢途径的7 种,参与糖代谢途径的有1 种;而在JLH的差异代谢物中参与脂类代谢途径的有3 种,参与氨基酸代谢途径的有9 种,参与糖类代谢途径的有7 种,并且发现了萘普生。由此可见,JLH的代谢过程相比大明绿豆的代谢过程更为复杂。此研究为绿豆品质分析提供理论基础,也为绿豆分类加工或分品种提取功能性成分提供依据。

