竹叶提取物和敲除转录因子DAL80对酿酒酵母精氨酸代谢的调控互作影响
刘小杰,娄行行,陈启和,*
(1.上海城建职业学院,上海 201415;2.浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
黄酒为中国著名的发酵酒,含有氨基酸、多肽、低聚糖、多糖以及酚类化合物[1-2],但黄酒在发酵过程中会产生风险化合物,如氨基甲酸乙酯(ethyl carbamate,EC),其对人体具有潜在的遗传毒性和致癌性[3-4],黄酒中EC的含量明显高于其他酒类[5],因此降低黄酒中EC含量对黄酒产业的可持续发展具有重要意义。EC通常是由乙醇与尿素自发反应形成的,因此通过控制尿素以减少黄酒中EC是控制其含量的主要思路之一[6]。黄酒中的尿素一部分来源于食品原料,另一部分来源于酿酒酵母对精氨酸(arginine,Arg)的降解作用[7-8]。多年来,许多研究者均致力于探究发酵食品中EC的控制方法,目前主要从优化生产工艺[9-10]、外源添加脲酶分解尿素[11-12]、基因工程手段修饰发酵菌株[13-15]、外源添加天然产物调控Arg降解[16]等方面展开研究。
在酿酒酵母中氮代谢阻遏效应相关基因的转录水平受4 个GATA家族转录因子GLN3、GZF3、GAT1、DAL80和1 个全局调控蛋白Ure2p的调控。其中,DAL80不仅能调控氮代谢阻遏效应相关基因的表达,也能与其他因子调控彼此的表达[17]。焦志华[18]的研究表明敲除酿酒酵母BY4741中的DAL80可以降低黄酒中38.5%的EC含量。竹叶提取物(bamboo leaves extract,BLE)作为食品添加剂,具有抗氧化、抑制有害物质的生成等作用[19-20]。BLE加入黄酒会抑制EC的形成,其具有多种作用机制[16,21-22]。目前,控制黄酒酿造EC的方法集中于使用一种手段,较少将2 种及以上的方法联合使用。因此,本实验添加BLE,并结合GATA家族转录因子中氮阻遏代谢转录调控因子DAL80的敲除手段,阐明二者对酿酒酵母细胞Arg代谢的互作调控机制。
1 材料与方法
1.1 材料与试剂
酿酒酵母BY4741(MATa、his3Δ1、leu2Δ0、met15Δ、ura3Δ0),酿酒酵母DAL80敲除菌(DAL80Δ),实验室-80 ℃保藏。
BLE 浙江圣氏生物科技有限公司;蛋白胨、酵母提取物、L-精氨酸盐酸盐、L-亮氨酸、酵母氮源(yeast nitrogen base,YNB)(含硫酸铵) 生工生物工程(上海)股份有限公司;L-组氨酸、L-甲硫氨酸、尿嘧啶阿拉丁试剂(上海)有限公司。
总蛋白浓度测定试剂盒 生工生物工程(上海)股份有限公司;精氨酸酶活力测定试剂盒 美国博世生物技术有限公司;酵母RNA提取试剂盒 美国Omega公司;PrimeScriptTMRT reagent Kit with gDNA Eraser、TB GreenTMPremix ExTaqTMII 日本Takara生物工程株式会社。
酵母膏胨葡萄糖琼脂(yeast extract peptone dextrose,YPD)培养基:酵母提取物、蛋白胨、葡萄糖质量分数分别为1%、2%、2%;Arg培养基:质量分数1.7%YNB(含硫酸铵)、质量分数2%葡萄糖、20 mmol/LL-精氨酸盐酸盐、10×氨基酸混合物(包含200 mg/LL-组氨酸、1 000 mg/LL-亮氨酸、200 mg/LL-甲硫氨酸、200 mg/L尿嘧啶);配制不同质量浓度的BLE(0、150、300、500 mg/L)标准溶液,过滤除菌,4 ℃保存。
1.2 仪器与设备
1510酶标仪 美国Thermo Fisher公司;ZQLY-300振荡培养箱 上海知楚仪器有限公司;JY92-IIDN超声波细胞破碎仪 宁波新芝生物科技股份有限公司;JP-040S超声清洗仪 深圳市洁盟清洗设备有限公司;Agilent 1200色谱仪、VORTEX-5涡旋仪 广州永程设备有限公司;DD-5M大型离心机 湖南湘仪实验室仪器开发有限公司;5417R桌面离心机 德国艾本德股份公司;SIM-100超微量可见分光光度计 杭州新景生物试剂开发有限公司。
1.3 方法
1.3.1 菌株生长性能评价
通过生长曲线、湿质量测定、点板实验和细胞活力测定,综合评价BY4741和DAL80敲除菌在BLE存在时的生长规律,具体操作参见张伟平等[17]研究。
1.3.2 发酵液和胞内尿素含量的测定
Arg培养基中培养48 h的酿酒酵母BY4741和DAL80敲除菌培养液于室温、4 000 r/min离心10 min,取上清液检测发酵液尿素含量。收集细胞用去离子水重悬,再以相同条件离心后重悬。最后弃上清液,加入10 mL去离子水重悬细胞,将离心管置于冰上,用超声波细胞破碎仪破碎细胞10 min,离心得上清液检测胞内尿素。将试剂I(硫酸120 mL、磷酸50 mL、FeCl30.05 g、蒸馏水330 mL)和试剂II(0.5 mg/mL的二乙酰一肟、0.1 mg/mL的硫铵脲)按体积比2∶1混合,制成显色剂。将2.5 mL显色剂加入0.5 mL样品,沸水浴反应15 min后迅速冷却至室温,在526 nm波长处检测吸光度变化[23]。
1.3.3 Arg含量的测定
采用高效液相色谱法在线衍生法测定发酵液或破碎后细胞液中的Arg含量[24]。
1.3.4 精氨酸酶活力的测定
胞内蛋白提取:收集培养的酵母细胞2 mL,于4 ℃、4 000 r/min离心10 min,弃上清液,用磷酸盐缓冲液重悬,相同条件离心2 次并弃上清液,用400 μL的Tris-HCl缓冲液(pH 7.4)重悬细胞,加入4 μL 10 mmol/L苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)溶液和4 μL的150 mmol/L二硫苏糖醇(dithiothreitol,DTT)溶液,超声破碎细胞15 min,吸取上清液,用总蛋白浓度试剂盒测定总蛋白浓度。用精氨酸酶活力试剂盒测定精氨酸酶活力。1 个单位酶活力(U)定义为:pH 7.4、30 ℃时,每分钟将1 μmol/L Arg转化为尿素和鸟氨酸所需的酶量。
1.3.5 氮代谢相关基因转录水平的实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)检测
将菌株培养48 h后,用酵母RNA提取试剂盒提取酵母总RNA,用超微量可见分光光度计测定提取RNA的浓度及质量,基因组DNA去除反应体系如表1所示,42 ℃保温2 min后置于冰上。逆转录PCR体系(20 μL)如表2所示,37 ℃保温15 min,85 ℃热激5 s后保存于4 ℃。长期保存于-20 ℃或更低温度。引物由杭州有康生物科技有限公司设计并合成,引物序列见表3,保存于-20 ℃。real-time PCR体系(20 μL)如表4所示。real-time PCR程序如表5所示,以ACT1基因作为内标基因,用real-time PCR荧光定量数据分析(2-ΔΔCt法),对扩增基因进行相对定量分析。
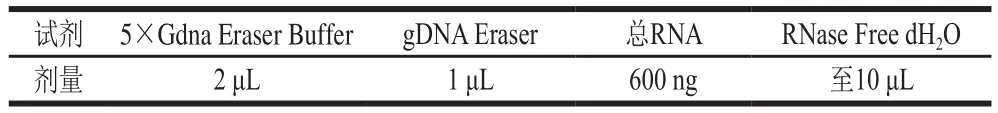
表1 基因组DNA去除反应体系Table 1 Reaction system used for genomic DNA removal

表2 逆转录反应体系Table 2 Reverse transcription reaction system

表3 引物序列Table 3 Primer sequences used in this study

表4real-time PCR体系Table 4 Real-time PCR reaction system
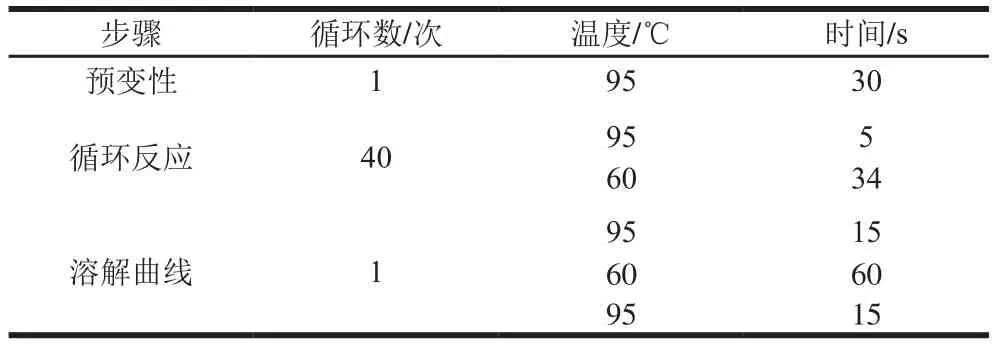
表5real-time PCR程序Table 5 Real-time PCR reaction procedures
2 结果与分析
2.1 BLE对酿酒酵母BY4741细胞生长及代谢的影响
2.1.1 BLE对BY4741生长的影响
通过生长曲线检测、湿质量测定、点板实验和细胞活力测定,对BY4741在不含(对照组)和含不同质量浓度BLE的Arg培养基中生长性能进行评价。如图1A、B所示,BY4741在不同质量浓度BLE处理下的生长曲线差异不大,发酵48 h后,各组间的湿质量差异也不大,仅BLE 500 mg/L质量浓度组略有降低。点板实验表明,各组间菌落形态及数量差异均不大(图1C)。细胞活力实验(图1D)结果表明,培养24 h后各组间细胞活力无显著差异,其中BLE 500 mg/L质量浓度组略有降低,故BLE对BY4741的生长无显著影响。通过如图1所示的4 个生长性能评价实验的结果可知,在质量浓度0~500 mg/L范围内,BLE对BY4741菌的生长影响不大,这意味着BLE添加可以进行后续氮代谢水平相关研究,也为BLE在实际发酵过程的应用提供前提条件。
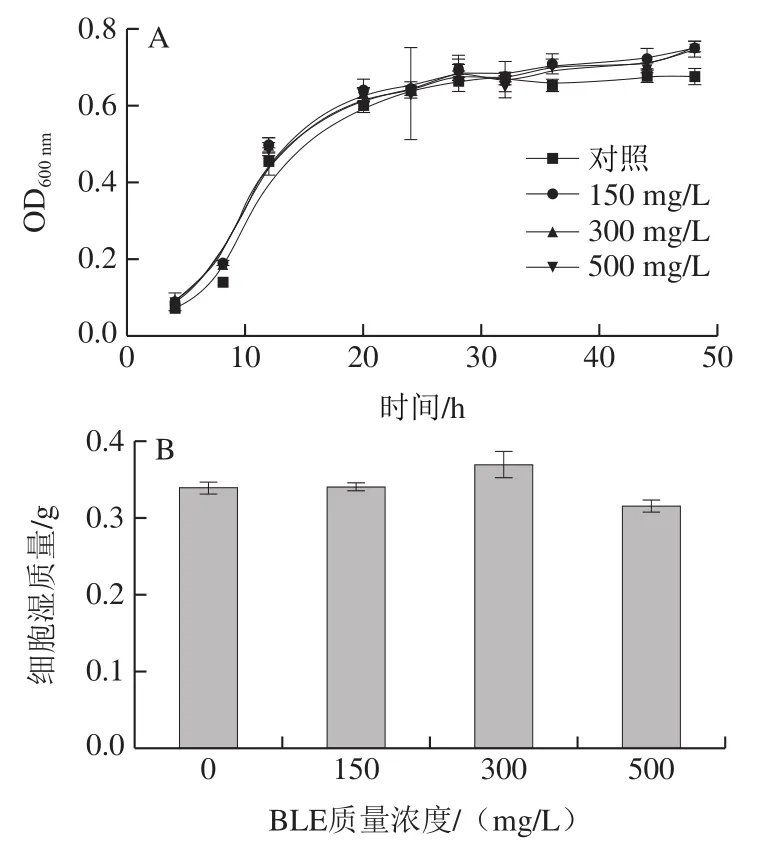
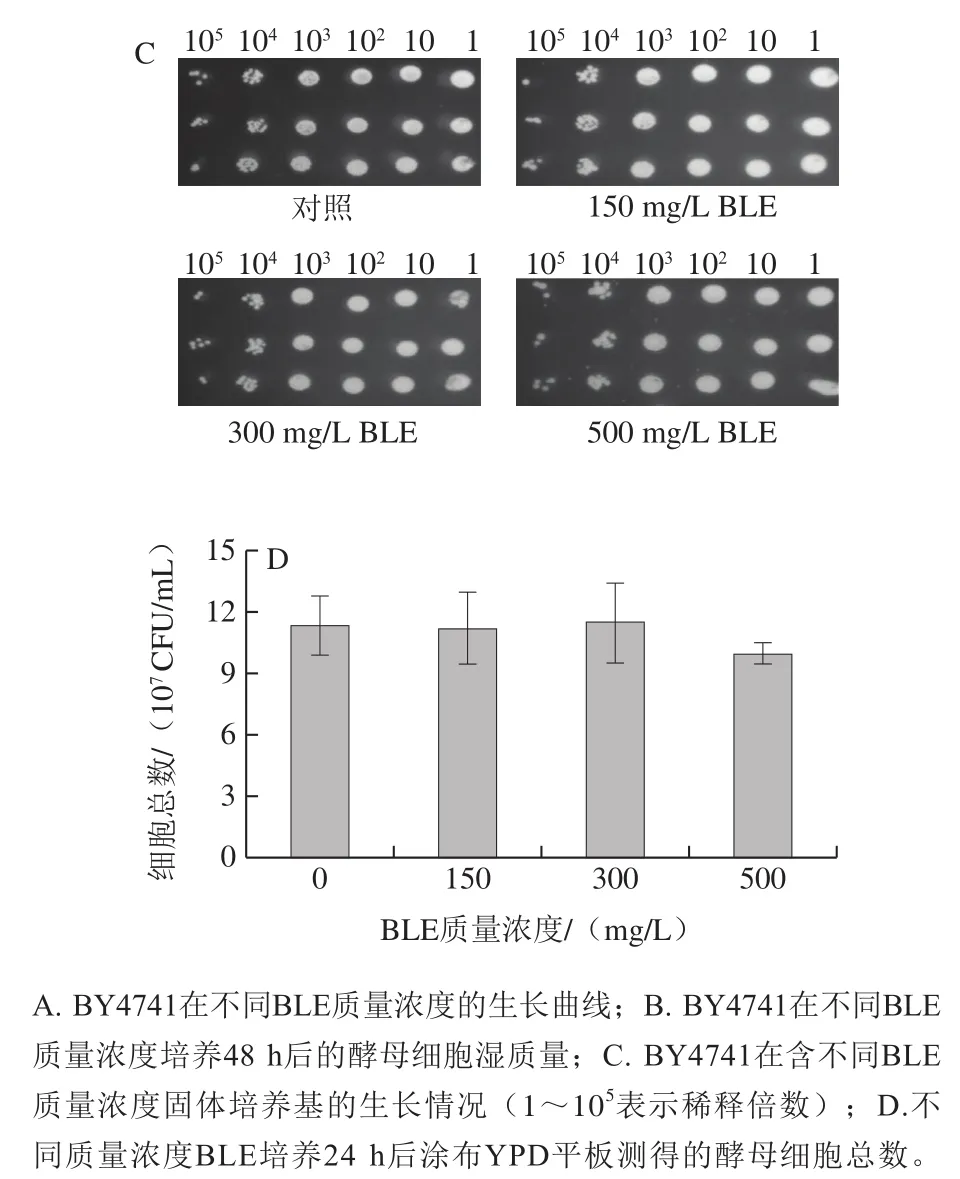
图1 BLE质量浓度对含有Arg培养体系中的BY4741生长的影响Fig. 1 Effects of different BLE concentrations on the growth of BY4741 in culture medium containing Arg
2.1.2 BLE对BY4741细胞氮代谢的影响
尿素和Arg是酿酒酵母氮代谢过程的重要物质,其中尿素可以与乙醇自发反应生成EC,而Arg在精氨酸酶的作用下,可以降解产生尿素。因此,为探究BLE在黄酒模拟发酵体系中可能的氮代谢调控作用,利用Arg培养基培养BY4741酵母,通过比较BY4741发酵过程中尿素和Arg代谢水平,探究BLE对BY4741细胞氮代谢的调控作用,结果如图2所示。
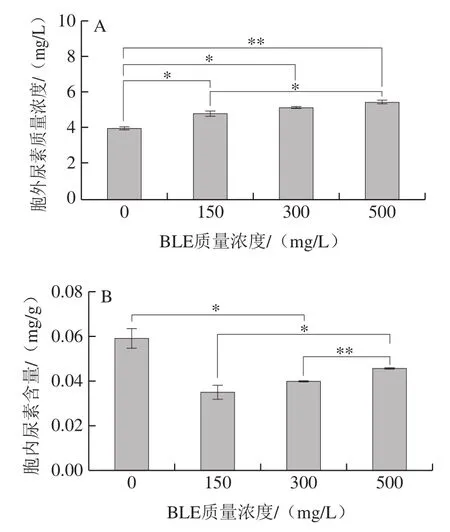
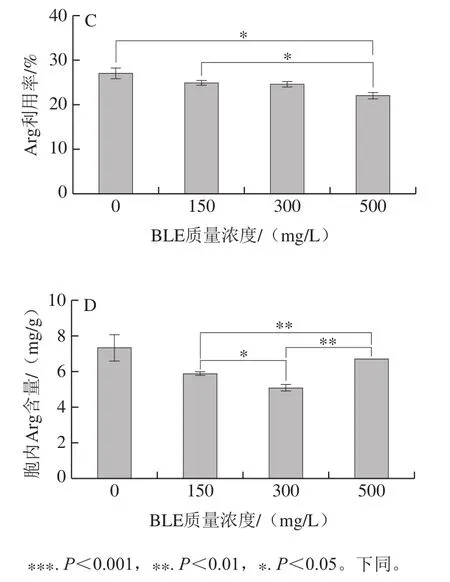
图2 BY4741在不同BLE质量浓度结束发酵时发酵液尿素含量(A)、胞内尿素含量(B)、发酵液Arg利用率(C)、胞内Arg含量(D)Fig. 2 Effects of different BLE concentrations on urea concentration in fermentation broth (A), intracellular urea concentration (B), Arg utilization rate in fermentation broth (C), and intracellular Arg concentration (D) of BY4741
添加BLE会增加BY4741发酵液中尿素积累,且添加质量浓度越高,效果越明显;当添加质量浓度为500 mg/L时,发酵液中尿素积累明显增多。胞内尿素处理组的积累较对照组更低,但随着BLE质量浓度的增加,BLE对尿素积累的影响减弱。胞外的尿素质量浓度越高,胞内的尿素含量随之降低,可能是BLE中的某些物质影响尿素的转运或者尿素的重吸收,也可能是BLE影响尿素代谢酶活力,如尿素羧化酶和脲基甲酸盐水解酶活力[25]。BLE还降低了胞内Arg的积累,但与对照组相比,BLE对其影响不显著。值得注意的是,添加BLE降低了BY4741细胞对Arg的利用率,说明BLE可能抑制Arg的分解代谢,添加质量浓度为500 mg/L的影响最为突出。这说明添加BLE后,发酵液中积累的尿素并不能仅归因于培养基中Arg的降解,还可能是BLE影响尿素的进一步代谢,其他物质合成尿素等因素导致尿素的积累,但这需要深入研究。因为BLE能降低Arg的利用率,且影响程度与BLE质量浓度呈正相关,所以选择500 mg/L BLE作为后续研究的添加质量浓度。
2.2 BLE与转录因子DAL80对酿酒酵母氮代谢途径的影响
2.2.1 BLE对DAL80敲除菌株和野生型BY4741生长的影响
通过生长曲线、湿质量测定、点板实验和细胞活力测定实验评价BLE对DAL80敲除菌和野生型BY4741的生长影响,BLE添加质量浓度为500 mg/L,结果如图3所示。首先CK组2 株菌的生长曲线差异不大,仅在20~25 hDAL80敲除菌株的OD600nm比野生型BY4741略高;质量浓度500 mg/L BLE组中2 株菌的生长曲线也差异不大,几乎重合。对照组和质量浓度500 mg/L BLE组的生长曲线差异不大(图3A)。在发酵48 h后,所有菌株的对照组细胞湿质量略高于500 mg/L BLE组;而在添加相同剂量BLE时,敲除DAL80后细胞湿质量有所提高(图3B)。从图3C可知,2 组间菌落形态及数量差异均不大。细胞活力实验显示培养24 h后,500 mg/L BLE组细胞的活力高于对照组(图3D)。上述实验说明,敲除DAL80和添加500 mg/L BLE对酵母菌的生长几乎没有影响。
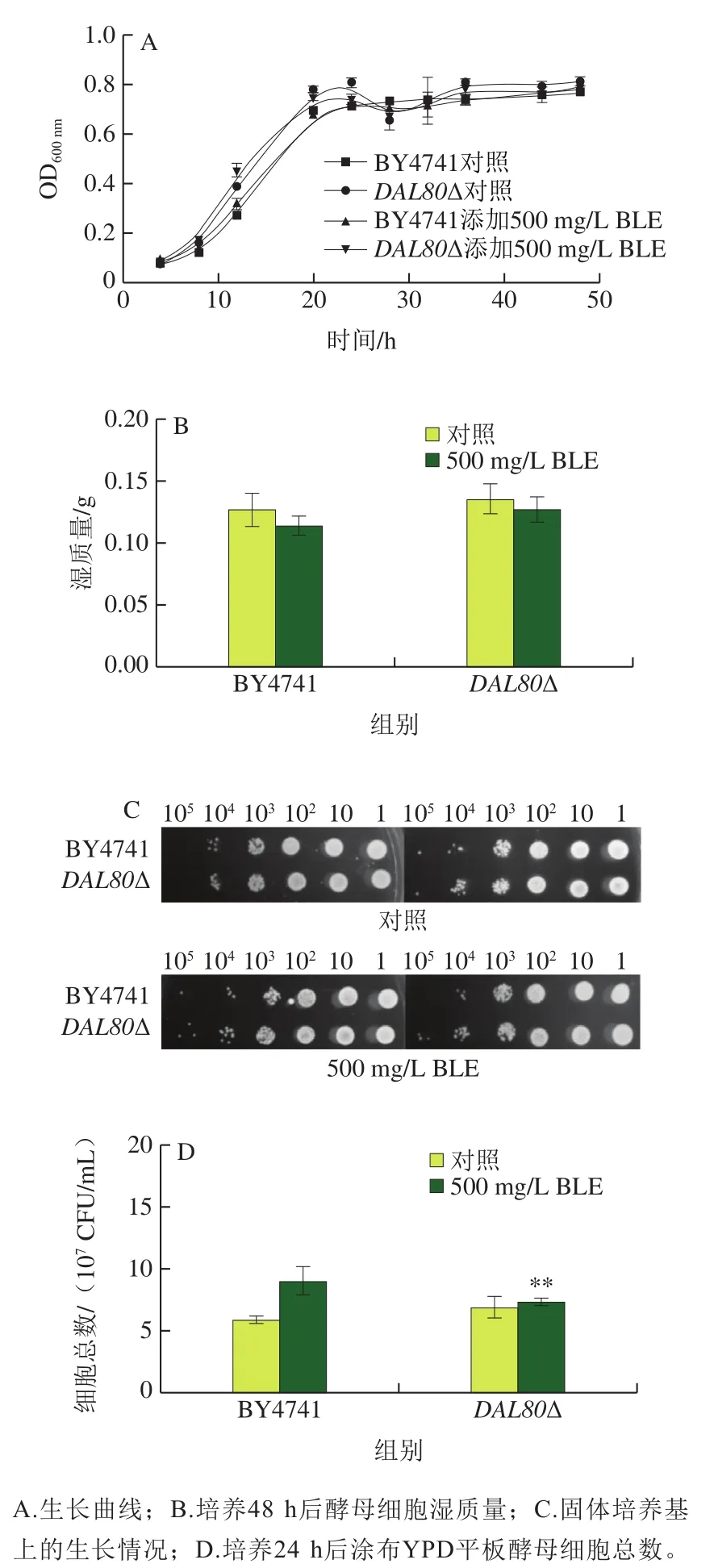
图3 500 mg/L BLE对DAL80敲除菌和BY4741生长的影响Fig. 3 Effects of 500 mg/L BLE on cell growth of BY4741 and DAL80Δ
2.2.2 BLE对DAL80敲除菌和野生型BY4741的Arg及尿素代谢水平的影响
如图4所示,相较于野生型酵母菌株BY4741,敲除DAL80提高酿酒酵母胞外尿素含量、Arg利用率及精氨酸酶活力,分别提高54.8%、27.3%、71.1%。BLE处理后,DAL80敲除提高精氨酸酶活力,BLE的干预使得提高幅度降低4.2%,其原因可能为DAL80抑制精氨酸酶编码基因(如CAR1)的转录,而BLE也有相似的作用。DAL80敲除菌的Arg利用率和精氨酸酶活力均呈现相同的变化趋势,这说明DAL80敲除菌中BLE略微影响Arg利用率和精氨酸酶活力,但敲除DAL80对二者的影响更突出,因此DAL80的敲除对酿酒酵母氮代谢的影响占主导作用。
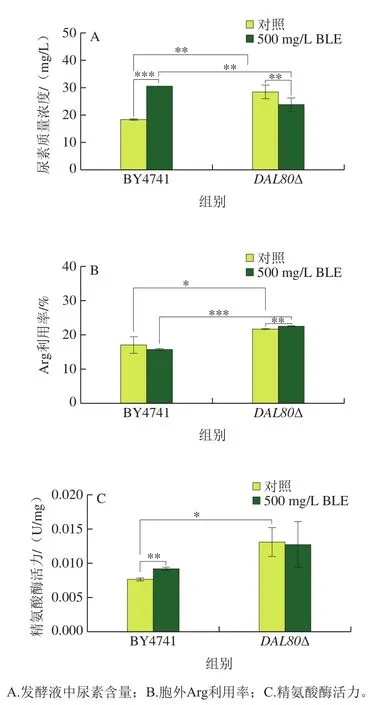
图4 DAL80敲除菌和BY4741在BLE处理下的代谢水平Fig. 4 Metabolic levels of DAL80Δ and BY4741 in culture medium containing bamboo leaf extract
2.2.3DAL80敲除菌和BY4741中Arg及尿素代谢相关基因的表达水平
采用real-time PCR继续检测氮代谢相关基因的表达水平,可以从转录水平进一步解释DAL80敲除菌和BY4741的氮代谢水平差异。基因表达倍数差异表示为2-ΔΔCt,其中ΔCt为目的基因与内参ACT1的Ct值差,ΔΔCt为目的基因在不同样本中的ΔCt值差。BY4741菌相比于不含BLE的处理方式,在BY4741添加500 mg/L BLE与不添加BLE培养基中氮代谢有关基因转录水平差异倍数之比如图5所示,DUR1,2、ALP1、GAP1的转录水平均有较显著提高,GZF3和DAL82的转录水平显著降低,DAL81的转录水平被略微抑制。其中,ALP1和GAP1的转录水平提高幅度最大,分别提高至2.7 倍和7.6 倍,这意味着BLE主要提高酿酒酵母的氨基酸透性酶编码基因的转录表达水平。
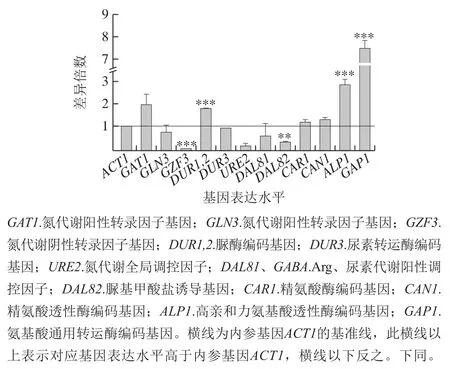
图5 BLE处理对BY4741氮代谢相关基因表达水平的影响Fig. 5 Effect of bamboo leaf extract on nitrogen metabolism-related gene expression levels in BY4741
如图6所示,DAL80的敲除显著提高GZF3、DUR1,2、DUR3、ALP1、DAL82、GLN3、CAR1、CAN1和GAP1的转录表达水平,说明这9 个基因均受到DAL80的调控,其中GZF3、DUR1,2、DUR3、ALP1的转录水平大幅提高,其分别提高至野生型酵母BY4741与四者对应基因的29.0、23.9、42.1、25.3 倍。此前已有报道,DUR1,2、DUR3、DAL82、GAP1的转录水平受到DAL80的负调控作用,GZF3在阻遏型培养基上受到DAL80的负调控作用[21,26],而GLN3与DAL80间的相互调控作用值得关注。DUR1,2编码尿素羧化酶和脲基甲酸盐水解酶,酿酒酵母胞内尿素的降解主要是在这2 种酶的连续作用下分解为二氧化碳和胺盐;DUR3编码尿素转运酶,将分泌到胞外的尿素重吸收进入胞内由尿素转运酶参与完成。DUR1,2和DUR3的大幅过表达利于酵母细胞内尿素的降解,减少尿素从细胞内转移到发酵液中,有利于降低发酵液中EC含量[17,27]。CAR1编码精氨酸酶,用来将Arg水解成为鸟氨酸和尿素[28];CAN1和ALP1分别编码Arg透性酶和高亲和力氨基酸透性酶[29]。CAN1、ALP1和GAP1的过表达利于Arg的分解和转运[30],可能对细胞的Arg利用率有提高作用。在DAL80敲除菌中,DAL81的转录表达水平被大幅抑制,说明DAL81的表达可能需要DAL80的诱导。张伟平等[17]报道,Gln3p诱导DAL82的表达,而DAL81p阻遏DAL82的表达,在本研究中,敲除DAL80后,DAL81的表达水平被抑制,而GLN3和DAL82的表达水平显著提高,且DAL82提高的倍数大于GLN3,其原因可能是GLN3诱导DAL82的表达,DAL81抑制DAL82的表达,当诱导作用加强,抑制作用减弱,则DAL82的表达水平提高得更多,与张伟平等[17]的研究结果一致。
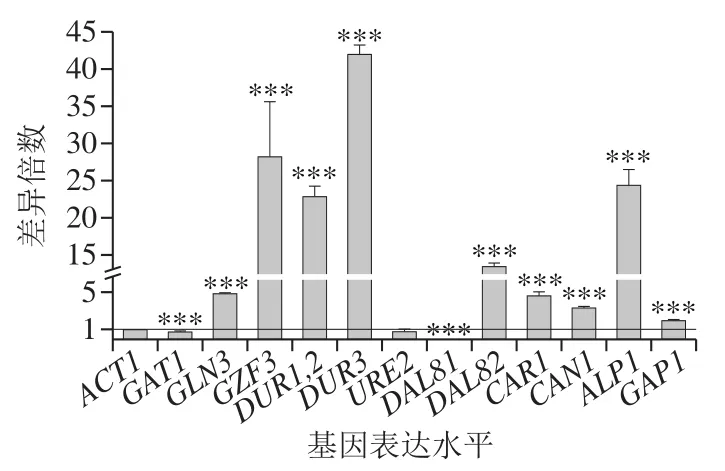
图6 DAL80敲除菌和BY4741氮代谢相关基因表达水平差异Fig. 6 Nitrogen metabolism-related gene expression levels in DAL80Δ and BY4741
在BLE处理下,DAL80敲除菌氮代谢相关基因表达水平普遍降低,其中较为显著的是GAT1、DUR3、DAL81、DAL82、CAR1、CAN1、ALP1和GAP1。DAL80敲除菌在添加500 mg/L BLE与不添加BLE培养基中基因表达水平差异倍数结果如图7所示,BLE的干预会削弱DAL80敲除的调控影响。
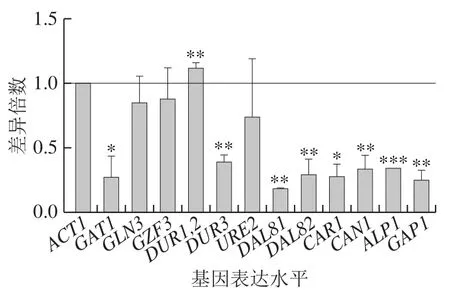
图7 BLE处理对DAL80敲除菌氮代谢相关基因表达水平的影响Fig. 7 Effect of BLE on nitrogen metabolism-related gene expression levels in DAL80Δ
敲除酿酒酵母BY4741中的DAL80基因,同时在培养基中加入500 mg/L BLE,DAL80敲除菌在500 mg/L BLE培养基与BY4741在不含BLE培养基中基因表达水平差异倍数结果如图8所示。尽管BLE降低部分基因的转录表达水平,GLN3、DUR1,2、DUR3、DAL82和ALP1的转录表达水平仍有明显提高,说明与BLE的调控影响相比,转录因子DAL80在酿酒酵母细胞氮代谢中的抑制调控作用更为突出。
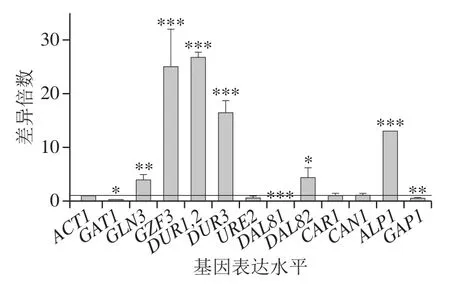
图8 DAL80敲除和BLE处理对BY4741氮代谢相关基因表达水平的影响Fig. 8 Effect of DAL80 knockout and BLE on the expression of nitrogen metabolism-related genes in BY4741
3 结 论
本实验研究BLE与酿酒酵母细胞GATA家族转录因子DAL80对黄酒酿造中酿酒酵母细胞Arg代谢网络的调控及其互作影响。在培养酿酒酵母BY4741时,添加BLE可以降低Arg利用率,敲除DAL80会提高氮代谢有关基因(DUR1,2、DUR3、ALP1、DAL82、GLN3、CAR1、CAN1和GAP1)的转录表达水平。当两者同时作用时,BLE的干预会削弱DAL80敲除带来的影响,但DAL80敲除对酿酒酵母氮代谢的影响仍占主导地位。

