婴儿肠道源格氏乳杆菌的安全性评价及益生特性
周钦育,许喜林,赵 珊,黄燕燕,邝嘉华,胡金双,刘冬梅
(华南理工大学食品科学与工程学院,广东 广州 510641)
人体肠道菌群位于胃肠道中,是复杂且动态平衡共生的微生物群落,包含约1 000 种不同的共生物种(古细菌、细菌、真菌、酵母菌和病毒)[1]。在健康的肠道菌群中,有益微生物占主导地位,并具有多种功能,如促进宿主对营养物质的吸收、增强机体代谢能力、调控维生素和激素的合成、抑制病原体生长等[2]。肠道菌群失衡会使肠道功能紊乱,并带来与此相关的多种慢性疾病,包括癌症、炎症、心血管疾病、自身免疫性疾病、神经系统疾病和精神疾病等。补充含益生菌的饮食可重新调节菌群失调,排除潜在危害并加强身体的自然防御机制[3]。
益生菌被广泛应用于食品工业中,其对宿主健康起到的作用也被许多学者研究。García-Ruiz等[4]发现乳酸菌属益生菌会产生B族维生素,分泌乳酸链球菌素或有机酸等抗病原体的代谢产物。Yadav等[5]发现鼠李糖乳杆菌MTCC 5957和发酵乳杆菌MTCC 5898可下调氧化应激作用,胆固醇降低,具有抗糖尿病的特性。Kim等[6]发现植物乳杆菌K 10具有抗肥胖的作用。益生菌的治疗效果和应用技术特征随菌株种类改变,且具有很大差异,因而挖掘新型益生菌具有重要意义。同时,新益生菌应被证明无毒,且在宿主的胃肠道中有良好定殖性后,才有可能发挥功效[7-8]。Španová等[9]发现人源性菌株更适宜在人体胃肠道中生存,哺乳婴儿肠道及母乳中分离的乳杆菌属是乳品益生菌的重要来源,具有更特异性的健康促进作用。
格氏乳杆菌(Lactobacillus gasseri),又称为加氏乳杆菌,是同型发酵乳酸菌[10],天然存在于胃肠道、阴道或母乳中,被美国FDA定义为一般公认安全类添加剂(generally recognized as safe,GRAS)状态微生物[11]。Kullen等[12]在2001年首次分离出格氏乳杆菌,对其DNA杂交模式研究后,明确了格氏乳杆菌与其他乳杆菌的16S rRNA基因区别。由于我国菌种研究起步较晚,且格氏乳杆菌的发现也较晚,目前国内对于格氏乳杆菌的报道多集中在阴道、肠道菌群的分离、筛选、鉴定及生长特性的研究中[13-15]。国外学者对格氏乳杆菌的益生性研究在近几年已经成为热点,发现其在食品、医药行业具有广大应用前景[16-18],但对婴儿肠道源格氏乳杆菌的研究仍然有限,大多数被研究的格氏乳杆菌来自于人类阴道。
本实验从广州1 月龄婴儿肠道中分离、鉴定出1 株格氏乳杆菌,将其命名为格氏乳杆菌LGZ 1029,对其进行安全性评价,包括溶血检测、耐药性实验以及动物急性毒理实验。以具有良好黏附性能和益生功能的商业菌株鼠李糖乳杆菌(L.rhamnosus)ATCC 7469为对照,对格氏乳杆菌LGZ 1029的益生特性进行探究,包括胃肠道定殖能力、抑菌能力及抗氧化能力的测定,旨在发掘格氏乳杆菌LGZ 1029作为新型益生菌的潜力。
1 材料与方法
1.1 材料与试剂
SPF级KM小鼠20 只,体质量18~22 g,4 周,小鼠及饲料由广东省医学实验动物中心提供(生产许可证号:SCXK(鲁)2014-0007)。
格氏乳杆菌LGZ 1029由华南理工大学食品质量与安全实验室从广州1 月龄婴儿肠道粪便中分离筛选得到,并于2019年4月29日保存于广东微生物菌种保藏中心,保存的菌株编号为GDMCC 60641。
鼠李糖乳杆菌ATCC 7469、大肠杆菌(Escherichia coli)ATCC 25922、金黄色葡萄球菌(Staphylococcus aureus)ATCC 12598 广东省微生物菌种保藏中心;细菌DNA提取试剂盒 生工生物工程(上海)股份有限公司;基础MRS培养基、LB培养基、哥伦比亚血琼脂平板广东环凯微生物科技有限公司;胃蛋白酶1∶3 000、胰蛋白酶1∶250、1,1-苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 上海源叶生物科技有限公司;Triton X-100、乙二胺四乙酸二钠、Tris、K-B药敏纸片、磷酸盐缓冲液(phosphate buffered saline,PBS)(均为分析纯) 广州卯林试剂有限公司。
1.2 仪器与设备
MK3型超净工作台 上海日岛科学仪器有限公司;LRH-250A-II型生化培养箱 韶关市泰宏医疗器械有限公司;JW-3021HR型高速冷冻离心机 安徽嘉文仪器装备有限公司;CYTATION5型紫外分光光度计 美国博腾仪器有限公司;680型多功能酶标仪 美国Bio-Rad公司;Five Easy Plus型pH计 梅特勒-托利多仪器(上海)有限公司;MHY-28473型麦氏浊度计 北京美华科技有限公司。
1.3 方法
1.3.1 菌株的分子生物学鉴定
调整洪颖等[19]的方法进行菌株DNA的提取。首先从纯菌落平板上刮菌到已灭菌的生理盐水中,调至麦氏浊度为1.5,吸取1.5 mL菌液至离心管,于室温、12 000 r/min离心5 min,去除上清液,沉淀重悬于180 µL缓冲液中(20 mmol/L、pH 8.0的Tris;2 mmol/L EDTA-2Na;体积分数为1.2% Triton X-100;终质量浓度为20 mg/mL溶菌酶),37 ℃处理30 min后,采用细菌DNA提取试剂盒提取格氏乳杆菌DNA,用核酸蛋白检测仪确认OD260nm/OD280nm为1.8左右,然后以该DNA为模板,采用细菌16S rDNA的通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-TACGGTTACCTTGTTACGACT-3’),进行聚合酶链式反应(polymerase chain reaction,PCR),其中PCR扩增条件为:95 ℃预变性5 min;98 ℃变性15 s;55 ℃退火30 s,72 ℃延伸2 min,进行30 个循环;72 ℃延伸5 min。PCR扩增结束后,凝胶电泳检测回收,在-20 ℃保存。将纯化后的PCR产物送至广州基迪奥生物技术有限公司进行测序。
将上述DNA测序得到的菌株序列导入基本局部比对检索工具(basic local alignment search tool,BLAST)中,参考田亚晨等[20]的方法,利用MEGA 6.0软件构建系统进化树。
1.3.2 菌株的安全性评价
1.3.2.1 溶血实验
将活化好的格氏乳杆菌LGZ 1029以及质控菌株大肠杆菌ATCC 25922用已灭菌的接种环划线接于血平板中,37 ℃恒温培养48 h,观察平板中菌落周围有无溶血圈出现并拍照记录。
1.3.2.2 抗生素耐药性实验
选用K-B药敏纸片扩散法进行格氏乳杆菌的耐药性评价[21]。取活化后的浓度约为1.0×108CFU/mL格氏乳杆菌菌液0.1 mL,均匀涂布于灭菌后冷却凝固的MRS琼脂培养基表面。将K-B药敏纸片用无菌镊子贴至琼脂表面,室温放置40 min,然后在37 ℃恒温培养箱中倒置培养24 h,再用精确度为0.01 mm的游标卡尺测量抑菌圈直径并记录,每种抗生素平行实验3 组,同时以金黄色葡萄球菌ATCC 12598作为对照菌。耐药性的判断参考美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)于2015年公布的药敏试纸标准M100—S25《抗菌药物敏感性的性能标准》[22]。
1.3.2.3 小鼠经口急性毒理实验
受试物为含格氏乳杆菌LGZ 1029的菌液,浓度为1×108CFU/mL。实验采用限量法,只设10.0 g/kg(体质量计)剂量组,即取经检验检疫合格的小鼠20 只,雌雄各半。实验前动物禁食过夜,不限制饮水。空腹灌胃1 次,每次灌胃容量为20.0 mL/kg。若染毒则要立即观察并记录中毒表现,以及死亡数和死亡时间,观察期为14 d。
1.3.3 菌株的益生特性分析
1.3.3.1 胃肠液耐受性实验
根据Maragkoudakis等[23]的方法进行胃液耐受性评价。将活化后的格氏乳杆菌LGZ 1029菌液按10%的接种量接种至pH值分别为2.0、2.5、3.0、4.0的人工胃液中,混合均匀,于37 ℃培养0、1、2、3 h后取样,进行平板菌落计数,同时设添加与人工胃液等体积的蒸馏水为空白对照组。
根据Guo Zhuang等[24]方法进行肠液耐受性评价。将活化后的格氏乳杆菌LGZ 1029菌液按体积比为10%的接种量接种于人工肠液中(pH 8.0),于37 ℃培养0、2、4、6、8 h后取样,进行平板菌落计数,同时设添加与人工肠液等体积的蒸馏水为空白对照组。按式(1)计算格氏乳杆菌在人工胃肠液中的存活率。
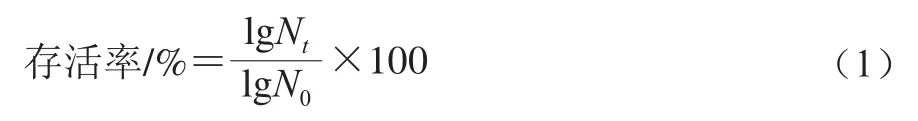
式中:Nt为乳杆菌在人工胃肠液处理th后存活的数量/(CFU/mL);N0为0 h时乳杆菌的活菌数/(CFU/mL)。
1.3.3.2 胆盐耐受性实验
根据Maragkoudakis等[23]方法进行胆盐耐受性评价。取活化后的格氏乳杆菌菌液按体积分数为10%的接种量分别接种于含牛胆盐(0.1、0.2、0.3、0.5 g/100 mL)的MRS液体培养基中,于37 ℃培养0、1、2、3、4 h后取样,进行平板菌落计数,设置无胆盐的空白对照组。按式(2)计算格氏乳杆菌在含胆盐培养基中的存活率。
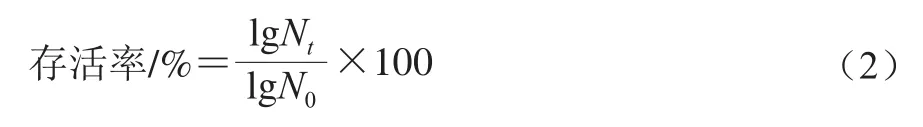
式中:Nt为乳杆菌在含胆盐的MRS培养基中处理th后存活的数量/(CFU/mL);N0为0 h时乳杆菌的活菌数/(CFU/mL)。
1.3.3.3 黏附性实验
黏附性实验以广泛应用的商业菌株鼠李糖乳杆菌ATCC 7469为对照菌株,测定2 株菌的自凝聚能力及疏水能力。
自凝聚能力的测定:将乳杆菌在MRS培养基中37 ℃孵育24 h后,于4 ℃、8 000 r/min离心10 min收集菌体,再用灭菌的PBS(pH 7.4)清洗2 次,离心条件同上,最后再用PBS重悬菌体,使菌悬液的初始OD600nm值为0.5±0.02。将菌悬液在37 ℃放置24 h,分别在第0、2、4、6、24小时取上清液,以无菌PBS为空白对照,于600 nm波长处检测吸光度。按式(3)计算菌株的自凝聚能力。
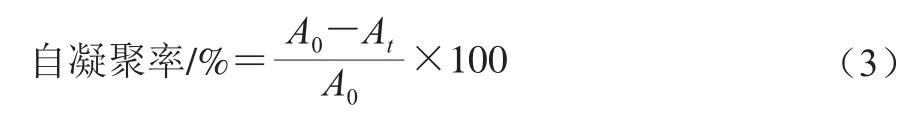
式中:At为t时刻的吸光度;A0为t=0时的吸光度。
疏水性的测定:同自凝聚能力测试中菌液处理,使乳杆菌的菌悬液初始OD600nm值为0.5±0.02。取适量菌悬液,加入等体积的二甲苯,旋涡振荡2 min后,约25 ℃室温放置30 min,分两相,以无菌PBS为空白组,于600 nm波长处检测下层水相的吸光度。按式(4)计算菌株的疏水性。
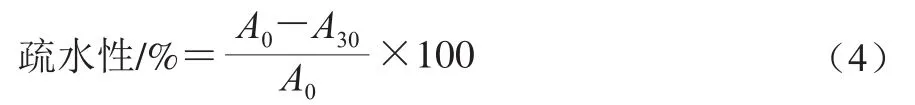
式中:A30为二甲苯振荡处理30 min后的吸光度;A0为t=0时的菌悬液吸光度。
1.3.3.4 抑菌能力测定
参考刘冬梅等[25]测定抑菌能力的方法进行修改。以大肠杆菌ATCC 25922和金黄色葡萄球菌ATCC 12598为指示菌种,取无菌生理盐水,将2 株致病菌稀释至浓度为106~107CFU/mL,再取菌液0.1 mL均匀涂布于LB琼脂培养基表面,将牛津杯中心对称放置于培养基表面,每个牛津杯内注射100 μL待测样品液。将平板置于4 ℃扩散24 h后置于37 ℃恒温培养箱,培养24 h,观察并测量抑菌圈直径大小。
1.3.3.5 抗氧化能力测定
参照田圆圆等[26]方法测定乳杆菌DPPH自由基清除能力。首先称取0.007 8 g DPPH,用无水乙醇溶解并定容至100 mL制得0.2 mmol/L DPPH乙醇溶液,室温避光放置,现配现用。将2.0 mL待测样品与2.0 mL 0.2 mmol/L DPPH乙醇溶液混合均匀,室温避光放置30 min,于室温、8 000 r/min离心10 min,取上清液于517 nm波长处测定吸光度。按式(5)计算菌株的自由基清除率。
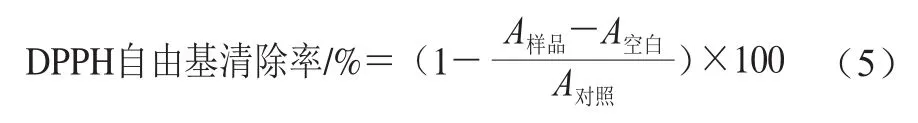
式中:A样品为待测样品加等体积DPPH乙醇溶液的吸光度;A空白为待测样品加等体积无水乙醇的吸光度;A对照为PBS加等体积DPPH乙醇溶液的吸光度。
1.4 数据处理
用MEGA 6.0软件构建系统进化树。采用Excel、SPSS Statistics 19.0软件对数据进行统计分析。采用OriginPro 9.1进行绘图。
2 结果与分析
2.1 菌株的鉴定结果
经16S rDNA测序后,在NCBI数据库中挑选出合适的菌株,与测试乳杆菌进行比较,构建进化树,作系统分析,结果如图1所示,测试乳杆菌与各已知序列的格氏乳杆菌的同源性较大,结合生理生化特征分析,确定菌株为格氏乳杆菌种,将其命名为LGZ 1029,于2019年4月29日保存于广东微生物菌种保藏中心,保存的菌株编号为GDMCC 60641。
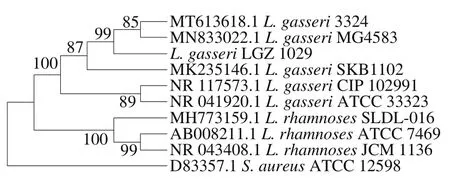
图1 格氏乳杆菌LGZ 1029的进化树Fig. 1 Phylogenetic tree constructed for L. gasseri LGZ 1029
2.2 菌株的安全性
2.2.1 菌株的溶血活性评估
乳酸菌在代谢过程中可能会产生溶血毒素溶解血红细胞,导致贫血等反应出现[27]。血平板划线法是有效检测细菌溶血性的方法,溶血检测结果如图2所示,图2a的质控菌株大肠杆菌ATCC 25922菌落周围出现明显的透明溶血圈,结果呈阳性,而图2b的格氏乳杆菌LGZ 1029长出乳白色菌落,周围没有明显溶血圈,呈阴性结果,可说明格氏乳杆菌LGZ 1029及代谢产物对血细胞无损伤性。
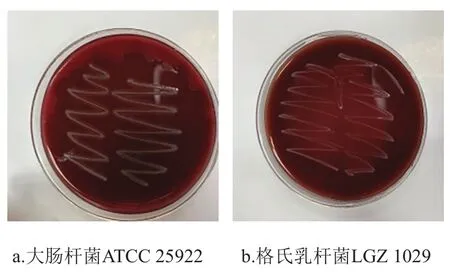
图2 溶血活性检测结果Fig. 2 Results of hemolysis test
2.2.2 菌株的耐药性评价
格氏乳杆菌LGZ 1029的抗生素耐药性标准及检测结果分别如表1和表2所示,选取的抗生素种类包括多肽类的万古霉素、大环内酯类的红霉素、四环素、青霉素类的氨苄西林以及氨基糖苷类的卡那霉素。由表1、2可知,质控菌株金黄色葡萄球菌ATCC 12598对各抗生素产生的抑菌圈直径均在S范围内,说明抗生素有效,可以用于鉴定菌株的耐药性。格氏乳杆菌LGZ 1029对各类抗生素产生的抑菌圈直径均在S范围内,即格氏乳杆菌对其均不具有抗性。检测依据为美国CLSI制定的相关标准[22]。
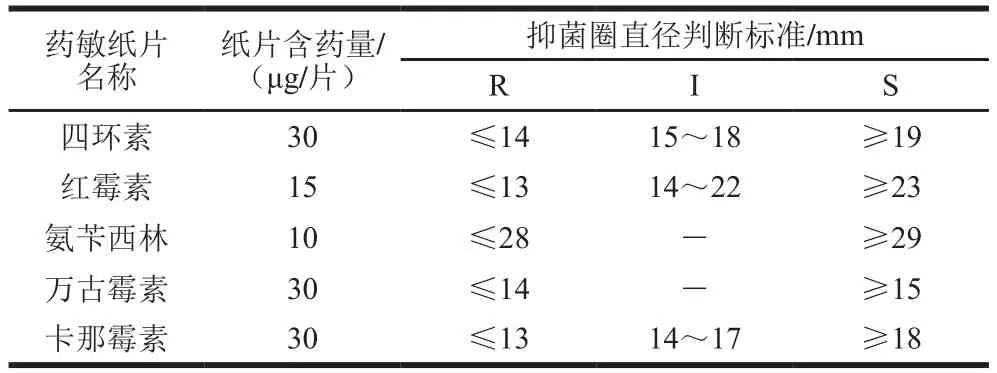
表1 药敏纸片含药量及耐药性判断标准Table 1 Drug load on drug sensitive discs and judgment criteria for drug resistance
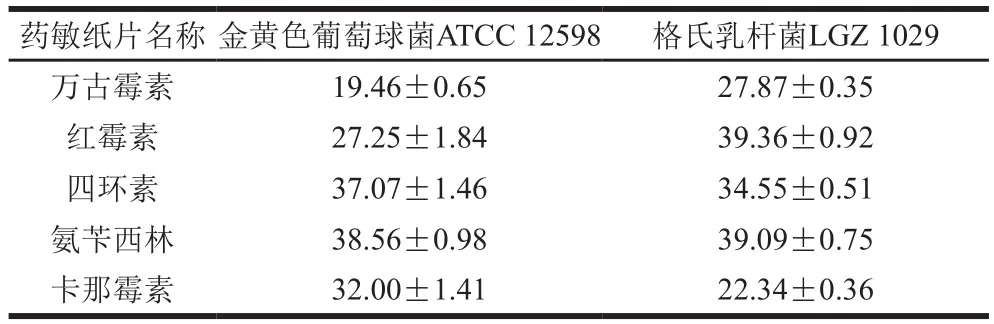
表2 抑菌圈直径及抗性结果Table 2 Inhibition zone diameters mm
2.2.3 菌株的动物毒理性评价
益生菌株在投入食品使用前,还要进行更多的体内安全性评价,因此实验先进行了小鼠急性毒理实验以验证格氏乳杆菌LGZ 1029的安全性。结果如表3所示,灌服菌液后,观察期内没有发现小鼠出现中毒症状或者死亡,小鼠体质量正常升高,实验期内无异常表现。实验结束后,对存活的动物解剖,肉眼未见异常。由此可知,活菌数为1×108CFU/mL的格氏乳杆菌LGZ 1029菌液对雌雄性KM小鼠急性经口毒性的半致死率(lethal dose of 50%,LD50)大于10.0 g/kg,属于无毒级食品。
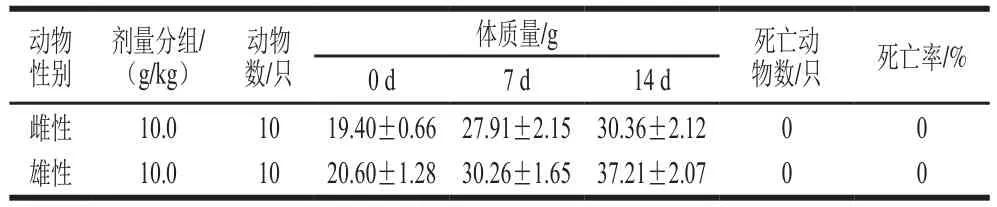
表3 受试物对小鼠经口急性毒性实验结果Table 3 Acute oral toxicity evaluation of L. gasseri LGZ 1029 in mice
2.3 菌株的耐受性
2.3.1 胃肠液耐受性
图3为格氏乳杆菌LGZ 1029在人工胃液中的存活率结果,在人工胃液中培养3 h后,格氏乳杆菌在pH 2.5~4.0的存活率均保持在95%以上,存活率无显著差异(P<0.05),而在pH 2.0的人工胃液中培养3 h,存活率仍有87.27%。益生菌在胃肠道内的存活率是评价益生菌的益生潜力的重要参数。因此,耐受模拟胃肠液是评价益生菌作用发挥的基本指标[28]。陈晓华等[15]在研究格氏乳杆菌的益生性质时,发现菌株在pH 2.0的人工胃液中存活率仅为71.43%,李文静等[29]研究乳酸杆菌的益生性质时,发现菌株在pH 3.0的模拟胃液中存活率范围是82.22%~91.65%。相比而言,本实验格氏乳杆菌LGZ 1029对胃液的耐受能力较强。
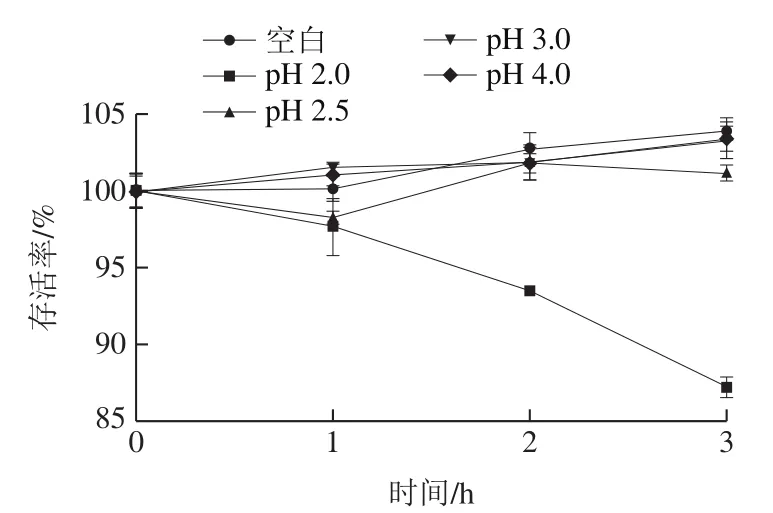
图3 胃液耐受性结果Fig. 3 Tolerance of LGZ1029 to artificial gastric juice
如表4所示,格氏乳杆菌LGZ 1029在人工肠液中经过8 h培养后,活菌数没有下降,反而略有上升,与空白组相比没有显著性差异,表现出格氏乳杆菌LGZ 1029对人工肠液有较高的耐受性。
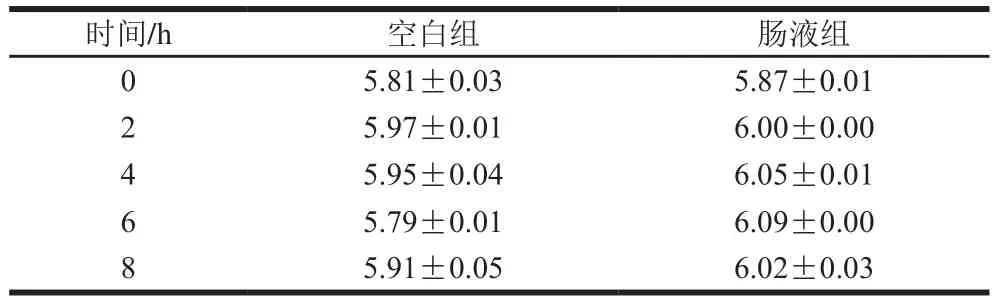
表4 格氏乳杆菌LGZ 1029在人工肠液中活菌数变化Table 4 Change in viable cell count of L. gasseri LGZ1029 incubated in artificial intestinal fluids(lg(CFU/mL))
2.3.2 胆盐耐受性
如图4所示,在0.5 g/100 mL的胆盐培养基中培养4 h后存活率不足60%,生存率较低,而在0.3 g/100 mL的胆盐培养基中孵育4 h后存活率可达78.27%,在0.1 g/100 mL和0.2 g/100 mL的胆盐培养基中培养4 h后存活率高达90%以上,此现象与陈晓华等[15]的研究结果类似。人的肠道中含有胆盐,能帮助人体消化和吸收脂肪,但同时会抑制和干扰肠道细菌的生长,破坏进入肠道的益生菌细胞结构,导致益生菌不能在肠道中存活并发挥功效[30]。虽然目前没有研究指出益生菌在肠道中需要耐受的最高胆盐浓度,但较高胆盐耐受性仍作为评判菌株益生潜力的标准之一。格氏乳杆菌LGZ 1029在较低浓度的胆盐培养基中仍可以保持活性并发挥功效,因此其对人工肠液有较高耐受性。此外,格氏乳杆菌LGZ 1029在模拟胃肠道消化液中仍可保持较高活性的3 个实验结果均有利于该菌株在胃肠道内以较高的活菌数到达其作用靶点,发挥其益生功能。
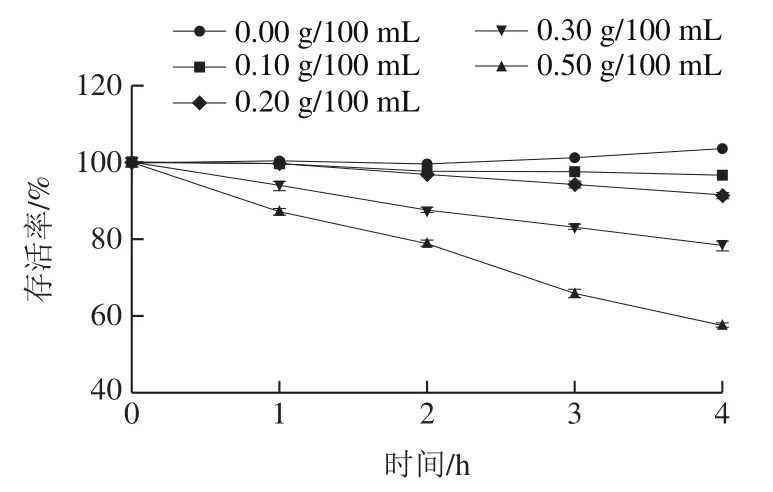
图4 胆盐耐受性结果Fig. 4 Tolerance of LGZ1029 to bile salts
2.4 菌株的黏附性
2.4.1 自凝聚能力
乳酸菌的疏水性、自凝聚能力和生物膜的形成能力呈正相关关系,可作为菌体黏附能力的指标。自凝聚能力高的菌株在竞争细胞基质-宿主结合位点时处于优势地位,除有利于其在肠道中的定植外,还可以有效避免病原体与宿主结合,从而阻止致病菌的黏附。Han Qi等[31]将菌株的自凝聚率分为3 个等级:16~35%为低等,35~50%为中等,50%以上为高等自凝聚能力。
如图5所示,2 株乳杆菌的自凝聚率均随时间延长而增加,二者均在前6 h内迅速凝聚,在24 h时达到最高值,此实验结果与陈臣[32]测试乳酸杆菌自凝聚能力的研究结果一致。格氏乳杆菌LGZ 1029在整个静置过程中自凝聚能力均高于鼠李糖乳杆菌,且在4 h时自凝聚率已达到64.18%,属于高自凝聚能力范围,最终24 h时自凝聚率达到了88.49%,即格氏乳杆菌具有较高的自凝聚能力,其可能具有较高的黏附肠上皮细胞的能力。
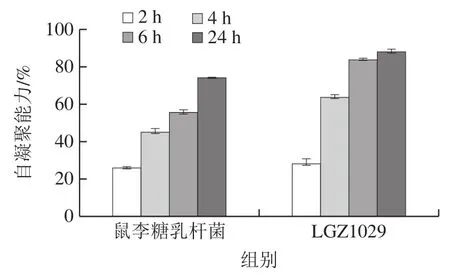
图5 乳酸杆菌的自凝聚能力Fig. 5 Self-aggregation capacity of Lactobacillus
2.4.2 疏水性
菌株的疏水性是决定细菌非特异性黏附到各种生物、非生物表面及界面的最重要的因素之一,也是影响细菌吸收和降解疏水性有机物质的主要影响因素之一,乳酸菌的高度疏水性有利于菌株在肠道中存活,维持肠道菌群稳态。Hernández-Alcántara等[33]指出,疏水性大于60%的菌株高度疏水,疏水性位于40%~60%之间是中度疏水菌,疏水性低于40%时的菌株亲水。经测定,格氏乳杆菌LGZ 1029的疏水性可达到79.75%,远高于鼠李糖乳杆菌的疏水性(43.01%),格氏乳杆菌LGZ 1029是高度疏水性菌株,其在疏水性的测定中存在菌种特异性。
2.5 菌株的抑菌能力
本实验选取了金黄色葡萄球菌ATCC 12598(革兰氏阳性菌)和大肠杆菌ATCC 25922(革兰氏阴性菌)作为指示菌,根据抑菌圈直径判断格氏乳杆菌LGZ 1029和鼠李糖乳杆菌ATCC 7469的抑菌活性,结果如表5所示。乳酸杆菌的代谢产物如有机酸、过氧化氢或分泌的细菌素可有效抑制肠道内有害菌的生长,且减少腐败菌产生的毒素,因而抑菌活性也是菌株的重要益生特性[34]。乳酸杆菌上清液的抑菌效果好于菌悬液,说明2 株菌的抑菌能力可能源于胞外代谢产物,对指示菌有一定抑制作用。相比于鼠李糖乳杆菌ATCC 7469,格氏乳杆菌LGZ 1029对金黄色葡萄球菌的抑菌效果极好,可能与其代谢产物有关,Otero等[35]发现格氏乳杆菌产有机酸和肽类物质,并对金黄色葡萄球菌造成较大的形态损伤,进而有效抑制金黄色葡萄球菌的生长。格氏乳杆菌LGZ 1029对大肠杆菌的抑制效果与鼠李糖乳杆菌ATCC 7469接近。
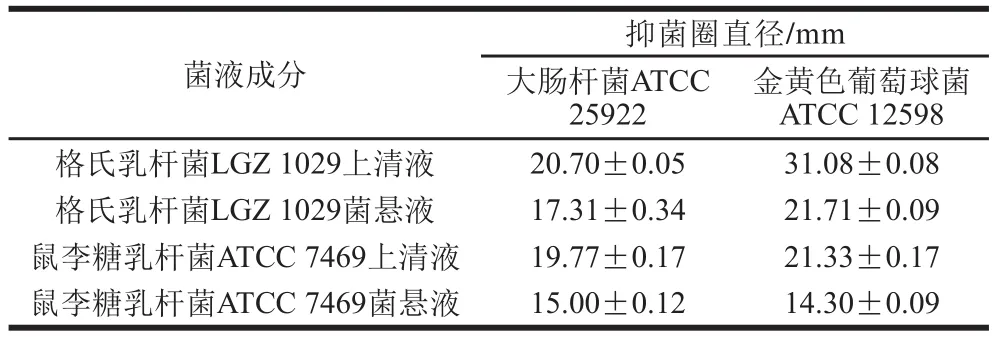
表5 不同菌液成分的抑菌圈直径Table 5 Diameters of inhibition zone of S. aureus and E. coli when exposed to the culture supernatant and cell suspension
2.6 菌株的抗氧化能力
如图6所示,菌株的发酵液、上清液及活菌体的DPPH自由基清除率均随活菌数的增加而逐渐增大。在活菌数为107CFU/mL时,格氏乳杆菌发酵液的DPPH自由基清除率达到最高值87.07%,另测得活菌数同样为107CFU/mL的鼠李糖乳杆菌ATCC 7469发酵液的DPPH自由基清除率为80.24%,田圆圆等[26]研究的8 株乳酸杆菌DPPH自由基清除率最高值仅为52.48%,说明格氏乳杆菌具有较高的DPPH自由基清除能力。赵彤等[36]指出机体的抗氧化能力与慢性疾病的发生及机体衰老密切相关,机体的强抗氧化能力可以预防某些疾病并抵抗衰老。已有许多研究证明,乳酸杆菌是优质的天然抗氧化剂,摄入一定数量的乳酸杆菌,可有效预防氧化应激作用[4-5,37]。而DPPH自由基清除能力是体外评价菌株抗氧化性的重要指标。
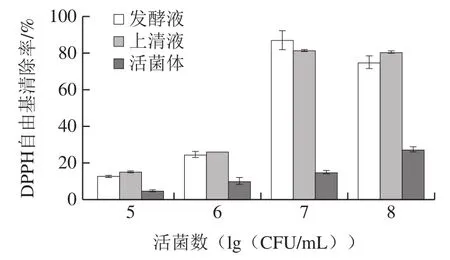
图6 格氏乳杆菌LGZ 1029的DPPH自由基清除能力Fig. 6 DPPH radical scavenging capacity of Lactobacillus gasseri LGZ 1029
此外,格氏乳杆菌的发酵液及上清液的DPPH自由基清除能力优于活菌体,推测为菌株在培养过程中产生的次级代谢产物具有较高的DPPH自由基清除能力。
3 结 论
本实验以1 株分离自广州1 月龄婴儿肠道内的乳酸杆菌为研究对象,对其进行分子生物学鉴定,确认为格氏乳杆菌并命名为LGZ 1029。通过溶血检测、耐药性检测、小鼠急性毒理实验对格氏乳杆菌LGZ 1029进行体内外安全性评价,未检测到有害代谢产物溶血毒素,格氏乳杆菌LGZ 1029对各种类抗生素都表现出了耐药敏感性,含格氏乳杆菌LGZ 1029的菌液对雌雄性KM小鼠急性经口毒性LD50大于10.0 g/kg,属于无毒级菌株,表明菌株安全。益生特性结果显示,格氏乳杆菌LGZ 1029在模拟胃肠道消化液中可保持较高活性,具有大于50%的高自凝聚能力和高疏水性(79.75%),黏附性高于对照组鼠李糖乳杆菌ATCC 7469。抑菌实验显示格氏乳杆菌对金黄色葡萄球菌有较高的抑菌效果,且上清液的抑菌活性较高,对大肠杆菌的抑菌效果与LGG相近。抗氧化能力测定结果表明,格氏乳杆菌LGZ 1029的发酵液、上清液及活菌体均具有一定的DPPH自由基清除能力,其中活菌数为107CFU/mL的发酵液清除能力最高且高于同等浓度鼠李糖乳杆菌的发酵液。本实验为发掘格氏乳杆菌LGZ 1029的益生功能特性提供参考,也为丰富我国益生菌种资源库、开发食疗性益生菌产品提供参考。

