魔芋葡甘聚糖-可得然胶共混凝胶替代动物脂肪对乳化肠品质特性的影响
余依敏,夏 强,杨林林,林泊宇,陆银银,曹锦轩,蔡振东,*,潘道东,*
(1.宁波大学 浙江省动物蛋白食品精深加工技术重点实验室,浙江 宁波 315800;2.宁波大学食品与药学学院,浙江 宁波 315800)
乳化肠是通过斩拌、灌装、蒸煮等工艺加工而成的肉糜制品。传统的猪肉乳化肠中脂肪含量接近30%[1]。脂肪与肌原纤维蛋白相互作用形成乳化液滴,以填充物或共聚物的形式被束缚在蛋白质的三维网状结构中,减小乳化肠凝胶体系中的孔隙率[2],从而提供优良的风味物质,赋予乳化肠良好的组织特性和消费者满意度[3]。然而,脂肪的过量摄入易增加患心血管疾病[4]、老年痴呆[5]、癌症[6]等疾病的风险。但仅通过减少动物脂肪含量以达到降脂目的又会对乳化肠的品质造成不良影响,可能会降低产品的保水性,改变其较理想的质构特性,导致消费者对其口感、色泽度的接受度变差,直接影响产品的销售和市场份额[7],这成为低脂肉制品生产工业化的技术瓶颈之一。因此在降低动物脂肪含量的同时,保持低脂乳化肠产品良好的感官品质已经成为了当前的研究重点。
近年来,有关多糖混合体系的研究迅速发展[8],应用食品胶体改善低脂乳化肠品质是当前的研究热点之一[9],通过建立共混凝胶体系可调控凝胶网络结构以改变凝胶体系的物理特性,从而改善低脂乳化肠的品质。芦嘉莹等[10]将魔芋葡甘聚糖(konjac glucomannan,KGM)、卡拉胶和黄原胶共3 种胶体两两复配,显著提高了乳化肠的出品率,并有效改善了产品的品质;王伟等[11]比较了3 种不同分子质量的海藻酸钠(sodium alginate,SA)对低脂乳化肠凝胶特性的影响,结果表明SA通过增强静电斥力和空间位阻作用可以形成更大孔隙的微结构,SA的分子质量越大,对乳化肠的凝胶持水性就越强,且低脂乳化肠质构没有明显变化。
KGM是非离子型的水溶性高分子糖,具有良好的保水性和凝胶性,在水产品[12]、面包[13]和肉制品[14]等食品中广泛应用,与其他亲水胶体复配后,能起到协同增效的作用[15]。可得然胶(curdran gum,CUD)为不溶于水的葡聚糖,可抑制蛋白的热聚集变性,在水中经过高速分散可以形成均匀的分散液,在较高温度中,胶体强度会随加热温度的上升而不断提高,其凝胶性质被广泛应用于面制品和水产品中,但在肉制品中的应用较少[16]。蒋明峰等[17]证明,KGM和CUD之间存在氢键相互作用,可形成网状结构,两种多糖分子共混会通过氢键相互作用起到协同增黏作用。虽然目前KGM和CUD在乳化肠中的单独应用已有报道[18-19],但复配添加KGM和CUD对乳化肠品质的影响研究鲜见报道。
本实验采用KGM和CUD进行复配,通过测定KGM-CUD共混凝胶的乳化性,确定乳化肠中KGM-CUD共混凝胶的浓度和配比,以蒸煮损失、色差、持水性、质构特性、脂质氧化、微观结构和感官评价为指标,探究KGM-CUD共混凝胶替代动物脂肪对乳化肠品质特性的影响,以期为研制新型低脂乳化肠提供新思路。
1 材料与方法
1.1 材料与试剂
猪后腿肉、猪背膘 浙江华腾食品有限公司;宅福艺牌KGM(食品级) 合肥益品园贸易有限公司;巷品街牌羊肠(20~22 g) 漯河钜轩食品科技有限公司;食盐 中盐长江盐化有限公司;CUD、谷氨酰胺转氨酶、β-环糊精、异抗坏血酸钠 河南万邦实业有限公司;亚硝酸钠 四川金山制药有限公司;复合磷酸盐 徐州添安食品添加剂有限公司;味精 广州奥桑味精食品有限公司;十三香 驻马店市王守义十三香调味品基团有限公司;红曲 上海佳杰天然食品色素有限公司;42度纯酿白酒 北京顺鑫农业股份有限公司牛栏山酒厂。以上配料、添加剂均为食品级。十二烷基硫酸钠(dodecyl sodium sulfate,SDS) 生工生物工程(上海)股份有限公司;三氯乙酸(trichloroacetic acid,TCA)、硫代巴比妥酸(thiobarbituric acid,TBA)上海麦克林生化科技有限公司;戊二醛、氯仿 上海源叶生物科技有限公司。
1.2 仪器与设备
XHF-D高速分散器 宁波新芝生物科技股份有限公司;PL403电子分析天平 梅特勒-托利多仪器(上海)有限公司;XM-400UHF液晶超声波清洗机 小美超声仪器(昆山)有限公司;5804R高速冷冻离心机 德国艾本德股份有限公司;DK-8D型电热恒温水槽 上海一恒科技有限公司;Infinte 200PRO型酶标仪 瑞士Tecan公司;TA-XT plus质构仪 英国Stable Micro System公司;85-2A型磁力搅拌器 上海司乐仪器有限公司;CE-440色差仪 柯尼卡美能达办公系统(中国)有限公司;BJRJ-20型斩拌机 嘉兴艾博实业有公司;Christ冻干机 北京博劢行仪器有限公司。
1.3 方法
1.3.1 单因素试验设计
参考王慧等[20]的方法进行单因素试验设计。选取KGM-CUD质量比0∶10、2∶8、4∶6、6∶4、8∶2、10∶0,KGM和CUD总质量分数0.1%、0.3%、0.7%、0.9%,研究KGM和CUD配比及总质量分数对共混凝胶乳化性和乳化稳定性的影响,从而确定乳化肠中KGM和CUD的总质量分数和比例。
1.3.2 KGM-CUD共混凝胶的制备
称取总质量分数为0.9%的KGM和CUD,分别按一定质量比例梯度(0∶10、2∶8、4∶6、6∶4、8∶2、10∶0)混合均匀,加入100 mL的去离子水,混匀,用高速分散器分散1 min,使KGM和CUD溶胀完全,然后超声清洗约10 min,直至溶液无明显气泡,静置,待测。
1.3.3 KGM-CUD共混凝胶乳化性及稳定性的测定
参考张根生等[21]的方法并作适当修改。取15 mL共混凝胶加入到离心管中,再取5 mL的大豆油加入到离心管中。用高速分散器于室温、10 000 r/min均质1 min,然后用移液枪立刻从离心管底部吸取100 μL乳化液样品加入到9.9 mL配制好的质量分数0.1% SDS溶液中,振荡1 min摇匀,用移液枪吸取100 μL离心管内溶液到酶标板中,以0.1%的SDS溶液作空白对照,于500 nm波长测定各组的吸光度A0。将乳化液静置10 min后,再吸取100 μL样品并重复上述步骤以测定其吸光度At。乳化活力指数(emulsifying activity index,EAI)按式(1)、(2)计算;乳化稳定性指数(emulsion stability index,ESI)按式(3)计算。
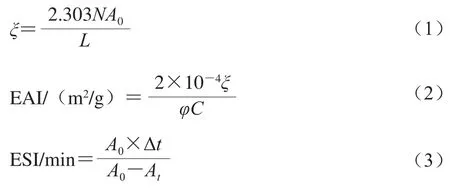
式中:N为稀释倍数(100);L为比色池的直径(1 cm);φ为体系中油相的比例;C为混合亲水胶体质量浓度/(g/mL);A0为0 min时吸光度;At为放置10 min后吸光度;Δt为时间差(10 min)。
1.3.4 低脂乳化肠的配方
本实验共4 组,对照组(G1)的猪背膘添加量为20%,在猪后腿肉质量不变的基础上,用KGM-CUD共混凝胶分别代替乳化肠中33%(G2)、66%(G3)、100%(G4)的猪背膘,猪后腿肉和猪背膘均用100 mL葱姜蒜料酒腌制15 min,均不改变的其他配料及其质量分数分别为:食盐(2%)、谷氨酰胺转氨酶(0.3%)、冰水(20%)、β-环糊精(0.1%)、亚硝酸钠(0.01%)、复合磷酸盐(0.4%)、白酒(1%)、味精(0.15%)、异抗坏血酸钠(0.05%)、十三香(0.03%)、红曲(0.05%)。以总质量为500 g计算配方,如表1所示。
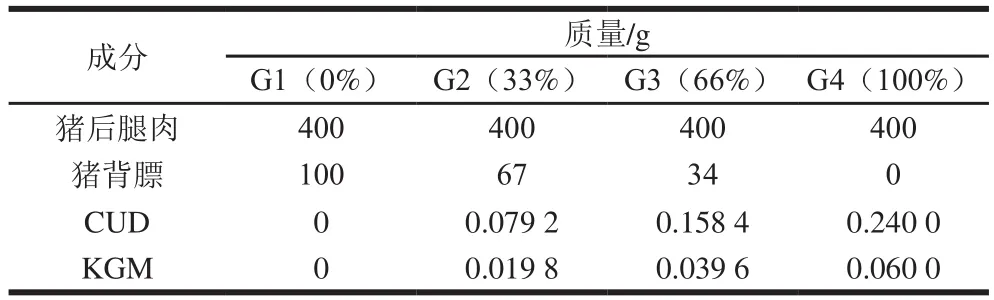
表1 不同比例KGM-CUD共混凝胶代替猪背膘的乳化肠配方Table 1 Formulations of emulsified sausages with replacement of pork back fat by KGM-CUD composite gel in different proportions
1.3.5 低脂乳化肠的制备过程
参考赵尹毓等[22]的方法并适当修改。
原料处理:选择新鲜的猪后腿肉和猪背膘共400 g,于室温用小流水解冻隔袋中的肉,此时肉中的营养物质不易流失,口感较好,且解冻速度较快。去除结缔组织和肌内脂肪,瘦肉切块(10 cm×10 cm×10 cm),肥肉切丁(2 cm×2 cm×2 cm)。
斩拌:按猪后腿肉和配料与冰水的质量比4∶1准备冰水,将猪后腿肉和配料混合后与备好三分之一体积的冰水共同放入斩拌机中,高速斩拌0.5 min,再分别放入猪背膘、不同添加量的KGM和CUD,加入剩余一半体积的冰水,高速斩拌1 min,再加入剩余的全部冰水继续高速斩拌0.5 min。斩拌过程中温度控制在8~12 ℃,以完成肠的乳化。
灌肠:用灌肠器将肉糜灌入肠衣内(羊肠的直径为2 cm)。灌肠过程中要求制得肉肠内的肉糜分布均匀,扎去明显的气孔。
蒸煮:放入恒温水浴锅进行蒸煮,待温度升高到75 ℃后继续蒸煮45 min。
冷却:将乳化肠取出后,除去表面水分,由于乳化肠和冷却介质间的对流传热对肠的持水能力有较大影响,因此将其放入盛有15~20 ℃自来水的盆中,迅速冷却肉肠于室温,并于4 ℃保存备用。
1.3.6 乳化肠蒸煮损失测定
根据Abbasi等[23]的方法适当修改,将制备好的乳化肠表面擦拭干净,称质量,置于恒温水浴锅中至温度上升至75 ℃后继续蒸煮45 min,取出后冷却,除去表面水分,称质量,按式(4)计算蒸煮损失率:
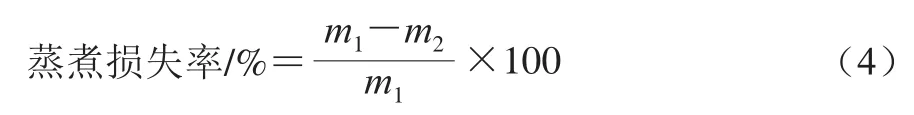
式中:m1为乳化肠样品蒸煮前的质量/g;m2为乳化肠样品蒸煮后的质量/g。
1.3.7 乳化肠色差的测定
使用色差计测定乳化肠的颜色,用白板进行校准(L*=92.46、a*=-0.39、b*=4.55),将样品在室温放置2 h,切成直径2 cm的薄片,剥去肠衣,随机取3 个区域测定L*(亮度)、a*(红度)、b*(黄度),每个区域测定3 次。
1.3.8 乳化肠持水性的测定
称取一定量的样品用吸水纸包裹后放入到离心管中,于4 ℃、1 000×g离心10 min,记录离心后的样品的质量,每组至少做3 次实验,按式(5)计算样品的保水性:
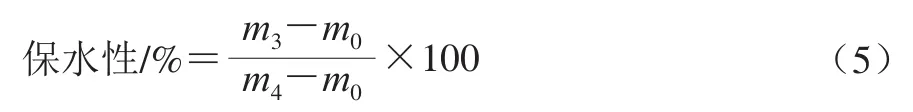
式中:m4为离心前样品和离心管的总质量/g;m3为离心后样品和离心管的质量/g;m0为离心管的质量/g。
1.3.9 乳化肠质构的测定
质构仪可以准确地量化食品的质构特性,对食品的品质特性进行高精度的测定[24],形成一系列定义和描述[25]。参照Laranjo[26]和Wang Peng[27]等的方法作适当修改。将乳化肠在室温放置2 h,将香肠样品切成2.5 cm高的圆柱形,切面要求平整,剥去肠衣。使用TA-XT plus质构仪,选用36R 探头,将样品放置在测试平台中央,设置参数为:测试前速度2 mm/s,测试速度为1 mm/s,测试后速度5 mm/s,触发力5×g,探头校准高度30 mm,压缩比50%。测量结果以硬度、弹性、内聚性、咀嚼性、回复性表示,每样品至少重复5 次实验。
1.3.10 乳化肠脂肪氧化的测定
根据Wang Ying等[28]的方法对TBARS实验做适当修改,测定乳化肠样品第1、4、7、10、13天的硫代巴比妥酸反应物(thiobarbituric acid reaction substances,TBARS)含量。称取2 g样品绞碎到试管中,在冰浴中加入10 mL体积分数为17.5%(含0.1%的EDTA)的TCA溶液,于4 ℃、3 000 r/mim离心1 min,然后将匀浆通过两层(中速定性)滤纸过滤,得到滤液。取1 mL滤液与1 mL 0.02 mol/L TBA溶液充分混匀,并在100 ℃水浴35 min。取出后立即冷却至室温,于4 ℃、2 000×g离心5 min,在上清液中加入5 mL的氯仿溶液,摇匀,静置,待分层后取上清液分别在532 nm和600 nm波长处测量样品的吸光度,按式(6)计算样品中TBARS值。
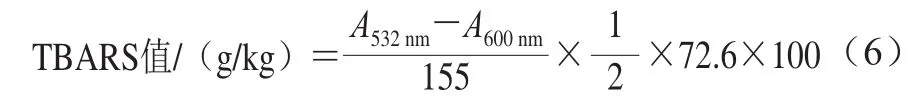
式中:A532nm为待测样品液在波长532 nm处的吸光度;A600nm为待测样品液在波长600 nm处的吸光度。
1.3.11 扫描电镜观察乳化肠的微观结构
参考姜帅等[18]的方法对乳化肠进行微观结构观察。将样品切成约0.2 cm×0.5 cm×0.5 cm的小块,先用质量分数2.5%、pH 6.8的戊二醛溶液浸泡过夜,再用0.1 mol/L、pH 6.8的磷酸缓冲液洗涤3 次,每次10 min。将无水乙醇配成50%、70%、80%、90%的乙醇溶液,洗涤样品,每次10 min,再用无水乙醇将样品脱水3 次,每次10 min。用冷冻干燥仪对样品进行干燥,再对样品进行扫描操作。
1.3.12 感官评价
参考Göek等[29]的方法适当修改。从经过专业感官训练培训的人员中随机挑选10 名对每组样品进行感官评价,评分项目有产品的色泽、口感、组织状态和整体可接受度。将各组乳化肠切成块状,随机打乱每组的顺序,1~3 分为不可接受,3~5 分为勉强可接受,5~7 分为可以接受,7~9 分为乐意接受。根据满分9 分的评分标准以判定产品的可接受度,评价标准如表2所示。

表2 法兰克福香肠的感官评价标准Table 2 Criteria for sensory evaluation of frankfurters
1.4 数据处理
至少做3 组平行实验,求取平均值,用Origin 9.3软件(美国OriginLab公司)作图,用SPSS 23软件(美国SPSS公司)进行单因素方差分析,数据结果以表示。
2 结果与分析
2.1 KGM-CUD共混凝胶乳化性及稳定性分析
如图1所示,随着共混凝胶中KGM的比例增大,共混凝胶的乳化性逐渐增加,乳化稳定性先升高后急剧降低,在KGM-CUD比例为8∶2时,乳化稳定性达到最大值(图1A)。KGM是线性分子,可以形成三维空间结构[30],在室温下,虽然KGM受剪切力影响较少,相互缠绕会表现出一定的黏度,但CUD分子链间缠绕不紧密,KGM和CUD相互结合后,CUD分子均匀分布在线性构象的KGM分子链网状结构中[31],形成有序的KGM-CUD共混凝胶,使得胶体溶液的乳化性和稳定性提高。对于单一胶体,KGM的稳定性低于CUD的稳定性,这与叶伟建[32]研究结果一致,其研究发现:低温下单一的KGM凝胶较不稳定,添加CUD有利于提高复合凝胶稳定性的结果一致;KGM-CUD比例在4∶1~1∶1之间效果明显。
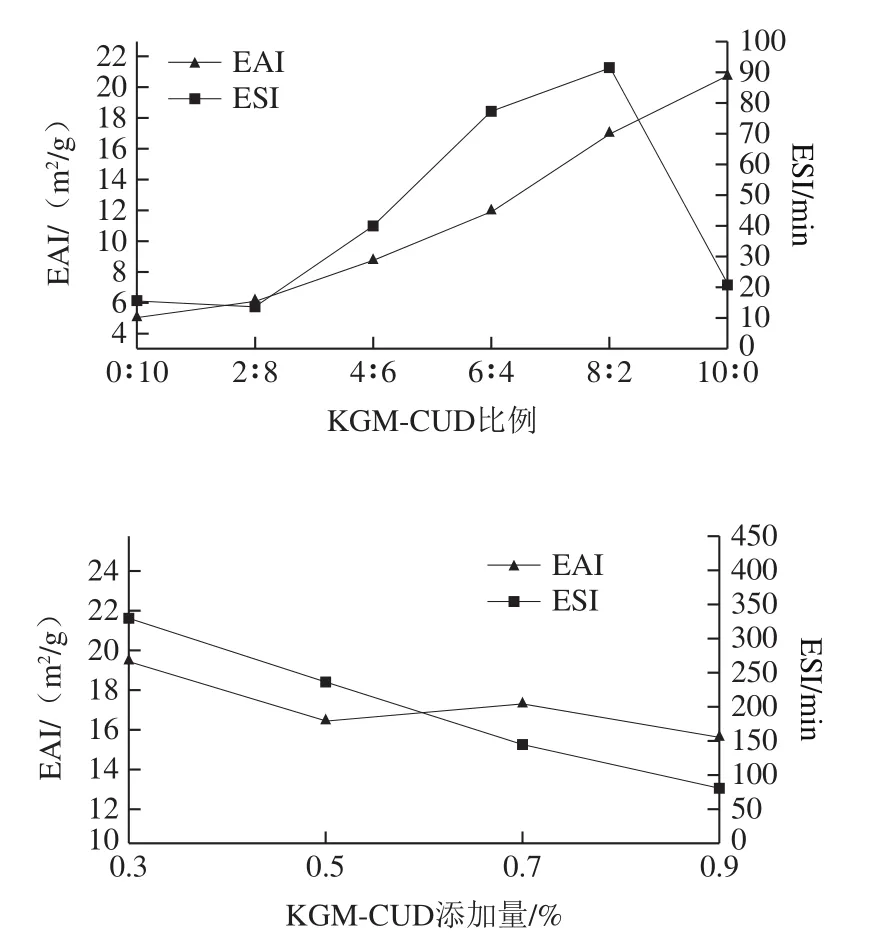
图1KGM-CUD比例与添加量对共混凝胶乳化性及稳定性的影响Fig. 1 Effects of KGM/CUD ratio and concentration on emulsification capacity and stability of composite gels
基于以上结果,进一步选取KGM-CUD比例8∶2以考察总添加量(0.3%、0.5%、0.7%、0.9%)对乳化性及稳定性的影响。由图1B可知,当KGM-CUD添加量不断上升时,KGM-CUD共混凝胶的ESI迅速下降,EAI先下降,后趋于稳定,原因可能为多糖分子结构中含有强阴离子性硫酸酯基团,可以和水分子形成额外的氢键[2]。同时,KGM和CUD分子链更趋向于自身分子链的结合,在共混时,浓度越高,能结合的自由水越少,分子链缠结越容易受到对方的阻碍,网络结构形成时间就越长[32],因此选取总添加量为0.3%。
2.2 乳化肠蒸煮损失分析
如图2所示,随着KGM-CUD共混凝胶代替脂肪比例的不断增加,乳化肠的蒸煮损失率先降低后增加,但添加KGM-CUD共混凝胶的G2、G3、G4组的蒸煮损失率均低于G1对照组。G3组蒸煮损失率最低,但与G2组没有显著区别(P<0.05)。肉制品在经过斩拌时,肌原纤维蛋白会从肌肉中溶出,在保持一定黏度的同时,会将脂肪球包裹于蛋白网络结构中,形成稳定的乳化物,从而保证肉糜微观结构的稳定。CUD通过氢键与水分子结合以锁住高于自身质量100 倍的水[33],在蒸煮过程中与大量的自由水结合,并转变为不易流动的水。当CUD和KGM以氢键的方式结合时,亲水基团与水结合,促使肌肉蛋白质发生交联反应,与肌原纤维蛋白结合形成更加致密的凝胶网络结构[2],因而可以束缚住更多的水分,从而降低乳化肠在蒸煮过程中水分损失量。但是在脂肪含量低的乳化肠中有较大的疏水域,其中的水分子不能被CUD锁住,这有可能导致脂肪颗粒的聚集,乳化性质降低,从而导致水分损失严重。
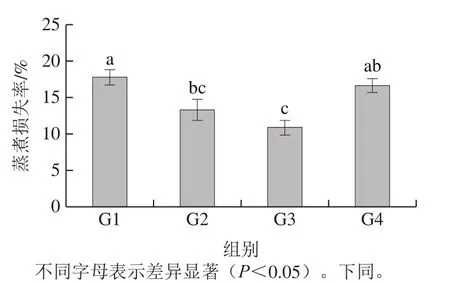
图2 替代比例对乳化肠蒸煮损失的影响Fig. 2 Effect of substitution ratio on the cooking loss of emulsified sausages
2.3 乳化肠色差分析
如表3所示,与G1对照组相比,随着KGM-CUD共混凝胶替代猪背膘的比例增加,G2组乳化肠的a*值显著增加(P<0.05),G3组乳化肠的a*值和b*值显著提高(P<0.05),当替代比到达100%(G4)时,乳化肠的L*值、a*值和b*值与对照组(G1)无显著差异(P>0.05)。Choi等[34]研究表明,脂肪代替物会影响低脂肉制品中的L*值、a*值和b*值,添加复配胶对乳化肠的a*值有一定的提高[10],这有利于改善产品颜色,提高产品的可接受性。本实验用复配胶体完全替代脂肪未显著改进乳化肠的颜色,而较低KGM-CUD共混凝胶代替猪背膘的比例能显著提高亮度,改善肉制品的颜色。

表3 替代比例对乳化肠色差的影响Table 3 Effects of substitution ratio on the color difference of emulsified sausages
2.4 乳化肠持水性分析
持水性受到蛋白质-蛋白质以及蛋白质-多糖间的氢键作用、疏水相互作用等影响[35]。由图3可知,G2、G3组的持水能力与G1组没有显著差异(P>0.05),都具有较高的持水性,G4组与其他3 组相比持水能力显著下降(P<0.05)。Cofrades等[36]研究发现,用添加海藻的乳液代替脂肪不会降低水和脂肪的结合能力,而海藻的持水能力与多糖的组成种类密切相关[37],导致G4组持水能力显著下降的原因可能是KGM和CUD含量较高,两者的相互作用抑制肌原纤维蛋白之间或者CUD与肌原纤维蛋白之间的联结,导致水分流失较多,且G4组脂肪含量几乎没有,不能很好地形成脂质-凝胶乳化体系,这与蒸煮损失测定中G4组蒸煮损失率显著上升的情况相对应。
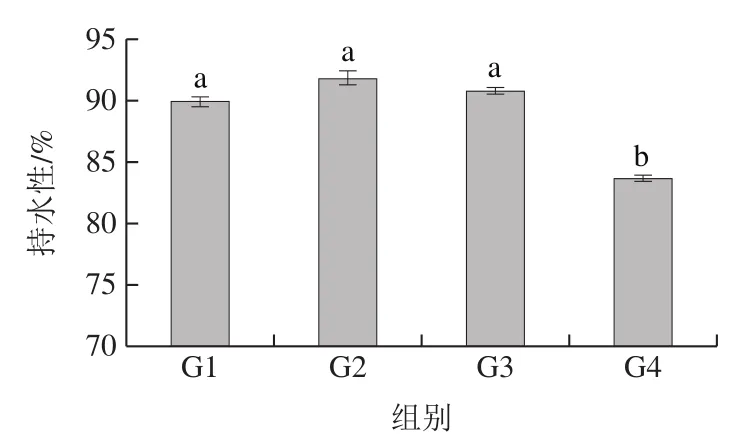
图3 替代比例对乳化肠持水性的影响Fig. 3 Effect of substitution ratio on water-holding capacity of emulsified sausages
2.5 乳化肠质构分析
质构仪可以模仿人体口腔的咀嚼动作,在肉类制品开发研究中有广泛应用[4]。由表4可知,G2组和G3组的弹性、咀嚼性、内聚性和回复性与对照组(G1)均没有显著差异(P>0.05),但G3组硬度显著增加(P<0.05);G4组相比于G3组,弹性显著下降(P<0.05),但与G1组没有显著性区别,咀嚼性、内聚性、硬度和回复性与G1组相比都显著下降(P<0.05)。Zhuang Xinbo等[38]的研究证明,良好的脂肪替代品可以通过烹饪过程中更高强度的蛋白质-蛋白质相互作用提高肉的凝胶性能,从而提高样品的硬度。在本实验中KGM-CUD共混凝胶中虽然存在较多水分,但能有效填充蛋白质的三维凝胶网络结构,从而提高乳化肠的硬度。但随着共混凝胶替代比例过度升高,当完全替代脂肪时,由于脂肪含量过少,而水分大量存在,与对照组相比各个方面的质构特性都显著下降。
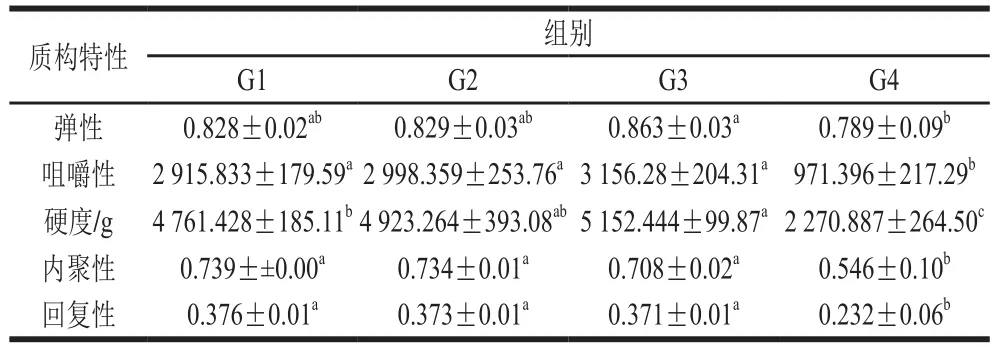
表4 替代比例对乳化肠质构特性的影响Table 4 Effects of substitution ratio on the texture properties of emulsified sausages
2.6 乳化肠脂质氧化分析
由图4可知,在贮藏乳化肠相同的时间时,G3组和G4组的TBARS值均显著低于对照组(G1)(P<0.05),可能是因为脂肪含量的降低导致乳化肠中不饱和脂肪酸含量的减少,从而削弱氧化程度。G2组与对照组相比变化不大,仅在第4天值脂质氧化程度加剧,其原因可能为取代的脂肪含量较少,这与胡红燕[39]研究得到取代质量分数为25%的乳化肠由于多不饱和脂肪酸含量的增加导致氧化程度加剧的结果相似。随着贮藏时间的延长,G1组在第4天时TBARS值显著增加(P<0.05),G2组在第7天时TBARS值显著增加(P<0.05),G3组在第4天时TBARS值显著增加(P<0.05),但仍低于G1组在第1天的TBARS值,G4组在第10天时TBARS值显著增加(P<0.05),所有组在第13天时,脂质氧化程度明显增加,原因可能是丙二醛与蛋白质等其他成分发生反应[40]。因此,结果表明KGM和CUD共混凝胶替代脂肪的比例较高时,可进一步提高乳化肠抗氧化性。
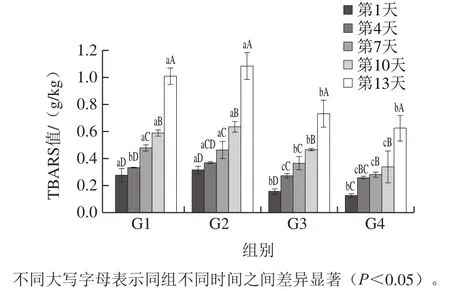
图4 不同替代比例乳化肠的脂质氧化程度随时间的变化Fig. 4 Effect of substitution ratio on lipid oxidation in emulsified sausages as a function of storage time
2.7 乳化肠微观结构的观察
如图5所示,G1、G2和G3组间没有明显变化,内部形成分布不明显的空隙,而G4组明显有空隙。Zhuang Xinbo等[41]研究发现甘蔗不溶性膳食纤维在加热前会从肌原纤维蛋白中迁出,通过疏水基团的相互作用,能使肌原纤维蛋白单独形成的凝胶空隙减小。姜帅等[18]研究发现添加CUD能起到空间填充的作用,从而提高对水的束缚能力,可明显改善凝胶的组织特性,但是加水量过多会对凝胶结构起到一定的破坏作用。虽然G4组含有最多CUD,但是由于KGM-CUD共混凝胶中含有大量的水分,可能造成G4组凝胶网络结构的稳定性最差。G4组乳化肠结构组织松散,不能很好地锁住水分,因此蒸煮后肉汁流失严重,导致蒸煮损失率上升,且持水性的下降,乳化肠微观结构基本与蒸煮损失和持水性结果相一致。
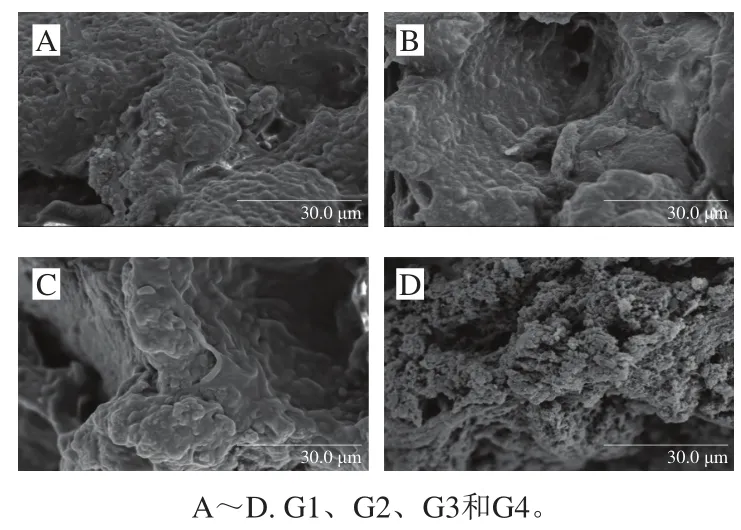
图5 乳化肠扫描电镜结果(×1 500)Fig. 5 Microstructure of emulsified sausages (× 1 500)
2.8 乳化肠感官评价分析
图6为感官分析结果,从乳化肠色泽、口感、组织状态和整体可接受度进行评定。随着乳化肠中KGM-CUD共混凝胶替代猪背膘比例的增加,乳化肠的组织状态、口感均呈现出降低的趋势,G4组显著降低,而G2组和G3组的结果相似,这说明脂肪的替代比例在提升到某一值后会明显导致乳化肠的口感发柴、其结构变得疏松多孔。在色泽方面,G2组、G3组的分数稍高于对照组(G1),这也与之前色差的测定结果相似。G1组由于有较理想的组织状态和口感,因而在总体可接受度的评分最高。G2组和G3组相对于G1组稍弱,且2 组间没有显著区别,但G1组、G2组、G3组都属于感官测定结果中乐意接受范围内。G4组在口感、色泽、组织状态方面评分都最低,这也导致其整体可接受度评分最低,以上结果表明,脂肪在保证乳化肠风味中起重要作用,脂肪的减少会影响乳化肠的口感及其组织结构的状态,但在适宜范围内影响不大。乳化肠的色泽小于组织、状态和口感对消费者整体可接受度的影响。本实验用66%替代组(G3)可以在保证不影响风味的情况下进行脂肪替代。
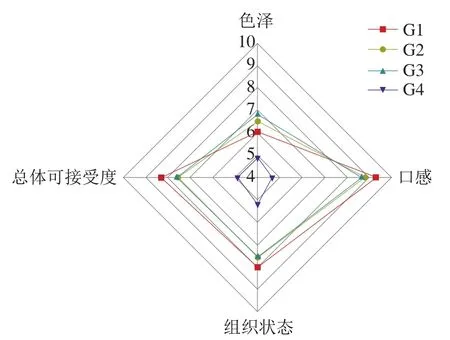
图6 不同替代比例乳化肠的感官特性Fig. 6 Sensory characteristics of emulsified sausages prepared with different proportions of KGM and CUD mixture as a substitute for pork back fat
3 结 论
选择KGM-CUD添加量0.3%、KGM-CUD比例8∶2的共混凝胶替代脂肪添加到猪肉乳化肠中,随着替代比例的升高,当复配胶体对脂肪的替代比为33%(G2)和66%(G3)时,相比于对照组(G1),2 组乳化肠的蒸煮损失和脂质氧化程度均显著下降,但G3组下降得更加显著,这对延长产品的货架期有利;G2组提高亮度值,G3组提高红度值,且显著提高硬度;G2、G3共2 组的微观结构和持水性相比于对照组无明显差异。但当完全替代脂肪(替代100%)时,乳化肠的持水性、质构特性、总体接受度均显著下降,其结构、组织的状态疏松,因而选择66%的KGM-CUD共混凝胶替代脂肪。目前对于制备低脂乳化肠,纤维素类、蛋白质类、淀粉类均可作为脂肪替代物的物质,虽然大多研究对提高乳化肠感官品质具有促进作用,但脂肪替代的比例范围较宽,本实验为进一步研究脂肪替代比例及提高乳化肠感官品质提供一定参考。

