养分水平对烤烟根系性状及养分吸收的影响
谢 晋, 黄 浩, 袁文彬, 李谨成, 王初亮, 黄 磊, 邵兰军, 梁增发,苏 诏, 王 维*
(1.广东中烟工业有限责任公司,广东 广州 510145; 2.华南农业大学 农学院, 广东 广州 510642)
0 引言
【研究意义】烟草是我国农业生产中主要的税收经济作物之一[1],其种植面积与总产量均居世界前列,而高产、稳产和优质对确保卷烟提质增效极其重要。但是,烟草品质的优劣往往受栽培措施、自然环境条件和烟草品种等因素的影响[2-3]。通过调整各类烟草生长所需的营养元素配比和改变栽培措施能够显著提高烟草叶片有机物的含量,且烟碱、焦油和尼古丁等有害物质的含量显著降低[4-5]。目前,K326、云烟85、云烟87和红花大金元4个烤烟品种仍占全国烤烟种植面积的绝大部分,提高主栽品种的产质量已成为限制烟草种植业发展的瓶颈[6]。南方烟草种植区的土壤理化结构多以酸性红黄壤为主,铝铁含量丰富,但是氮磷钾元素普遍缺乏[7]。因此,要提高主栽品种的产质量,应重点关注精简栽培方式与合理施肥等环节,而弄清养分水平对烤烟根系性状及养分吸收的影响,对烤烟生产的合理施肥具有重要意义。【前人研究进展】烟草的收获期相对较长,需连续多个时期采收不同部位叶片进行烘烤。传统栽培模式以增加地上部分的生物量达到增加产量的目的,盲目地喷施叶面肥,虽然促进了枝叶的生长,但也会导致植株贪青徒长,容易发生病虫害[8-9]。此观念忽略了地下部分与地上部分的对应关系,根是吸收水分与营养物质的主要器官,发达的植物根系能够促进植物地上部分光合产物的积累[10]。植物根部结构主要由主根与侧根共同组成,主根主要起到定植作用,而侧根越发达,吸收供应地上部分的营养元素越多。为了获取更多的水分与营养物质,植物地下的根部构型多种多样,侧根数量、长度与空间角度显著影响植物的生长。模式植物拟南芥的侧根起源于主根的中柱细胞,由中柱细胞脱分化形成向外凸起的生长锥继而发育成为侧根,调控植物侧根发育的部分关键基因已被鉴定,如转录因子ABI4[11]、脂肪酸氧化酶LOX[12]、生长素响应因子IAA14、ARF7[13]等。【研究切入点】尽管涉及根部发育的遗传分子机制正在被不断地解析,但对有关烟草根构型的分子发育机制却知之甚少,甚至对于烟草的主根与侧根如何响应营养元素分布的表型数据亦十分匮乏。【拟解决的关键问题】以南方酸性红壤土为基质,选择主栽品种云烟87为试验材料,探明养分水平对烤烟根系结构的变化及其对养分吸收的影响,以期为烤烟高产栽培与合理施肥提供依据。
1 材料与方法
1.1 研究区概况
试验于2019年在广东省广州市华南农业大学校内农场进行,土壤pH为6.33,有机质含量25.65 g/kg,全氮1.362 mg/kg,全磷0.958 mg/kg,全钾17.52 mg/kg,速效磷104.51 mg/kg,速效钾52.62 mg/kg,碱解氮102.41 mg/kg。
1.2 材料
1.2.1 品种与土壤 烤烟品种为云烟87,由广东中烟工业有限责任公司提供;供试土壤(晒干、敲碎,捡去杂物,过筛后备用),采自华南农业大学农场水稻土。
1.2.2 仪器 CCD图像采集仪,深圳市多图科技有限公司;DeVere540显微图像分析仪,辽宁仪表研究所有限责任公司;凯氏定氮仪,上海圣科仪器设备有限公司。
1.3 方法
1.3.1 根系培育试验 在温室内进行根系培育试验,每个培养室栽植4叶一心烟苗1株。植株根系均匀放置在聚酯板间,填入过筛土,保持茎部在盘子上部5 cm处,烟株根系的活动区域及根系精细结构示意见图1。
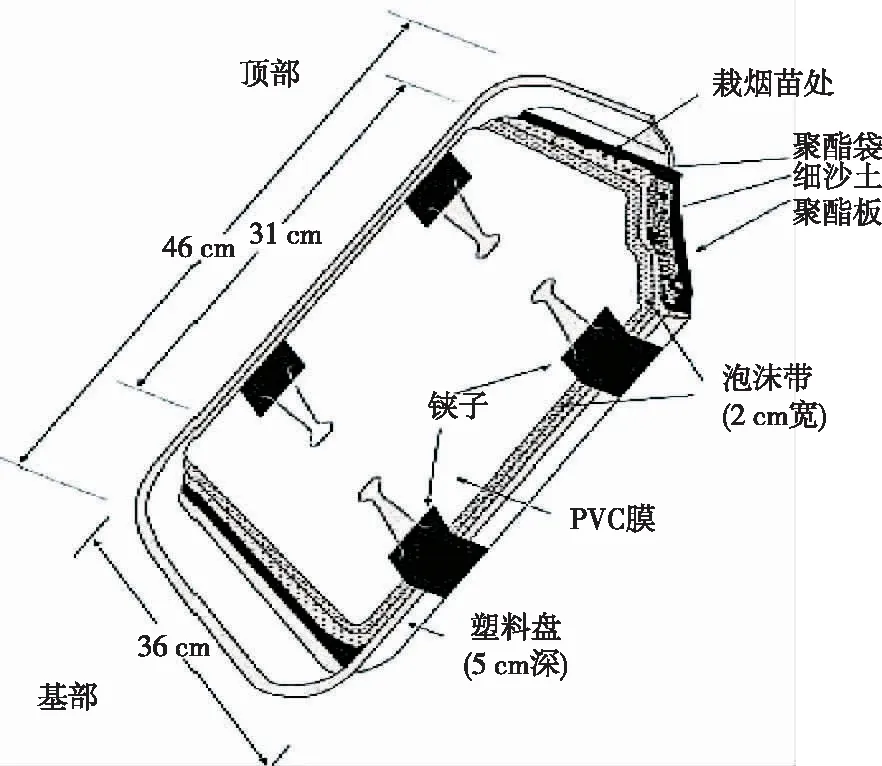
图1 烟株根系的活动区域及根系精细结构示意
1.3.2 试验设计 采用底部渗透吸水方法,烟株生长设3个营养水平,即3个处理:N1,NPK Hogland 全营养液;N2,1/2 NPK Hogland全营养液;N3,1/4 NPK Hogland全营养液。
Hogland营养液配方:每升大量元素培养液中加入1 mL Fe-EDTA溶液和1 mL微量元素溶液。1) 大量元素:每升培养液中1 mol/L KH2PO41 mL,1 mol/L KNO3 5 mL,1 mol/L Ca(NO3)25 mL,1 mol/L MgSO42 mL;2) 微量元素:每升水中加入H3BO32.86 g,MnCl2·4H2O 1.81 g,ZnSO4·7H5O 0.22 g,CuSO4·5H2O 0.08 g,H2MoO4·H2O 0.02 g;3) Fe-EDTA溶液:每升水中加入Na2-EDTA 7.45 g,FeSO4·7H2O 5.57 g[14]。
整个处理时期(移栽45 d后)用CCD图像采集仪观察根系在土壤中的扩展状态,并测定叶片SPAD值和光合作用。待根系生长接近培育室底部时,取地上部各器官进行干物重及N、P、K元素分析;打开聚酯板,进行流水浸泡,待根系与土壤完全分离,取有代表性的根系从根部切断,平铺在玻璃板上,用含0.01%甲基紫罗兰的甘油附着染色1 h,然后用去离子水冲洗干净,再用滴管加一薄层甘油和醋酸。根系放到DeVere540显微图像分析仪下,在计算机上用NIH和BRC分析根直径、根分枝和根毛等指标。
1.3.3 指标测定
1) 烟株根系、农艺性状及养分含量。指标包括根长、根粗、分枝根、根夹角和根毛等,以及烟株农艺性状及地上部和地下部营养元素N、P、K的含量。烟草地上与地下部分烘干、称干重,3次重复。植株地上部和根部分别测定生物量后,将样品粉碎,用浓硫酸消煮后分别测定植株的氮、磷及钾含量。其中,植株氮含量用凯氏定氮仪测定,磷含量用钼锑抗比色法测定,钾含量采用火焰光度计测定[15]。
2) 生理活性。指标包括叶片净光合速率、硝酸还原酶活性和谷氨酰胺合成酶活性等。
测定叶片净光合速率:采用红外线气体分析仪(IRGA)测定。
硝酸还原酶活性[16]:制作标准曲线,取新鲜植物组织洗净,拭干。叶片打成直径1 cm的圆片,若是根、茎可切成0.1 cm厚的薄片。取上述材料4份,每份50片,称重后分别放入4个50 mL三角瓶中,其中1个为空白,3个用于酶活性测定,即3次重复。在空白瓶中先加30%三氯乙酸1 mL,然后在每个三角瓶中加入0.1 mol/L pH7.5磷酸缓冲液5 mL、蒸馏水5 mL。将三角瓶置于真空干燥器中抽气至样品完全沉入溶液中。取出三角瓶,避光30 min;之后在重复中也分别加入30%三氯乙酸1 mL以终止反应,摇匀。吸取2 mL反应液于10 mL试管中,加磺胺试剂2 mL,α-萘胺试剂2 mL,静置30 min;比色,记下吸光度(A)并计算结果。
谷氨酰胺合成酶活性:粗酶液提取,称取样品1 g于研钵中,加入提取缓冲液3 mL,置冰浴上研磨成匀浆,转移离心管中,4℃下12 000 r/min离心20 min,取上清液为粗酶液,取粗酶液0.8 mL和酶反应液2.2 mL混匀于40℃水浴30 min,加入0.8 mL终止液,于5 000 r/min离心10 min,取上清液测定540 nm下的OD值。
淀粉酶活性:制作标准曲线,称取样品2 g加入少许石英砂和氯化钠溶液2 mL研磨成匀浆,装入离心管放置15~20 min后,以3 000 r/min转速离心10 min,转移上清液于100 mL容量瓶定容、保存。取上述酶原液2 mL,加入 1%淀粉溶液2 mL,37℃水浴10 min,加入 3,5-二硝基水杨酸2 mL沸水浴5 min,冷却后蒸馏水定容至20 mL,于540 nm波长下测定OD值,记录数据并计算结果。
蔗糖合成酶活性:取3支10 mL具塞试管,加入酶反应液0.4 mL,UDPG 0.1 mL和透析后的酶液0.05 mL,补水至1 mL,于30℃水浴中反应10 min后,沸水浴3 min中止反应,对照用蒸馏水代替UDPG,冷却后测定体系蔗糖含量。
测定根系活力(TTC还原力)[17]:称取根尖样品0.5 g置于小烧杯中,加入0.4%TTC溶液和磷酸缓冲液 (pH7.0)各5 mL,使根充分浸没,37℃下暗保温1~2 h后加入1 mol/L硫酸2 mL,把根取出吸干水分,用乙酸乙酯3~4 mL充分研磨,提取液移入刻度试管,乙酸乙酯定容至10 mL,于分光光度计485 nm下比色。
根系总吸收面积及活跃吸收面积[18]:制作甲烯蓝溶液标准曲线,取待测烟株根系吸干水分用排水法测定根系体积。把0.000 2 mol/L甲烯蓝溶液加入3个小烧杯,每杯约10倍于根的体积,准确记下溶液用量,取根系用吸水纸小心吸干数次,慎勿伤根,然后顺次浸入盛有甲烯蓝溶液的烧杯中,每杯中浸1.5 min。每次取出时均使甲烯蓝溶液能从根上流回到原烧杯中。从3个烧杯中各取1 mL溶液加入试管,均稀释10倍,测得其光密度,查标准曲线求出每杯浸入根系后溶液中剩下的甲烯蓝毫克数,并求出根的吸收面积。
1.4 数据处理与分析
采用Sigmaplot 10.0和Excel 2010处理分析数据并制图。
2 结果与分析
2.1 不同处理烟株侧根及不定根的根长、根粗及表面积
从表1可知,不同处理烟株侧根和不定根的总根长、根粗及表面积的变化。侧根总根长和表面积:N1最长/大,分别为9.42 m和0.36 m2;N3最短/小,分别为7.12 m和0.27 m2;均为N1显著长于N3,N1与N2间和N2与N3间差异不显著。侧根根粗:N1最粗,为4.7 mm;N3最细,为3.7 mm;各处理间差异显著。不定根总根长:N3最长,为17.45 m;N1最短,为15.43 m;各处理间差异显著。不定根根粗:N1最粗,为1.4 mm;N3最细,为1.1 mm;N1显著粗于N3,N2与N3间差异不显著。不定根表面积:N1最大,为0.42 m2;N3最小,为0.31 m2;N1显著大于N3,N1与N2间和N2与N3间差异不显著。
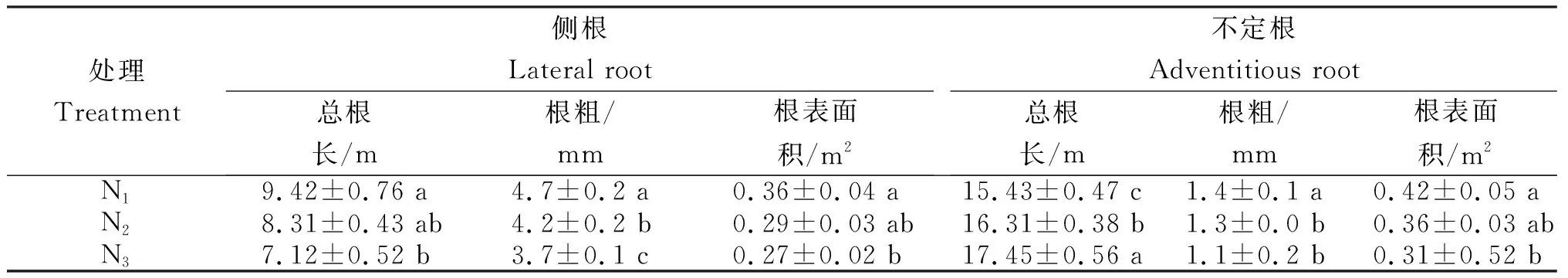
表1 不同营养水平烟株侧根及不定根的根长、根粗及表面积
2.2 不同处理烟株侧根与不定根的一二级分枝根密度及根毛密度
从表2看出,不同处理烟株侧根和不定根一二级分枝根密度及根毛密度的的变化。侧根:一二级分枝根密度分别为1.4~1.7条/cm和2.2~3.0条/cm,均为N3>N2>N1;一级分枝根密度各处理间差异不显著;二级分枝根密度N1显著大于N3,N1与N2间和N2与N3间差异不显著。根毛密度为140.1~214.3条/cm,依次为N3>N2>N1,各处理间差异显著。不定根:一二级分枝根密度分别为1.8~2.7条/cm和3.0~4.1条/cm,均为N3>N2>N1;一级分枝根密度N1显著小于N2和N3,N2与N3间差异不显著;二级分枝根密度各处理间差异显著。根毛密度为216.5~343.2条/cm,依次为N3>N2>N1,各处理间差异显著。

表2 不同营养水平烟株侧根和不定根的一二级分枝根密度及根毛密度
2.3 不同处理烟株的夹角根系状况
烤烟根系基本构型呈“T”型,不同角度根系主要功能存在一定差异。从表3可知,不处理烟株各夹角根系占比的变化。≤30°为14.5%~29.6%,依次为N3>N2>N1。<30°~≤60°和>60°分别为43.1%~50.3%和27.3%~35.2%,均为N1>N2>N3。表明,正常营养条件下,烟株根系基本呈T型结构,而低NPK浓度下,低角度(≤30°)的根系较为集中,养分匮乏会促进低夹角根系的生长。
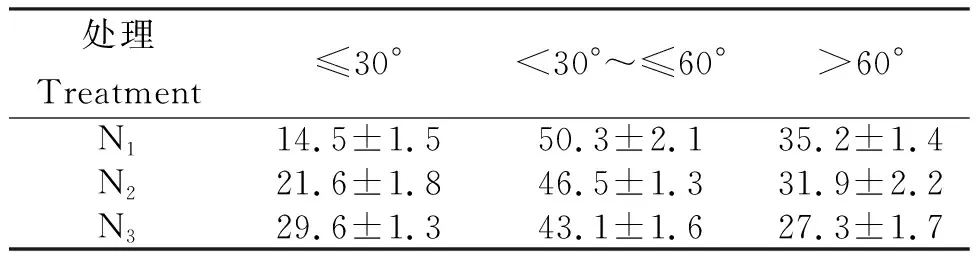
表3 不同营养水平烟株各夹根系角的占比
2.4 不同处理烟株的生长发育状况
从表4可知,不同处理烟株的株高、茎围和叶片数等的变化。株高:40.5~48.0 cm,依次为N1>N2>N3,N3显著矮/小于N1和N2,N1与N2间差异不显著。茎围:7.1~7.6 mm,依次为N1>N2>N3,N1显著大于N3,N1与N2间和N2与N3间差异不显著。叶片数:13.3~14.7片,依次为N1>N2>N3,各处理间差异显著。最大叶面积、叶重、茎重和根重:分别为450.7~576.4cm2、21.5~32.4 g、27.3~39.7 g和5.9~10.1 g,均为N1>N2>N3,各处理间差异不显著。

表4 不同营养水平烟株地上部和地下部的生长发育状况
2.5 不同处理烟株的生理特性
从表5可知,不同处理烟株的叶片和根系生理特性的变化。叶片:净光合速率N1最高,为20.3 μmol/(m2·s);N3最低,为16.6 μmol/(m2·s);N1显著高于N3,N1与N2间和N2与N3间差异不显著。硝酸还酶和谷氨酰胺合成酶活性均以N1最高,分别为54.4 μg/(g·h)和42.4 μmol/(mg·h);N3最低,分别为40.7 μg/(g·h)和32.3 μmol/(mg·h);各处理间差异显著。淀粉酶活性淀粉N1最高,为6.4 mg/(g·min);N3最低,为4.7 mg/(g·min);N1显著高于N2和N3,N2与N3间差异不显著。蔗糖合成酶活性:N1最高,为2.7 mg/(g·h);N3最低,为1.8 mg/(g·h);N3显著低于N1和N2,N1与N2间差异不显著。根系:根系活力N3最高,为252.7 TTC μg/(g·h);N1最低,为224.5 TTC μg/(g·h);N3显著高于N1和N2,N1与N2间和N2与N3间差异不显著。总表面积:N1最高,为0.78 m2;N3最低,为0.58 m2;各处理间差异显著。活跃吸收面积: 0.31~0.34 m2,各处理间差异不显著。表明,低浓度NPK营养液抑制烟株净光合速率及生理特性相关酶的活性。
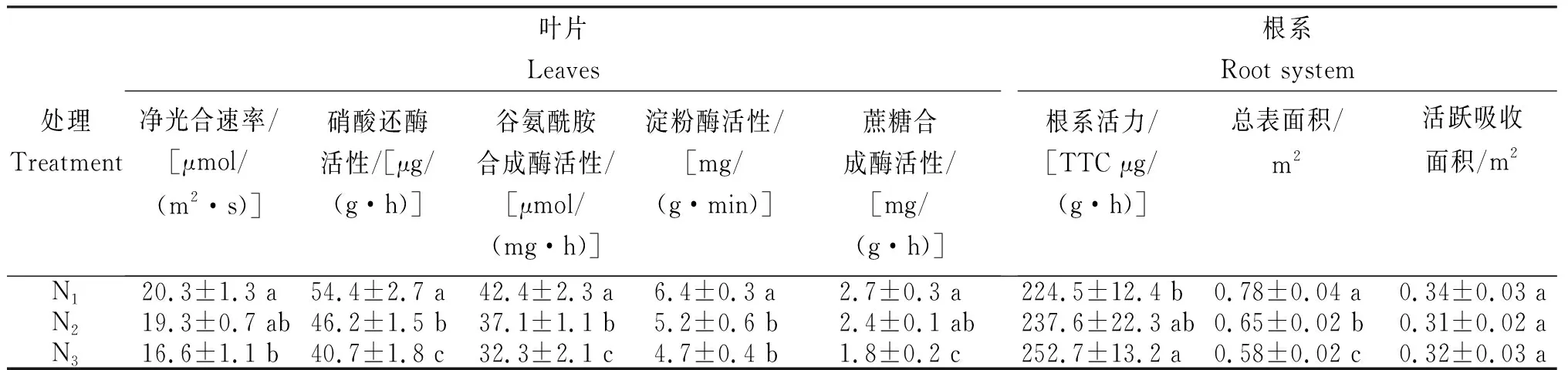
表5 不同营养水平烟株地上部和地下部的生理特性
2.6 不同处理烟株的N、P、K浓度与积累量
从图2看出,不同处理烟株地上部和根系N、P、K浓度与积累量的变化。N浓度与积累量:地上部和根系均为N1>N2>N3,地上部N浓度N1显著高于N3,N1与N2间和N2与N3间差异不显著,根系N浓度各处理间差异显著;地上部N积累量各处理间差异显著,根系N积累量N1显著高于N2和N3,N2与N3间差异不显著。P浓度与积累量:地上部和根系均为N1>N2>N3,各处理间差异显著。K浓度与积累量:地上部和根系均为N1>N2>N3,地上部K浓度各处理间差异显著,根系K浓度N1显著高于N3,N1与N2间和N2与N3间差异不显著;地上部和根系K积累量各处理间差异不显著。
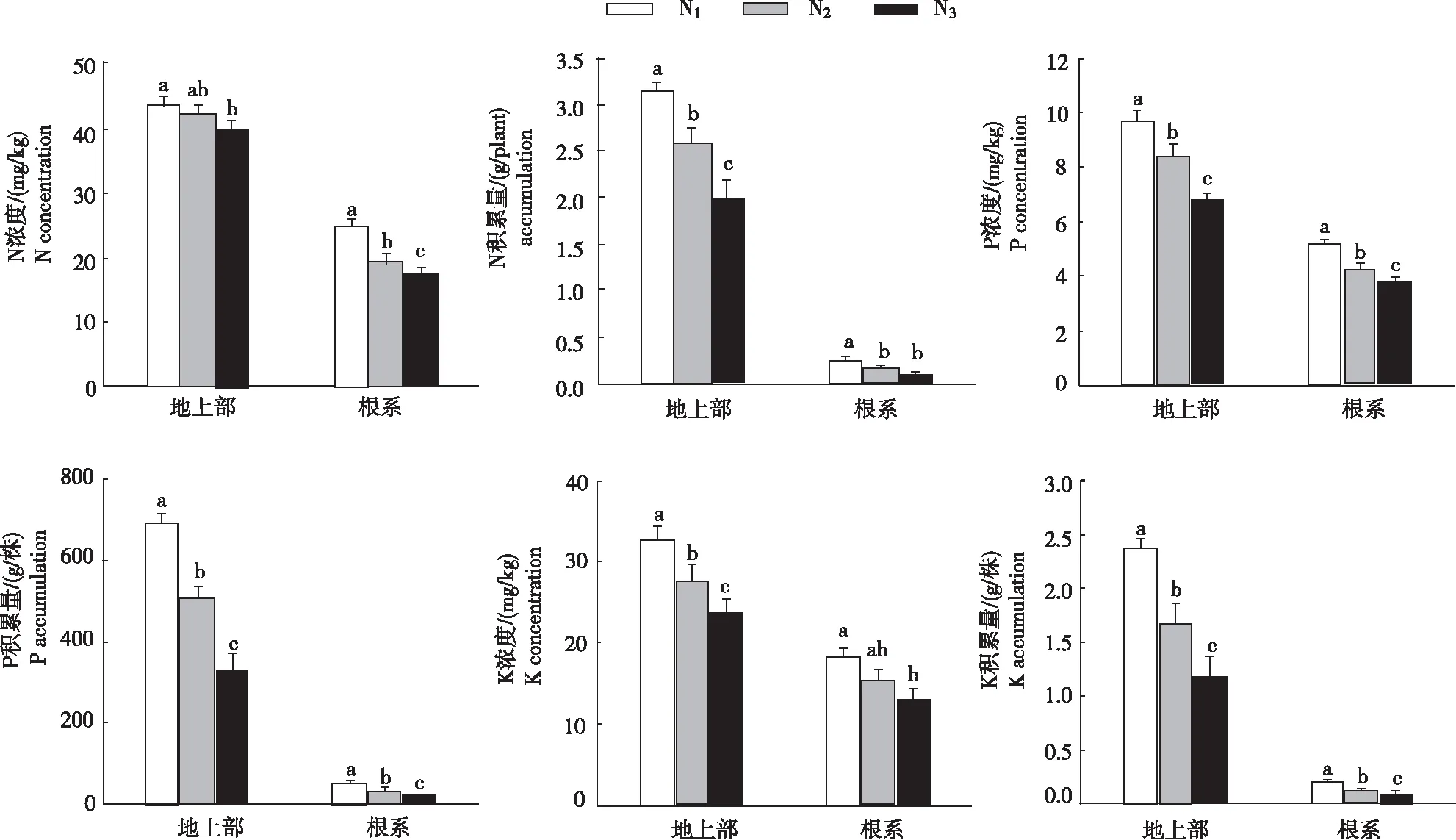
图2 不同营养水平烟株地上部和根系N、P、K的浓度与积累量
3 讨论
烟草是区域性农业结构调整的重要作物,也是广大农民脱贫致富的首选作物[8]。传统栽培模式过度关注地上部的产量,而忽视了作物根系生长对产量的贡献[9,19]。研究结果表明,Hogland全营养液(N1)烟株生长发育状况显著优于1/2 NPK Hogland全营养液(N2)和1/4 NPK Hogland(N3)。但在NPK缺乏的情况下,烟株的正常生长受明显抑制,其株高、茎围、叶片数、最大叶面积、干重等农艺性状均低于全营养处理。此外,低养分条件下,烟株净光合速率、硝酸还原酶、谷氨酰胺合成酶、淀粉酶及蔗糖合成酶活性降低,不利于相关化学成分的合成,且烟株地上部和根部NPK浓度及NPK积累量降低。虽然全营养水平有助于烟草生长,而NPK营养胁迫下对烟草根系活力却具有一定的促进作用。随着Hogland营养液中NPK浓度的降低,侧根及不定根的密度增大,且各处理侧根和不定根的一二级分枝根密度及根毛密度逐渐增大。可能原因:NPK营养胁迫致使侧根及不定根的密度提高。低NPK Hogland全营养液浓度下,烟株低角度(≤30°)根系较为集中,亦可促进低夹角下根系的生长。在烟草田间施肥管理过程中,应适当调整施肥时间,用养分饥饿处理方式促进烟草根系的生长发育;当烟草侧根与不定根发育至适当阶段,再施适量养分,不仅能提高整株烟草的生物量,亦可促进其根系的生长发育。但是,养分胁迫管理不能盲目开展,应根据生长环境与栽培区域有计划地开展。
侧根和不定根是烟草根系构成的主要部位,对烟株生长发育至关重要,而单一营养元素缺乏对烟草根系生长的作用明显[20]。烟草缺少氮肥导致细胞分裂素合成酶(IPT)活性降低,其促进细胞分裂素含量升高进而诱导侧根数量的增加,扩大根系与土壤的接触面积以吸收更多的氮元素,此过程中氮肥诱导生长素相关通路的基因表达量出现差异性表达,以辅助侧根的生长[21]。但长期缺少氮肥,烟草根系变白及活力降低。研究结果表明,氮肥可显著促进烟株生物量的增加及根系发育,高氮条件下植株根系较缺素条件更发多,与前人的研究结果不同。磷在酸性土壤中扩散系数很低,极易被土壤胶体中的铁、铝等金属元素固定而难以移动,因此根系的发育对土壤中磷元素的吸收至关重要[22]。低磷条件下,大豆和水稻侧根根原基细胞内促进生长的通路被激活,侧根数量与根密度较高磷水平更多或更大[23];拟南芥在缺磷刺激下,侧根原基加快突破主根表皮细胞[24-25]。而烟草在低磷环境中,根系有向两侧浅层扩展生长的趋势。目前,我国优质烟评价要求K含量2.0%以上,生产上应补充钾肥的使用量[26],但是南方酸性土壤淋溶作用较强,钾肥流失较快,且烟草对钾肥缺素敏感性较弱,优质烤烟生产上钾肥用量应采用薄肥多施策略[27]。
4 结论
NPK Hogland全营养液处理烟株的农艺性状最佳,地上部和根系NPK浓度与积累量最大,净光合速率和相关酶活性效果最大或最高;1/4 NPK Hogland全营养液处理烟株的一二级分枝根密度与根毛密度最大。

