血浆(1-3)-β-D葡聚糖对AIDS合并CM预后评估价值研究
涂文瑶, 何 娟, 龙 海, 吴 君, 梁跃东,
(1.贵州医科大学, 贵州 贵阳 550004 2.贵州省贵阳市公共卫生救治中心感染科, 贵州 贵阳 550004)
获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS)是人类免疫缺陷病毒(human immunodeficiency virus,HIV)侵犯机体CD4+T淋巴细胞,导致细胞免疫功能紊乱及缺陷引起的以全身免疫系统损害为特点的严重传染性疾病[1]。隐球菌性脑膜炎(cryptococcal meningitis,CM)是AIDS患者常见的发病率及死亡率较高的机会性真菌感染[2],约占全球获得性免疫缺陷综合症患者相关死亡的15%[3]。了解AIDS合并CM预后影响因素并进行干预及防治是降低病死率的关键,但目前研究仍缺乏一个可靠的有预后评估价值的金指标。因此,寻求和探索一个快速、高敏感和高特异性的预后指标成为该领域需要迫切解决的问题。(1-3)-β-D葡聚糖是广泛存在于真菌细胞壁的真菌特异性抗原,当真菌侵入人体时,(1-3)-β-D葡聚糖经吞噬细胞吞噬、消化,从真菌细胞壁释放入血,导致血浆(1-3)-β-D葡聚糖浓度升高[4]。血浆(1-3)-β-D葡聚糖检测(简称G实验)通过检测真菌特异性抗原成分或特异性酶的微生物学检测方法诊断真菌感染,该方法取材方便,操作简单,创伤小,可快速诊断。血浆(1-3)-β-D葡聚糖对AIDS合并CM预后评估价值的研究在国内外的报道较少,本研究旨在探究血浆(1-3)-β-D葡聚糖对AIDS合并CM预后评估价值。
1 材料与方法
1.1研究对象:选择2015年1月1日至2020年12月31日贵阳市公共卫生救治中心接诊AIDS合并CM患者66例,均进行血浆(1-3)-β-D葡聚糖检测。纳入标准:首次诊断隐球菌脑膜炎且初次接受抗真菌治疗的AIDS合并CM患者。AIDS诊断标准符合《中国艾滋病诊疗指南(2018版)》诊断标准[5]。CM诊断标准:脑脊液隐球菌墨汁染色涂片阳性和或培养阳性[6]。排除标准:合并结核性脑膜炎、病毒性脑膜炎、化脓性脑膜炎、念珠菌、肺孢子菌肺炎、马尔尼菲篮状菌、曲霉菌等及临床资料不齐患者。
1.2研究方法:根据66例患者1年内生存状况将患者分为两组:生存组56例及死亡组10例。收集两组患者的性别、年龄、传播途径、临床症状(头痛、发热、呕吐及意识障碍),头颅影像学检查、入院时实验室检查(CD4+T淋巴细胞计数、HIV-RNA病毒载量、外周血血红蛋白、外周白细胞计数、外周血中性粒细胞计数、C反应蛋白、血沉、PCT、脑脊液葡萄糖、脑脊液氯化物、脑脊液蛋白、脑脊液培养、脑脊液涂片、血液隐球菌培养、血浆(1-3)-β-D葡聚糖浓度)及抗真菌治疗后第一次血浆(1-3)-β-D葡聚糖浓度(入院时实验室检查均在抗真菌治疗前完成,抗真菌治疗后第一次血浆(1-3)-β-D葡聚糖浓度检测均在抗真菌治疗后7~10d完成)。

2 结 果
2.1AIDS合并CM患者基本情况:共纳入患者66例,其中男性55例(83.33%),女性11例(16.67%),平均(42.1212.77)岁,其中异性传播54例(81.82%),同性传播8例(12.12%),血液传播或母婴传播4例(6.06%)。死亡组患者10例(15.15%),生存组患者55例(84.85%),单因素分析提示PCT、CD4+T淋巴细胞、血浆(1-3)-β-D葡聚糖浓度是AIDS合并CM患者死亡危险因素,差异有统计学意义(P<0.05)。年龄、性别、传播途径、临床症状(头痛、发热、呕吐及意识障碍),头颅影像学检查、血浆HIV-RNA病毒载量、外周血血红蛋白、外周白细胞计数、外周血中性粒细胞计数、C反应蛋白、血沉、脑脊液葡萄糖、脑脊液氯化物及脑脊液蛋白、脑脊液培养、脑脊液涂片、血液隐球菌培养差异无统计学意义(P>0.05),见表1。

表1 AIDS合并CM患者基本情况(%)
2.2AIDS合并CM患者抗真菌治疗前后血浆(1-3)-β-D葡聚糖浓度比较:66例患者入院后都进行了规律的抗真菌治疗(采用包括两性霉素B、氟胞嘧啶和氟康唑在内的标准方案)及抗逆转录病毒治疗,死亡组抗真菌治疗前血浆(1-3)-β-D葡聚糖浓度中位数151.72pg/mL,明显高于生存组的54.83pg/mL,两组间比较有统计学意义(P<0.01),死亡组患者抗真菌治疗后的血浆(1-3)-β-D葡聚糖浓度中位数59.00pg/mL,较抗真菌治疗前151.72pg/mL明显下降,差异无统计学意义(P>0.05),具体见表2。
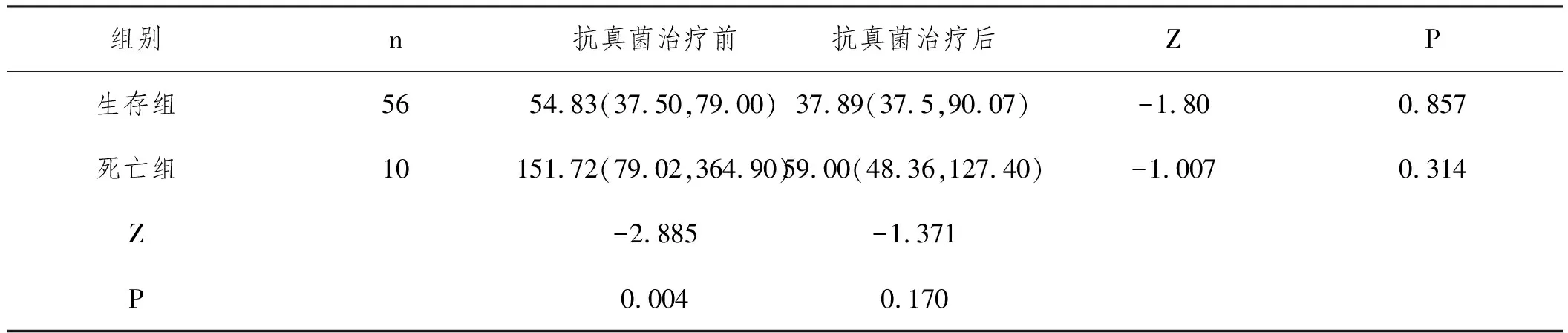
表2 66例AIDS合并CM患者抗真菌治疗前后血(1-3)-β-D葡聚糖浓度比较(pg/mL)
2.3AIDS合并CM患者多因素Logistic分析:以患者1年预后(1=生存,2=死亡)为因变量,将单因素分析有统计学意义的变量PCT、CD4+T淋巴细胞、血浆(1-3)-β-D葡聚糖浓度因素按中位数调整后纳入多因素Logistic回归分析,结果显示:高浓度血浆(1-3)-β-D葡聚糖是AIDS合并CM患者独立预后危险因素。见表3。
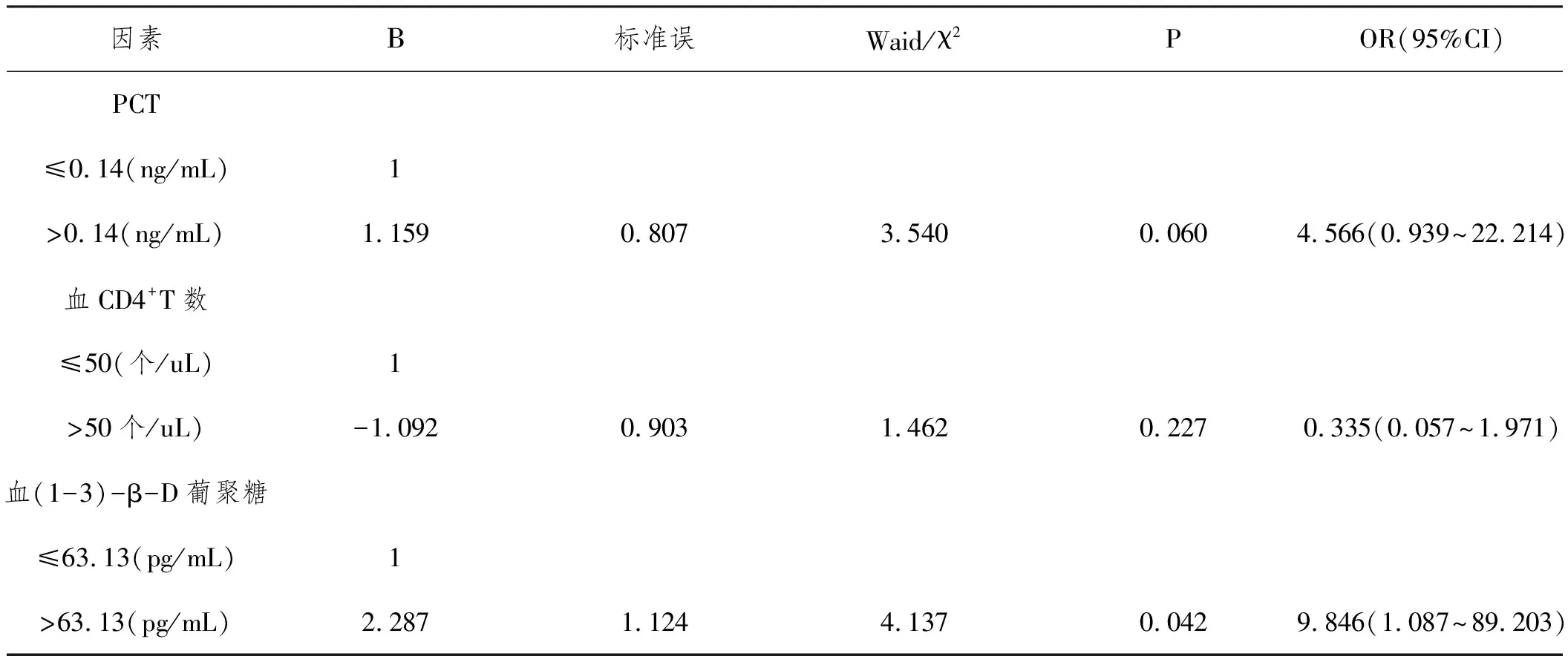
表3 影响AIDS合并CM患者预后的多因素Logistic回归分析
2.4ROC曲线分析确定血浆(1-3)-β-D葡聚糖最佳预测死亡值:血浆(1-3)-β-D葡聚糖用于AIDS合并CM预测死亡的ROC曲线下面积(area under curve,AUC)为0.787,95% 置信区间(confidence interval,CI)为0.665~0.910,预测值为65.63pg/mL时Youden指数最大,最佳预测值为65.63pg/mL,此时敏感度和特异度分别为90.0%和62.5%,(P<0.05),见图1。

图1 血(1-3)-β-D葡聚糖浓度对预测AIDS合并CM死亡的ROC曲线
3 讨 论
CM是隐球菌透过血脑屏障侵入中枢神经系统引起的深部真菌病,是AIDS常见的严重机会性真菌感染,及时抗真菌治疗是降低AIDS合并CM死亡率的有效方法[7]。目前抗真菌治疗期间尚缺乏一个金指标用于预后的评估,因此积极寻找对AIDS合并CM预后有评估价值的指标具有重要的临床意义。血浆(1-3)-β-D葡聚糖检测是检测侵袭性真菌感染的辅助诊断手段,自2008年欧洲癌症研究组及真菌研究组将其纳入检测除曲霉菌之外的其他菌种真菌感染的诊断指标后,血浆(1-3)-β-D葡聚糖检测取得美国FDA(Food and Drug Administration)批准后逐渐在全球范围得广泛应用[8]。目前,国内外探索血浆(1-3)-β-D葡聚糖与真菌感染预后关系的研究少见,为此本研究排除其他真菌感染的AIDS合并CM患者,避免其他真菌对血浆(1-3)-β-D葡聚糖的影响后通过分析不同预后的AIDS合并CM患者血浆(1-3)-β-D葡聚糖浓度,探讨血浆(1-3)-β-D葡聚糖对其预后评估价值。
目前血浆(1-3)-β-D葡聚糖检测在CM的应用存在争议,有专家不建议将血浆(1-3)-β-D葡聚糖检测用于CM的推定诊断[9],但部分学者[10]认为血浆(1-3)-β-D葡聚糖检测可以用于诊断CM,且有很多研究[11~13]证实血浆(1-3)-β-D葡聚糖升高可以发生在AIDS合并CM患者。本研究在66例AIDS合并CM患者血浆中检测到(1-3)-β-D葡聚糖,且浓度有不同程度升高,死亡组血浆(1-3)-β-D葡聚糖明显高于生存组。与我们研究相同,Bellanger等[11]也证实血浆(1-3)-β-D葡聚糖在AIDS合并CM患者体内明显升高。Obayashi等[13]也在6例CM死亡患者体内检测到血浆(1-3)-β-D葡聚糖,其平均值高达538pg/mL,进一步证明高浓度血浆(1-3)-β-D葡聚糖AIDS合并CM患者预后较差。
本研究中66例AIDS合并CM患者均进行了规律的抗真菌治疗,生存组抗真菌治疗后的血浆(1-3)-β-D葡聚糖较抗真菌治疗前变化不大,死亡组患者抗真菌治疗后的血浆(1-3)-β-D葡聚糖较抗真菌治疗前明显下降。这提示我们动态监测治疗过程中血浆(1-3)-β-D葡聚糖浓度变化对评估AIDS合并CM患者预后有一定指导作用。
本研究经ROC曲线分析确定血浆(1-3)-β-D葡聚糖为65.63pg/mL是预后评估的最佳临界值,其敏感度与特异性分别为90%、62.5%,提示血浆(1-3)-β-D葡聚糖对AIDS合并CM患者总体死亡预测价值较好,并经多因素Logistic回归分析证实高浓度血浆(1-3)-β-D葡聚糖为AIDS合并CM独立死亡危险因素。由此可见,血浆(1-3)-β-D葡聚糖>65.63pg/mL的AIDS合并CM患者预后较差,临床上应尽早采取干预措施,尽可能降低患者病死率。
综上所述,血浆(1-3)-β-D葡聚糖在AIDS合并CM患者体内高表达,是AIDS合并CM预后影响因素。血浆(1-3)-β-D葡聚糖对AIDS合并CM患者预后具有较高评估价值,当血浆(1-3)-β-D葡聚糖>65.63pg/mL是提示患者死亡风险高,临床上应加强对该类患者的管理和治疗,尽可能降低病死率。

