连续性肾脏替代治疗急性肾功能衰竭疗效及对T淋巴细胞炎症因子和血清电解质水平的影响
韩瑞萍, 袁光新, 陈 慰, 苏 清, 朱梦莉, 王智超
(1.湖北省武汉市第一医院急诊医学科, 湖北 武汉 430000 2.泰康同济(武汉)医院重症医学科, 湖北 武汉 430033)
急性肾功能衰竭(Acute renal failure ARF)是临床常见危重疾病之一,死亡率较高,可达10%~15%[1]。ARF患者多因呕吐、呼吸急促等就诊,可导致肾功能急速减弱,出现炎症反应,降低免疫功能[2]。血液替代疗法主要通过体外循环将各种代谢物质、异常血浆、药物及毒素等进行有效清除,纠正内环境紊乱的技术,是临床治疗危重疾病常用方法,可有效改善患者临床症状,但目前临床对于治疗过程中的用药尚无统一规范,临床用药复杂,且治疗周期长,因此采取科学有效的血液替代疗法完成治疗操作十分必要。间歇性血液透析(IHD)及连续性肾脏代替治疗(CRRT)是临床常用的两种不同血液替代疗法,其中IHD是治疗ARF的主要手段,且在很长一段时间内取得了较好效果;而随着科技的进步,CRRT因其安全性高,操作性强等特点逐步成为临床首选方法。本次研究主要观察两种方式在ARF患者中的临床疗效,及其对T淋巴细胞、炎性因子及水电解质的影响,旨在为临床提供更多的可行性方案,具体结果如下。
1 资料与方法
1.1一般资料
1.1.1研究对象:经医学伦理委员会审批后,采用简单随机抽样法将2019年6月至2020年6月在我院治疗的161例ARF患者分为观察组(n=81)与对照组(n=80)。两组患者性别、年龄、原发病等一般临床资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。纳入标准:①符合《肾脏病学》[3]中关于ARF的临床诊断标准:肾小球滤率48h内突然下降,血肌酐绝对值增加≥0.3mg/dl(≥26.5μmoL/L),或在排出梗阻性肾病或脱水状态下,超过6h以上时间尿量均<0.5mL·kg-1·h-1,B超可见肾体积增大、肾皮质增厚;②无凝血障碍,严重低血压等,临床治疗依从性好;③知情且同意者。排除标准:①有严重低血压,凝血功能障碍,恶性肿瘤者;②有肾移植手术史,或终末期肾病者;③参与其他研究或无法完成治疗周期者;④严重过敏体质者。
表1 两组患者一般资料临床比较
1.2方 法
1.2.1治疗方法:两组患者均基于常规对症治疗,补充血容量,纠正水电解质紊乱,防感染,预防并发症及营养支持等。观察组患者在此基础上给予IHD治疗,具体如下:透析仪器为Prismaflex M100 set血液透析滤过器(法国 Gambro Industries 公司生产)和金宝透析机(Gambro Lundia AB 公司生产),超滤系数为40 mL /min,透过面积为1.3m2,4~5h/次,2~3次/周,每次透析液流量为500 mL /min,其中透析液为碳酸氢盐溶液。观察组患者采用CRRT治疗,具体日下:选取患者颈内右侧静脉通过过 Seldinger技术进行双腔导管留置(共72次)。其治疗仪器设备为PRISMA机器、FH66D型血率器、FH55型滤器,置换液为Port配方,选取同步输入模式,领单独输入碳酸氢盐置换液。设定白天治疗时间10~12h,输入16~24L碳酸氢铵置换液,24h不间断输入Port配方液。注意检查置管情况,透析过程中出现凝血则可根据重程度给予肝素或置换液冲洗滤器和管路,控制置管时间越长则效果越理想。
1.2.2指标检测方法:于治疗前、治疗3个月后分别采集两组患者空腹静脉血样,离心处理后置于-80℃冰箱,经流式细胞仪检测两组患者免疫功能指标(CD3+、CD4+、CD8+、CD4+/CD8+)水平。采用全自动生化仪测定两组患者肾功能指标[血尿素氮(BUN)、血清肌酐(Scr)、内生肌酐清除率(Ccr)、β2微球蛋白(β2-MG)]及炎症因子[白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)及肿瘤坏死因子-α(TNF-α)]及血清电解质[钾(K+)、钠(Na+)、氯(Cl-)]水平。
1.3评定标准:显效:各项指标恢复至正常标准;有效:治疗后病情有所好转,相关指标接近正常标准;无效:治疗后病情无缓解或继续恶化。临床总有效=显效+有效。
1.4观察指标:比较两组患者临床疗效,观察治疗前、治疗3个月后两组患者T淋巴细胞(CD3+、CD4+、CD8+、CD4+/CD8+)、炎症因子(IL-1、IL-6、IL-8、TNF-α)、血清电解质(K+、Na+、Cl-)、肾功能指标(BUN、Scr、Ccr、β2-MG)变化情况。

2 结 果
2.1两组患者临床疗效比较:治疗3个月后,观察组患者临床总有效率为96.3%,明显高于对照组的87.5%(P<0.05),见表2。
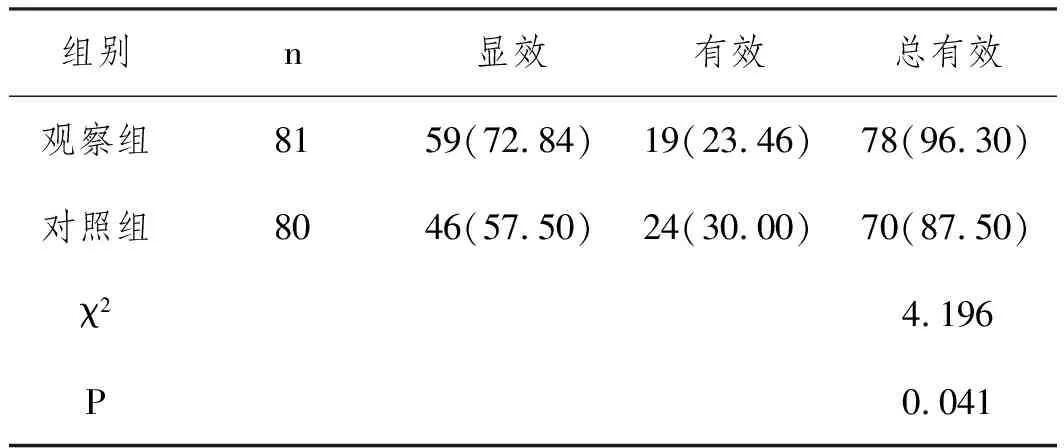
表2 两组患者临床疗效比较n(%)
2.2两组患者T淋巴细胞比较:治疗3个月后,两组患者CD3+、CD4+、CD4+/CD8+水平均高于治疗前,CD8+水平均低于治疗前,且两组治疗前后CD3+、CD4+、CD4+/CD8+、CD8+差值组间比较,差异具有统计学意义(P<0.05),见表3。

表3 两组患者T淋巴细胞亚群比较
2.3两组患者血清炎性因子水平比较:治疗3个月后,两组患者血清炎性因子IL-1、IL-6、IL-8、TNF-α水平均低于治疗前,且两组治疗前后差值组间比较,差异具有统计学意义(P<0.05),见表4。
表4 两组患者血清炎性因子比较
2.4两组患者血清电解质水平比较:治疗3个月后,两组患者血清电解质K+、Na+、Cl-水平均低于治疗前,且两组治疗前后差值组间比较,差异具有统计学意义(P<0.05),见表5。

表5 两组患者血清电解质水平比较
2.5两组患者肾功能指标比较:治疗3个月后,两组患者BUN、Scr、β2-MG水平均低于治疗前,Ccr水平均高于治疗前,且且两组治疗前后BUN、Scr、β2-MG、Ccr差值组间比较,差异具有统计学意义(P<0.05)见表6。

表6 两组患者肾功能指标比较
3 讨 论
ARF是肾内科常见危重疾病之一,其主要与患者机体肾小球滤过率急剧下降有关,发病后患者可出现突然呕吐、呼吸急促、脱水、电解质紊乱等症状,造成肾功能衰竭,严重者还可危害患者生命安全,因此必须尽早治疗。目前临床多采用肾脏代替疗法治疗,IHD与CRRT均是临床常用的肾脏代替疗法,但有学者指出,IHD在治疗过程中可导致ARF患者水、毒素处于高负荷状态,加重血流动力学紊乱,引起低血压等危害,损伤脏器功能,远期治疗效果并不十分理想[4]。
CRRT主要通过对流、弥散等方式对患者机体代谢物进行交换和清除,可持续代替已损伤的肾脏功能。本次研究结果显示,观察组患者临床总有效率高于对照组,分析原因可能由于CRRT可持续、稳定代谢机体相关毒素,且不影响血流动力学及电解质水平有关。研究发现,CRRT可维持血流动力学、渗透压稳定,具有减轻心血管不良事件的优势[5]。严重感染是ARF发病的重要危险因素,可严重影响患者机体免疫力。有学者指出,外来抗原可降低机体T淋巴细胞等相关因子的分泌,导致免疫调节紊乱[6],本次研究结果显示,治疗3个月后,观察组患者CD3+、CD4+、CD4+/CD8+水平均高于对照组;CD8+水平低于对照组。提示CRRT可较好改善患者免疫功能。分析原因可能是CRRT能连续、缓慢代谢患者体内毒素,降低炎性反应,重建免疫平衡有关。炎性因子的释放是导致机体出现炎性联级反应的主要原因之一,也是加重肾脏损伤的重要因素,对患者预后十分不利。研究报道,CRRT联合血液灌流能有效改善ARF患者IL-1、IL-6、IL-8、TNF-α水平,减轻炎性反应,提高临床疗效[7]。另外,彭博[8]等研究认为,CRRT虽炎性介质的清除是没有选择性的部分清除。本次研究结果显示,治疗3个月后,两组患者血清炎性因子IL-1、IL-6、IL-8、TNF-α水平均低于对照组,进一步证实CRRT在ARF中的抗炎效果。分析原因可能是CRRT能通过对流清除TNF-α,增加超滤速率,增加血清炎性因子清除效果。
急性ARF发病后可在短时间内出现肾功能急剧下降,导致电解质紊乱,大量代谢物质堆积,引起高血钾症等。CRRT治疗疾病主要是代替肾脏将体内毒素等代谢物质进行有效代谢,维持机体内环境稳定[9]。本次研究结果显示,观察组患者血清电解质K+、Na+、Cl-水平均低于对照组。说明CRRT治疗ARF可有效维持患者机体内环境稳定,分析原因推测一方面CRRT治疗时,脱水速度慢,可维持血流动力学稳定,避免肾功能进一步损害;另一方面,CRRT帮助患者将体内多于水分缓慢排出,保证血管、细胞内外渗透压处于平衡稳定状态,维持酸碱平衡。
BUN、Scr是反应ARF患者肾脏损伤程度的重要指标。但肾脏代谢能力强,早期BUN、Scr水平变化并不十分明显,且容易受到体重、尿量等多种因素的影响,导致其敏感性相对较低。β2-MG是近年来认为可有效反应早期肾损伤的敏感指标[10]。周爽[11]研究显示,血液净化可促进ARF患者肾功能恢复,提高临床生存率。本次研究结果显示,观察组患者BUN、Scr、β2-MG水平均低于对照组,Ccr水平高于对照组。说明CRRT可有效改善ARF患者肾功能。分析原因为CRRT可长期平稳将体内毒素代谢出去,可维持血流动力学、电解质稳定,减少容量波动,加速BUN、Scr等清除速率,改善患者预后。
综上所述,CRRT治疗ARF患者效果显著,可降低患者炎性水平,调节电解质平衡,提高机体免疫力,改善肾功能。

