藻蓝蛋白对四氯化碳诱导的大鼠肝纤维化及肠道微生物的影响
翟诗翔 ,李文军 ,李莉莉 ,王 莉,秦 松
(1.中国科学院烟台海岸带研究所,山东 烟台 264003; 2.中国科学院大学,北京 100049; 3.烟台市奇山医院,山东 烟台 264001; 4.中国科学院海洋大科学研究中心,山东 青岛 266071)
肝纤维化(hepatic fibrosis)是肝脏在受到刺激反复或连续损伤时肝脏细胞对这些损伤的修复反应。当长期伤害或炎症导致肝脏中过多的疤痕组织积聚,就会发生肝纤维化。肝纤维化是所有慢性肝病发展成为肝硬化的必经阶段,晚期肝纤维化会发展为肝衰竭甚至肝癌[1]。目前肝脏疾病在世界范围内发病率和死亡率都很高,这与日益增加的经济和社会影响有关。而目前缺乏治疗肝纤维化的有效疗法。
由于肝纤维化的发生涉及多个因素多条通路的参与,肝纤维化的防治也比较困难。目前在肝纤维化的治疗上还没有特效药,仅有鳖甲软肝片和扶正化瘀片这两种中药被批准用来治疗肝纤维化[2]。最近很多研究表明肝脏疾病和肠道微生物相关。肠道和肝脏能通过胆道、门静脉和体循环进行物质交换。肠道中宿主和微生物的代谢物,能通过门静脉易位至肝脏,影响肝脏中的胆汁酸合成,葡萄糖和脂质代谢。如芳香族的氨基酸的微生物代谢产物苯乙酸在非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)的发病进展中起着关键的作用[3]。肠道微生物产生的脂多糖(lipopolysaccharide,LPS)等病原相关分子模式(pathogen associated molecular patterns,PAMPs)也能通过肠屏障,经循环系统进入到肝脏中,激活肝脏巨噬细胞,产生促炎因子,造成肝脏损伤及纤维化[4-5]。因此,肠道微生物的稳态能影响肝脏的健康,临床上观察到肝脏疾病患者体内存在肠道微生物失调的多种情况[6]。
藻蓝蛋白(phycocyanin,PC)是一种天然的色素蛋白,通常存在于蓝藻和红藻中,目前规模化制备的PC大多来自螺旋藻。近年来的研究证明PC具有抗肺纤维化、保肝和调节肠道菌群的作用[7-10],同时PC还容易得到,安全无毒。PC的这些优良特性表明其可能是一种改善肝纤维化的潜在物质。本文探究了 PC对 CCl4诱导造成的肝纤维化的改善效果及对肠道菌群的影响,解释了肠道菌群在PC抗纤维化过程中的作用机理。
1 材料
1.1 仪器
7500型实时定量 PCR仪(Applied Biosystems,7500 Fast System),Basic电泳仪(Bio-RAD,Power-Pac Basic),凝胶成像分析系统(Bio-RAD,Chemi-Doc XRS+),正置显微镜(Zeiss,Axio Scope.A1),包埋机(Leica,ARCADIA),石蜡切片机(Leica,RM2235)。
1.2 药物与试剂
本实验中所用的 PC(产品单号 C-190430,Amax/A280=3.0)购自福清市新大泽螺旋藻有限公司; RNAiso Plus(Total RNA 提取试剂)、PrimeScript™ RT reagent Kit with gDNA Eraser (Perfect Real Time)、TB Green™Premix Ex Taq™ II (Tli RNaseH Plus) 购于Takara公司; HE染色试剂盒和Masson染色试剂盒购于北京索莱宝科技有限公司。
1.3 实验动物
SPF级Wistar雄性大鼠21只,体重130~160 g,购自济南朋悦实验动物繁育有限公司,许可证号:SCXK(鲁) 2019 0003。饲养于山东国际生物科技园。
2 方法
2.1 实验动物分组及干预
饲养条件: 温度 (23±2) ℃,相对湿度(45±10)%,光照周期为12 h光照/12 h黑暗,自由进食和进水。适应性饲喂一周后,以体重为标签,将 21只大鼠随机分成3 组,每组7只。分组方式为: 对照组(NC),肝纤维化组(FIB),CCl4+PC干预组(FIB_PC)。CCl4+PC干预组每天灌胃100 mg/kg的PC,对照组灌胃同等体积的蒸馏水,持续4周。用腹腔注射CCl4的方法建立肝纤维化模型,具体方法为: 腹腔注射体积分数为12.5%的CCl4橄榄油溶液,以0.01 mL/g体重每周注射2次,持续4周[11]。
2.2 样本采集
大鼠的粪便于干预的最后一天采集。将大鼠轻轻抓取起来时大鼠就会排便(若无粪便排出,可用消毒棉签轻轻刺激大鼠的肛门,即可排便),将刚排出的粪便样品收集于无菌的冻存管中,然后立即放入液氮中冷冻后,置于-80 ℃ 冰箱进行保存。
2.3 大鼠肝脏组织的HE和Masson染色
腹腔注射质量分数为10%的水合氯醛溶液(0.3 mL/100 g大鼠),使大鼠进入麻醉状态后,取肝脏中的最大叶,置于质量分数为 4%的多聚甲醛固定液中固定,在4 ℃冰箱内固定24 h后,按说明书的方法进行HE染色(苏木精-伊红染色,hematoxylin and eosin stain)和 Masson染色(又称马森三色染色法,masson’s trichrome stain),通过鉴定肝组织中炎性细胞和纤维化的程度来判断肝纤维化的阶段。将剩余的肝脏组织于-80 ℃冰箱中保存,以备后续检测相关基因的表达。
2.4 RT-PCR检测大鼠肝脏组织中纤维化标志物的表达
每组取3只大鼠肝组织,用RNAiso Plus试剂提取总 RNA。肝纤维化标志物 I型胶原蛋白(collagen type I,Co-I)和α-平滑肌肌动蛋白(alphasmooth muscle actin,α-SMA)的扩增引物由北京睿博兴科生物技术有限公司合成。序列如下所示:α-SMA_F GCCATCAGGAACCTCGAGAA; α-SMA_R AGCTGTCCTTTTGGCCCATT; Co-I_F GGAGAGA GCATGACCGATGG; Co-I _R GGGACTTCTTGAG GTTGCCA; β-actin_F CGTAAAGACCTCTATGCC AACA; β-actin_R GGAGGAGCAATGATCTTGA TCT。每个样本设置2个技术平行。PCR反应条件为: 先 95 ℃预变性 30 s,进入循环,循环 40 次,循环条件为 95 ℃变性5 s,60 ℃退火和延伸 30 s。以 β-actin 作为内参,用双德尔塔 Ct法(2-ΔΔCt)计算目的基因的相对表达量。
2.5 肠道菌群的高通量测序
利用粪便 DNA 提取试剂盒提取大鼠粪便样本的基因组DNA。以细菌的 16S 核糖体RNA基因的V3—V4 可变区引物(338F 5′-ACTCCTACGGGAG GCAGCAG-3′和 806R 5′-GGACTACHVGGGTWTC TAAT-3′),将所提取的 DNA 样本进行的 PCR 扩增(ABI GeneAmp®9700型 PCR仪)。2%琼脂糖电泳检测扩增样品,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收 PCR产物,使用TruSeqTM DNA Sample Prep Kit试剂盒(Illumina公司)构建MiSeq文库,并根据测序流程利用Illumina MiSeq测序平台进行测序。
2.6 统计学方法
用IBM SPSS Statistics 22软件对数据进行统计分析,最终结果以平均值±标准差(±s)呈现,用单因素方差分析检验不同组之间的显著性,用wilcoxon秩和检验分析不同组菌群之间的显著性。P<0.05表明不同组之间有显著性差异。
3 结果
3.1 PC对 CCl4诱导大鼠肝纤维化标志物的影响
各组干预后组织中α-SMA和Co-I的mRNA的相对表达量如图1所示。FIB组肝脏中α-SMA和Co-I的表达量较NC组显著升高(P<0.05),而与FIB组相比,FIB_PC组肝脏中α-SMA和Co-I的表达量显著降低(P<0.05)。
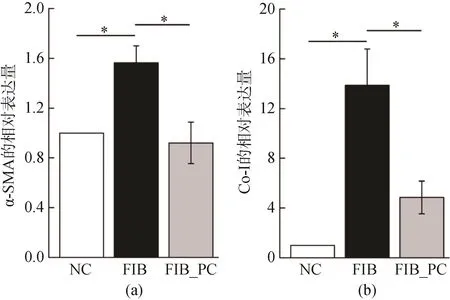
图1 PC对α-SMA (a) and Co-I (b)表达的影响Fig.1 Effects of phycocyanin on the liver expression of alpha-smooth muscle actin (α-SMA) (a) and collagen type I (Co-I) (b).
3.2 大鼠肝脏病理分析
用HE染色和 Masson染色评价大鼠的肝损伤程度。HE染色结果显示,NC组中大鼠的肝脏结构正常,FIB组中出现了大量的嗜酸小体和大量空泡样变性的肝细胞。FIB_PC组中嗜酸小体和空泡样变性的肝细胞较 FIB组都有所减轻。Masson染色结果显示,NC组仅在汇管区存在少量的被染成蓝色的胶原纤维,而 FIB组中汇管区周围存在大量的胶原纤维,且胶原纤维连在了一起,形成了纤维间隔,说明此时大鼠出现了肝纤维化的症状。FIB_PC组中虽然汇管区也存在一定量的纤维,但没有形成纤维间隔,其纤维化程度较 FIB组低(图2)。结合图1的结果,表明CCl4诱导4周能造成肝脏纤维化,PC干预具有缓解CCl4造成的肝纤维化的作用。
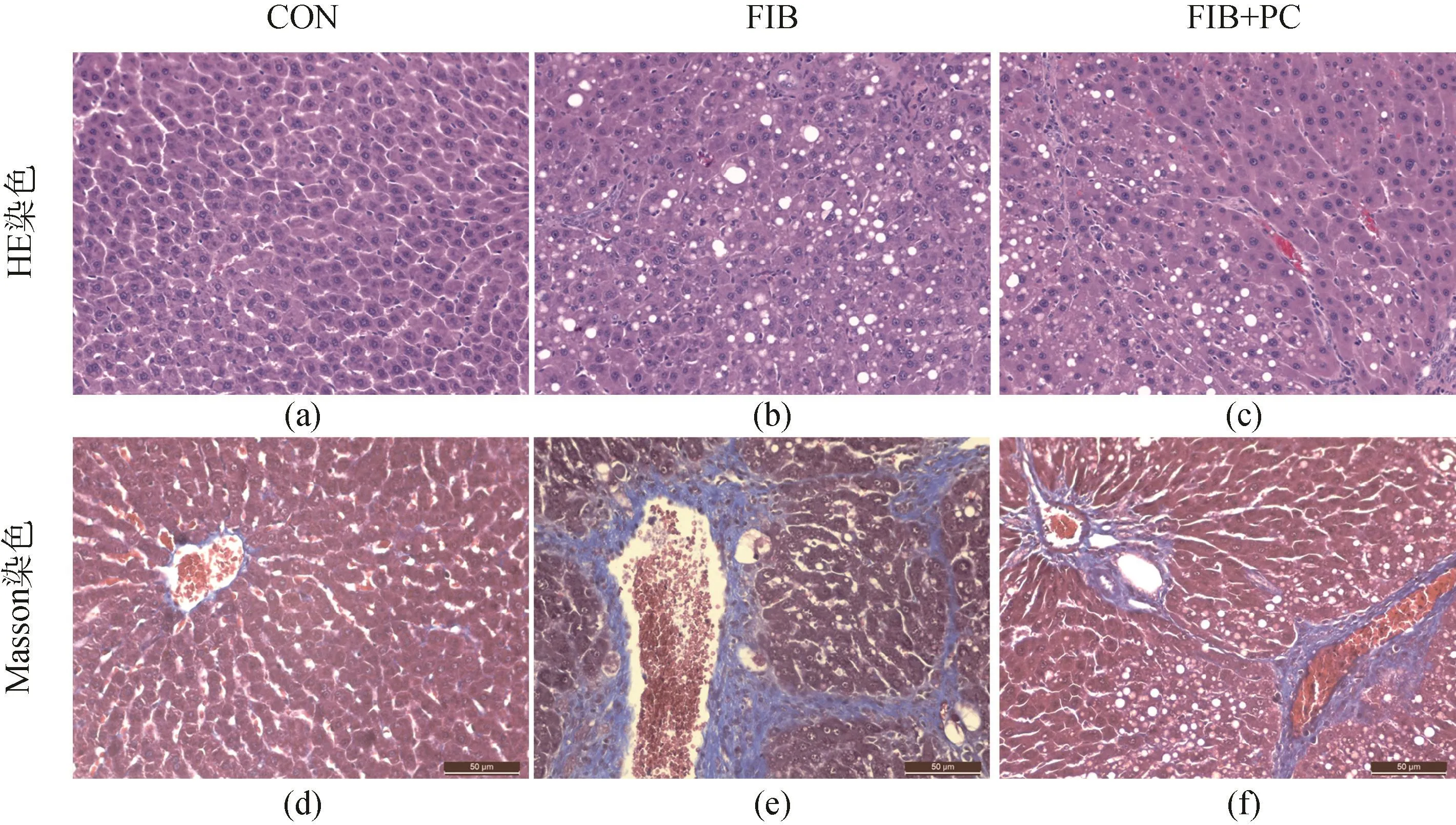
图2 各组大鼠肝脏组织染色结果(放大200倍)Fig.2 Pathological section staining of liver tissue (200×)
3.3 肠道微生物基础质控分析
本次测序21个粪便样本共产生了1 043 032条有效序列,有效碱基数目为 505 342 145 bp,有效序列的平均长度为 423 bp。各样本稀释曲线Shannon指数达到平缓(图3a),coverage指数达到了95%以上(图3b),且reads数在35 000以上,说明本次测序的数据量足够反映出大鼠肠道菌群的组成的真实情况。
3.4 对OTUs的影响
对所得的reads以97% 的相似度进行聚类,共得到 960个操作分类单元(operational taxonomic units,OTUs)(图3c),NC组有 760个,FIB组有 830个,FIB_PC组有847个,这些组共有的OTUs有639个,NC组独有38个,FIB组独有32个,FIB_PC组独有52个。
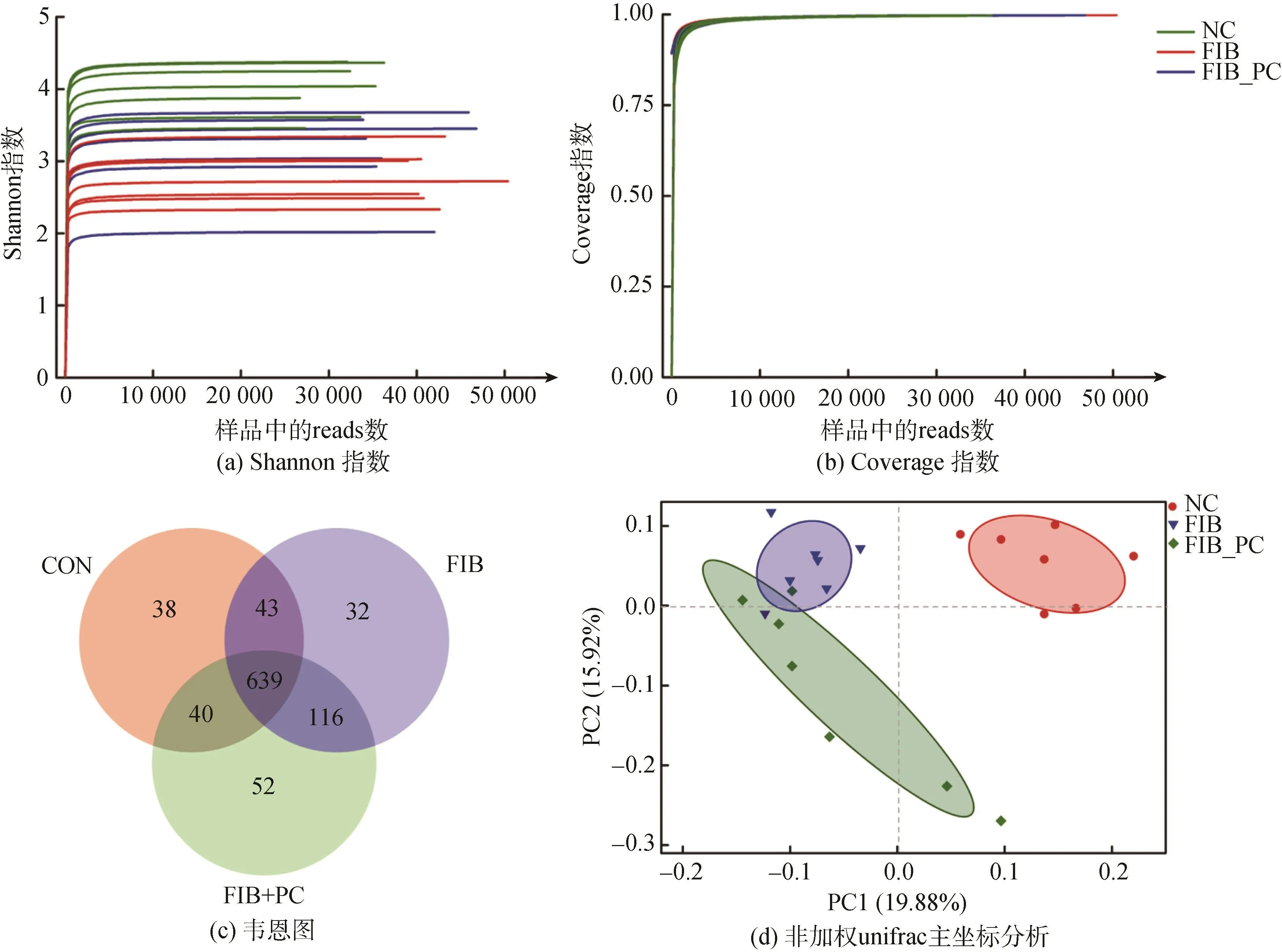
图3 藻蓝蛋白干预对肠道微生物组成的影响Fig.3 Phycocyanin intervention modulated composition of gut microbiota
3.5 OTUs聚类分析
对测得的各组肠道微生物进行OTUs聚类分析,非加权 unifrac主坐标分析(principal co-ordinates analysis,PCoA)的结果如图3d所示,以 95%的置信区间给图中各组加上分组椭圆,结果显示 NC组、FIB组和 FIB_PC组在图中对应的点分布比较集中,且NC组与FIB组、FIB_PC组的分组椭圆没有交集,说明PC和CCl4都能改变肠道菌群。与FIB组相比,PC_FIB组的分类椭圆距 NC组远,可能是因为PC_FIB组是CCl4和 PC双重干预,且PC是灌胃干预,在消化道中直接与肠道微生物接触,因此对肠道微生物的影响较大。
在门水平上,将相对丰度小于0.005的门设为其他组,可以看出大鼠肠道内主要的门为厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)(图4)。FIB组中,与 NC组相比,CCl4诱导增加了厚壁菌门的相对丰度而减少了拟杆菌门的相对丰度。与FIB组相比,FIB_PC组内Firmicutes与Bacteroidetes的比值降低。
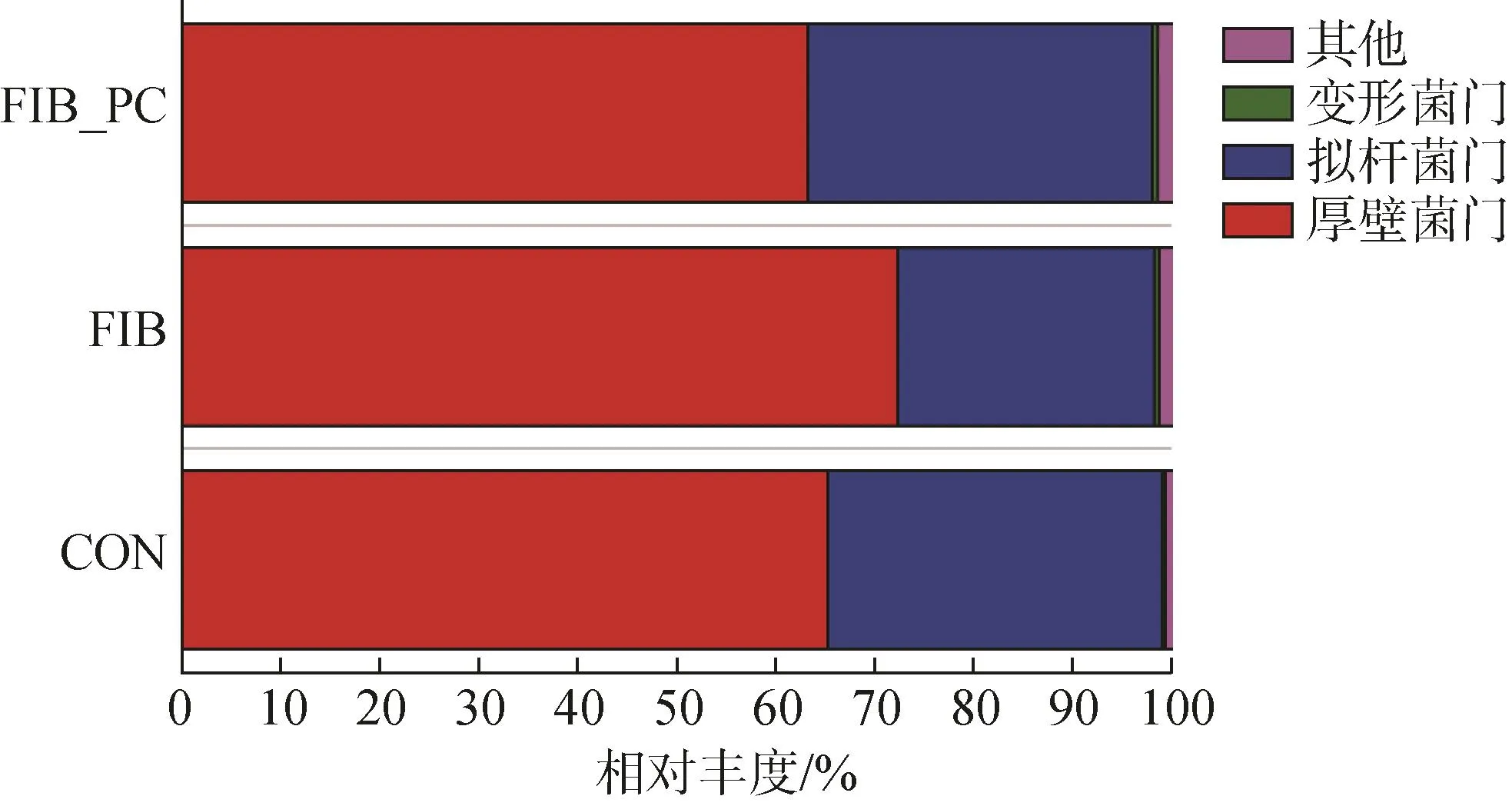
图4 肠道微生物在门水平上的相对丰度Fig.4 Relative abundance of gut microbiota at the phylum level
在科水平上,CCl4诱导降低了拟杆菌科(Bacteroidaceae)、理研菌科(Rikenellaceae)、坦纳菌科(Tannerellaceae)等菌群的丰度,PC加入后这些科的细菌相对丰度增加。此外,与 NC组相比,FIB_PC组还显著增加了消化链球菌科(Peptostreptococcaceae)、双歧杆菌科(Bifidobacteriaceae)的相对丰度(图5)。
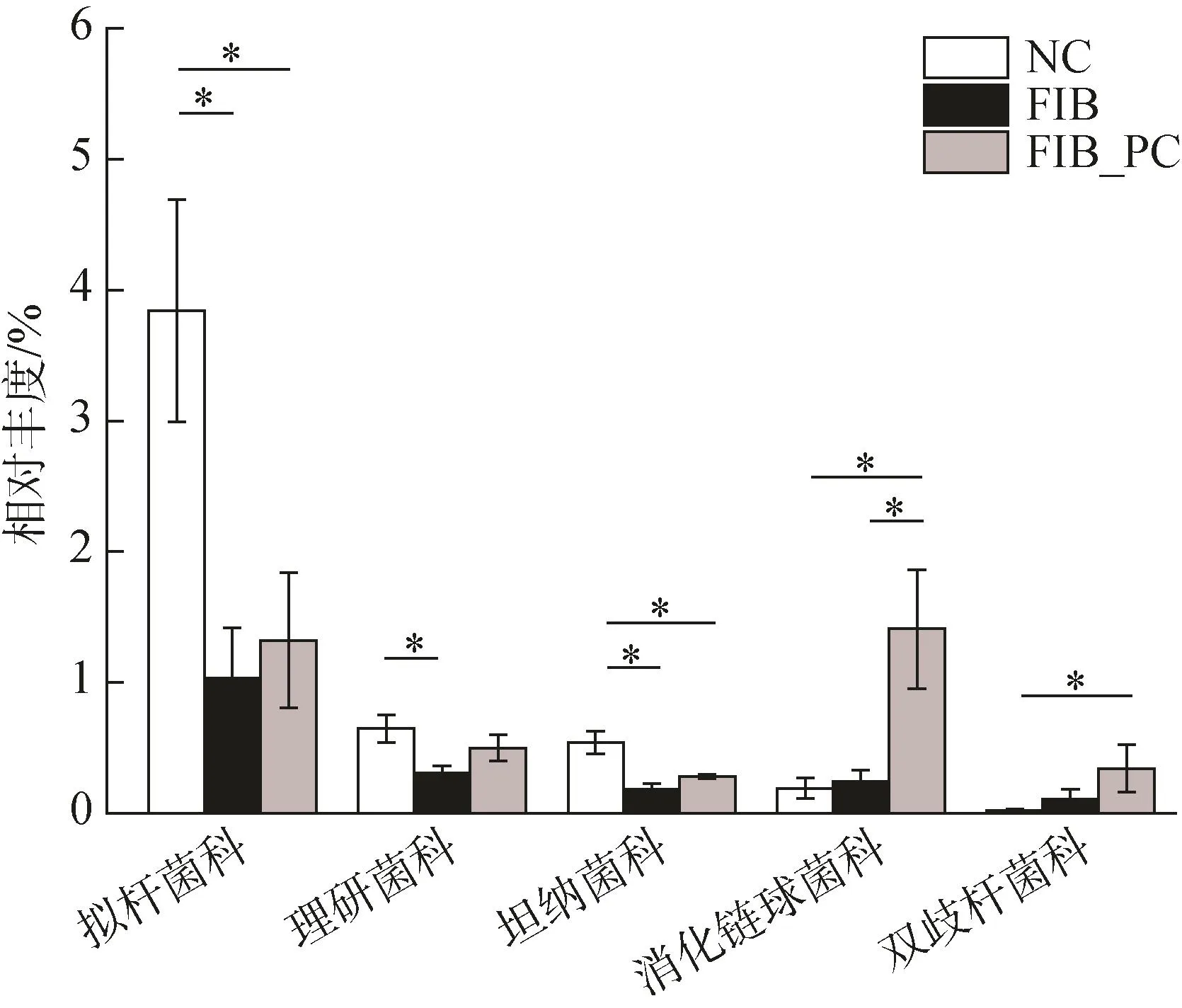
图5 藻蓝蛋白干预在科水平上对肠道微生物丰度的影响Fig.5 Phycocyanin intervention changed the relative abundance of gut microbiota at the family level
在属水平上,与 NC组相比,FIB组拟杆菌属(Bacteroides)、副拟杆菌属(Parabacteroides)、布劳特氏菌属(Blautia)的相对丰度显著降低(P<0.05)。而与FIB组相比,FIB_PC组中别样棒菌属(Allobaculum)、双歧杆菌属(Bifidobacterium)等菌的相对丰度显著增加(图6)。
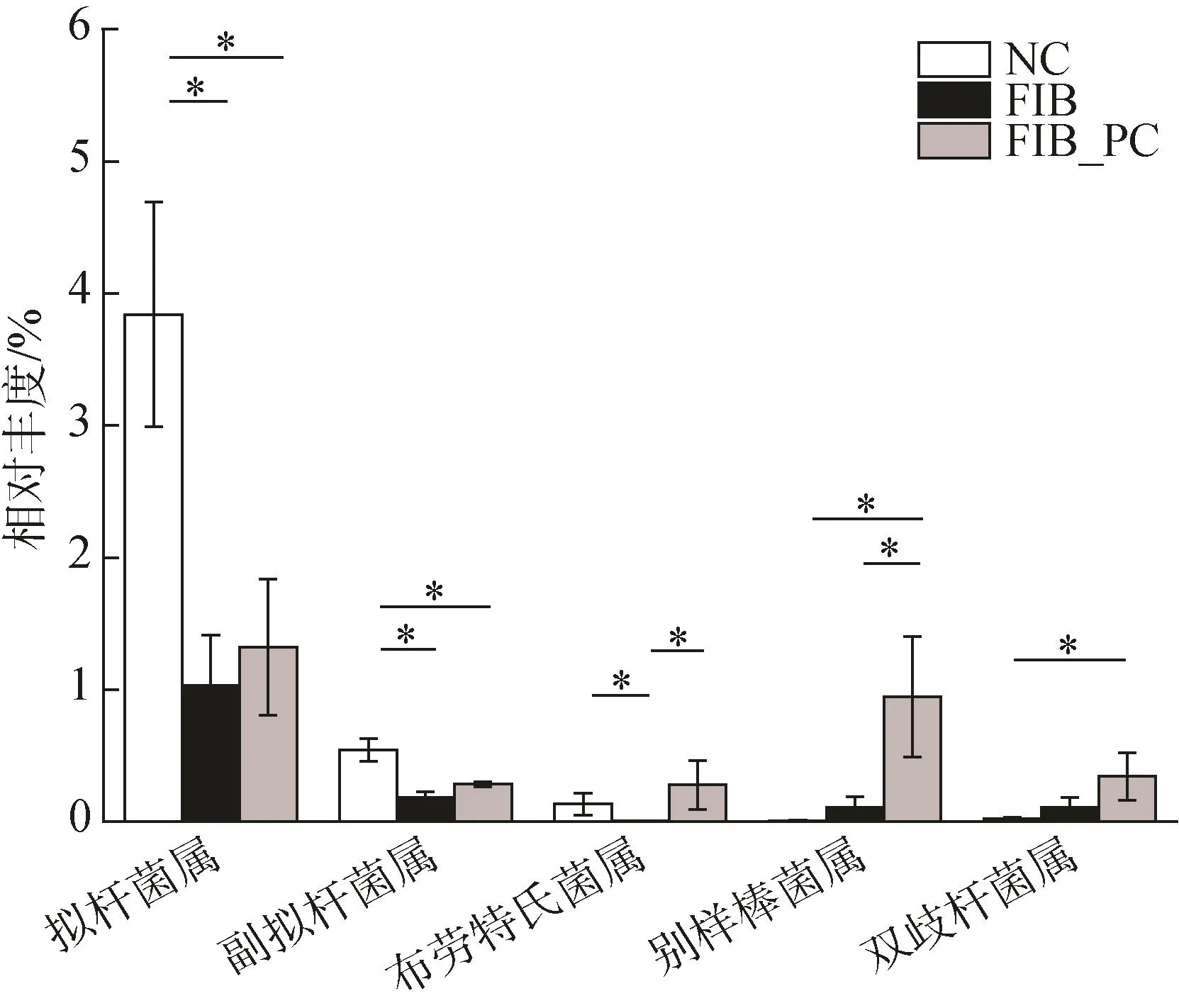
图6 藻蓝蛋白在属水平上对肠道微生物丰度的影响Fig.6 Phycocyanin intervention changed the relative abundance of gut microbiota at the genus level
4 结论和讨论
因为CCl4腹腔注射诱导的肝纤维化与真实的化学物质造成的肝损伤类似,所以该肝纤维化模型在实验室广泛使用。本实验中,CCl4诱导的大鼠肝脏组织中肝纤维化标志物α-SMA和Co-I显著增加,病理检查发现肝脏出现了纤维化样病变,说明建模成功。
CCl4能通过多种方式对肝脏造成损伤。CCl4在生物组织中发生碳键的断裂,形成活性三氯甲烷(CCl3·)自由基和三氯甲烷过氧基(CCl3OO·)自由基,这些自由基攻击肝脏细胞,导致了细胞膜上脂质过氧化,进而引起肝细胞的持续损伤[12]。之前的研究表明PC能够通过抗氧化作用降低 CCl4诱导的肝损伤。Vadiraja等[13]研究表明,PC能够清除大鼠肝脏内CCl4产生的自由基,从而降低脂质过氧化和肝损伤。Ou等[7]证明PC可以通过清除活性氧(reactive oxygen species,ROS)并增强超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的活性来减少CCl4诱导的肝损伤。此外,PC上的色基藻蓝胆素(phycocyanobilin,PCB)能显著提高 CCl4小鼠血清和肝脏中的SOD水平,降低肝损伤[12]。在本研究中,PC干预降低了 CCl4诱导的大鼠肝脏组织中α-SMA和 Co-I的增加,改善了大鼠肝脏组织的病理状态,说明PC具有改善肝纤维化的作用。
除了诱导脂质过氧化外,CCl4诱导的肝纤维化还可能与肠道菌群相关。D’Argenio等[14]用 CCl4诱导了大鼠肝纤维化,发现纤维化大鼠存在肠道菌群失调。临床上也发现了肝硬化患者存在肠菌失调,Qin等[15]通过定量宏基因组学的方法揭示了肝硬化患者和健康人菌群之间的差异,和健康人相比,肝硬化患者肠道中Bacteroidetes的丰度降低,而Firmicutes的丰度升高。Firmicutes/Bacteroidetes(F/B)可以反映肠道微生物的失调情况。本研究发现大鼠粪便中主要的菌门为Firmicutes和Bacteroidetes,这2个菌门占据大鼠总微生物的 90%以上,数量上涵盖了大部分的肠道细菌。CCl4诱导增加了Firmicutes的丰度,降低了 Bacteroidetes的丰度,说明 CCl4诱导了大鼠的肠道菌群的失调,而PC抑制了CCl4造成的Bacteroidetes的丰度降低和Firmicutes的丰度升高,说明PC能够改善 CCl4引起的肠道微生物的紊乱,这种改善可能有助于PC缓解肝纤维化。
本研究中CCl4干预降低了Bacteroides、Parabacteroides、Blautia等的丰度,这些菌都能产生短链脂肪酸[16-20]。肠道中短链脂肪酸具有抗炎作用,短链脂肪酸减少会增加机体的炎症反应[21]。之前的研究观察到自身免疫性肝炎中Parabacteroides的丰度降低[22],非酒精性脂肪肝患者和纤维化患者体内Blautia菌显著降低[23],Yan等人[24]观察到 CCl4处理后大鼠肠道中Bacteroides丰度下降,D’argenio 等[14]发现 CCl4诱导的肝纤维化大鼠体内肠道菌群发生了紊乱,促炎细胞因子水平升高。说明CCl4或许可以通过降低短链脂肪酸产生菌的丰度,增加机体炎症,促进肝纤维化的发展。PC干预增加了肠道中益生菌Blautia的丰度。Blautia能够调节免疫反应,从而发挥抗炎活性,能改善肝硬化患者的预后[25]。因此,我们推测PC能够通过调节肠道菌群调节免疫反应,从而降低肝脏的炎症水平,缓解肝脏纤维化。
PC对 CCl4诱导的肝纤维化具有良好的改善作用。本文首次比较了 PC 干预对 CCl4诱导的肝纤维化大鼠肠道微生物组成与结构的影响。结果表明了PC能够增加大鼠体内具有抗炎活性的益生菌的丰度,降低肝纤维化标志物的表达水平,具有缓解 CCl4诱导的肝纤维化的潜力。但PC在消化道中的代谢及其与机体和肠道微生物相互作用的机理较为复杂,是PC通过肠道微生物影响肝纤维化,还是 PC通过减弱肝纤维化,进一步影响肠道菌群,还需要通过粪菌移植等试验进行验证。

