DFO通过HIF-1α/VEGF信号通路促进脊髓损伤修复*
王卓 陈俊 郝杰 彭志财 付福建 陈吉 陈勇
(1.重庆医科大学附属永川区中医院骨科,重庆 402160;2.重庆医科大学附属第一医院骨科,重庆 400016;3.重庆医科大学附属南川区人民医院骨科,重庆 408400;4.南京中医药大学附属昆山中医院脊柱骨科,江苏 昆山 215300)
由于神经组织自我修复能力有限,脊髓损伤患者的临床康复往往难以达到预期效果[1-2]。作为临床上广泛用于治疗脊髓损伤的含铁螯合剂药物:去铁胺(Deferoxamine, DFO),可以清除自由基,并通过缺氧诱导因子-1α(Hypoxia Inducible Factor-1α,HIF-1α)/血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)的表达,促进神经组织修复[3-4]。本研究通过探讨DFO对HIF-1α/VEGF表达的调控作用,及因此对脊髓损伤产生的促进修复作用,旨在探讨脊髓损伤修复的分子机制。
1 材料与方法
1.1 分组与造模 将40只SD雄性大鼠(体重200~240 g)随机分为4组:假手术组10只,对照组10只,DFO 30 mg/Kg腹腔注射组(DFO 30组)10只以及100 mg/Kg腹腔注射组(DFO 100组)10只。术前1周内在相同的条件下喂养,待大鼠适应环境后,对所有大鼠通过腹腔注射2.5%戊巴比妥钠进行麻醉,将背部剃毛,显露背部,以胸10棘突为中心取正中切口,剥离椎旁肌肉,暴露椎板及棘突,小心切除椎板及棘突,暴露脊髓,在脊髓处放置直径为2.5 mm垫板,随后将10 g重砝码从4.0 cm高处自由坠落并撞击硬膜,以40 g.cm势能对脊髓造成损伤,将砝码迅速移除,止血后关闭创口。假手术组仅暴露脊髓,不予以神经损伤。术后所有大鼠予以每日两次膀胱功能训练,直至大鼠获得膀胱自我控制功能。本研究获医院伦理委员会批准。
1.2 DFO注射 将DFO(美国Sigma公司)溶解于磷酸盐缓冲液并使用0.45 um过滤器过滤。根据以往报告,DFO 30 mg/Kg及100 mg/Kg剂量给药均对啮齿类动物安全[5-6]。因此,为了评价DFO给药的效果,30 mg/Kg及100 mg/Kg浓度的DFO通过腹腔注射的方式在神经损伤术后两周内分别对DFO 30组及DFO 100组大鼠给药。
1.3 指标评价
1.3.1 行为学检查 使用BBB评分(Basso Beattie and Bresnahan Locomotor Rating Scale)和斜板实验对术前、术后1、7、14、21及28 d时大鼠的行为学功能进行评价[2]。在宽阔场地将各组大鼠置于其中使其自由活动至少5 min,观察左右后肢的运动情况。将左右后肢功能BBB分值相加取平均值后记录。而对于斜板实验,将大鼠放置于木制板上,逐渐提升大鼠头端木制板高度,观察并记录大鼠在斜板上维持超过5 s时的最大倾角。所有大鼠测量三次,取平均值作为最终检查数据。
1.3.2 病理学观察 术后第4周时,对照组及DFO两组大鼠每组取6只行病理学观察。对所有大鼠通过腹腔注射2.5%戊巴比妥钠进行深度麻醉,经左心室将冰生理盐水灌注全身,直至澄清液体流出后,使用约200 mL浓度为4%的多聚甲醛溶液将大鼠固定,随后以脊髓损伤部位为中点,将长约1 cm脊髓组织取出。组织取出后迅速使用多聚甲醛固定6~8 h,使用30%蔗糖溶液脱水后,行石蜡包埋。将包埋好的组织进行横切片,片厚5 μm,每只共获取切片40张。将残存面积最小处设定为脊髓损伤中心,取损伤中心处切片,并从损伤中心处至头侧及尾侧3 mm,每500 μm处取分别切片一张,共取得13张进行HE染色,在显微镜下通过数字图像分析仪计算切片中髓鞘的面积。
1.3.3 HIF-1α/VEGF表达测定 术后第4周时,4组大鼠每组取4只行HIF-1α/VEGF表达测定。脊髓组织取出方法同病理学观察。通过Western bolt法将取出的脊髓组织进行等量上样,随后进行电泳、转膜、洗膜及封闭处理,分别用兔抗HIF-1α(1∶100)及VEGF(1∶100)行4度一抗过夜,洗膜后,Odyssey系统进行观察,并定量分析各条带的灰度。

2 结果
2.1 行为学检查 术前,4组大鼠BBB评分及斜板实验角度接近,差异无统计学意义(P>0.05);与假手术组相比,术后1 d时,对照组及DFO两组大鼠行为学功能明显降低,但差异无统计学意义(P>0.05);术后1周开始,DFO两组大鼠行为学功能较对照组有明显改善(P<0.05),但DFO两组差异不明显(P>0.05)。术后2周开始,DFO两组大鼠行为学功能较对照组明显改善,且DFO 100组改善程度更优于DFO 30组(均P<0.05),见图1。
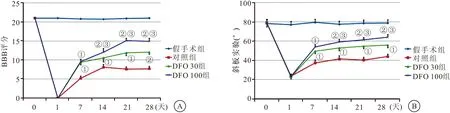
图1 4组大鼠行为学检查结果
2.2 病理学观察 术后4周时,与假手术组相比,对照组大鼠脊髓组织明显减少(P<0.01),而DFO 30组髓鞘残余面积相对于对照组明显恢复,DFO 100组髓鞘残余面积明显高于DFO 30组(均P<0.05),见图2。
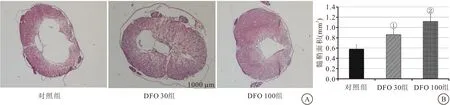
图2 对照组及DFO两组术后4周时髓鞘残余面积
2.3 HIF-1α/VEGF表达测定 术后4周时,对照组大鼠脊髓组织内仅有少量HIF-1α/VEGF表达, DFO 30组脊髓组织内HIF-1α/VEGF表达量明显高于对照组,DFO 100组HIF-1α/VEGF表达量较DFO 30组更明显(均P<0.05),见图3。
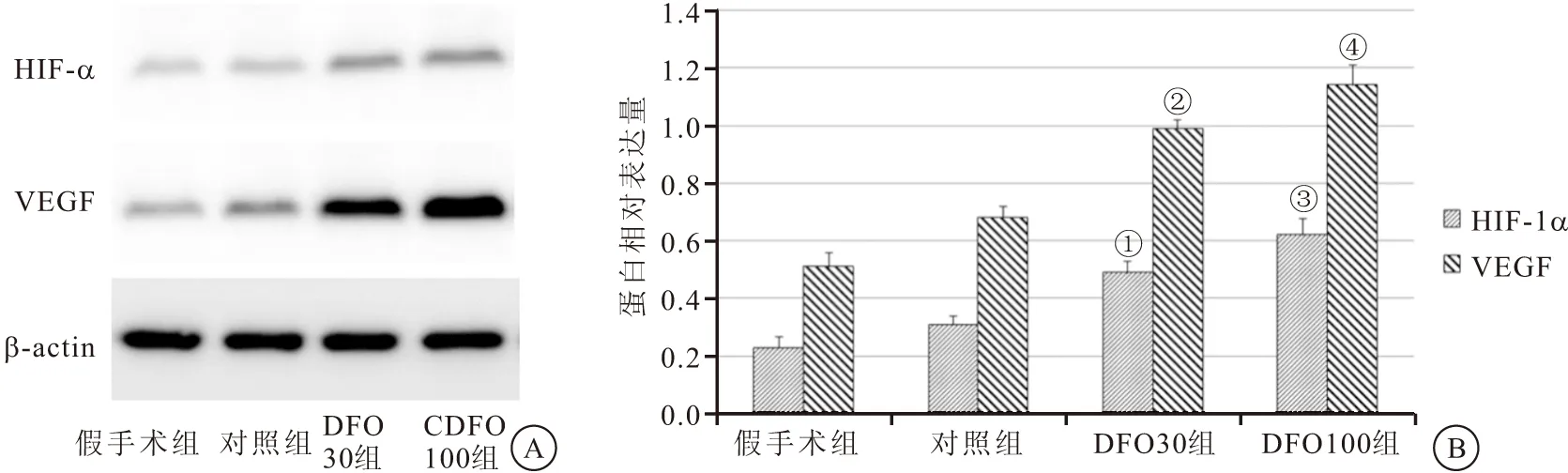
图3 4组HIF-1α/VEGF表达测定结果
3 讨论
DFO作为一种螯合剂,可以螯合铁蛋白中的三价铁离子,降低神经损伤部位的铁离子浓度[7-8],并可以清除氧自由基,从而减缓神经组织中脂质的过氧化反应,促进神经元细胞及神经胶质细胞再生[9-12]。本研究的斜板实验中,对照组和DFO两组大鼠行为学功能在术后1周时开始有所改善,术后两周开始,DFO两组大鼠行为学功能均较对照组有明显改善,而DFO 100组改善程度更优于DFO 30组。在病理学观察实验中,对照组大鼠脊髓组织在术后4周时明显减少,而DFO 30组髓鞘残余面积相对于对照组明显恢复,DFO 100组髓鞘残余面积明显高于DFO 30组(均P<0.05)。这些结果表明,DFO可以促进受损的神经组织修复,且高浓度DFO给药更利于神经组织的再生。
HIF-1蛋白可以调控细胞的信号通路,有α及β两个亚基。α亚基在常温下降解,而在缺氧情况下受诱导表达[13]。脊髓损伤时会造成神经组织微环境缺氧,缺氧状态不仅容易引起HIF-1α表达,且其羟基化作用容易被干扰,从而导致稳定性增强[14-16]。HIF-1α可以通过调控VEGF以及促红细胞生长素等基因的表达,从而促进神经组织血供恢复,抑制神经细胞凋亡,促进神经组织再生,对损伤后的神经组织恢复具有十分重要的作用[17]。有研究表明,脯氨酸羟化酶可以促进HIF-1α的降解,缺氧时脯氨酸羟化酶活性降低,导致HIF-1α的降解被阻断,从而导致HIF-1α的高表达[18-19]。DFO可以抑制脯氨酸羟化酶的活性,从而提高HIF-1α的转录与表达[20-21]。本研究结果同样表明,DFO可以促进HIF-1α表达。
作为HIF-1α的靶基因蛋白,VEGF可以直接作用于血管内皮细胞,使血管内皮细胞增殖,并增加血管的通透性[22-23]。脊髓损伤后,VEGF的表达可以持续促进血管再生,而新生血管能够分泌血管分泌因子,使神经元细胞归巢至受损的神经组织处,不仅改善受损神经组织的微循环,更使神经元细胞聚集而促进神经组织修复[24-27]。本研究结果显示,DFO促进HIF-1α表达的同时明显促进VEGF的表达,高浓度DFO可以促进HIF-1α/VEGF多表达,进一步促进神经组织修复。
DFO通过HIF-1α/VEGF表达可以有效促进脊髓损伤修复,大剂量DFO应用有望达到更好的脊髓损伤修复效果。本研究尚有以下不足之处:样本量较少;缺乏对脯氨酸羟化酶表达的观察;仅观察VEGF表达,缺乏对脑源性神经生长因子等蛋白表达的观察。为进一步确定DFO促进神经组织修复的机制,计划在将来进行更缜密的研究,深层次探讨DFO治疗脊髓损伤的机理,为临床用药提供新的思路。
4 结论
DFO通过调控HIF-1α/VEGF表达有效促进脊髓损伤修复,大剂量DFO应用可能具有更好的脊髓损伤修复效果。

