桃金娘果实多糖抗氧化稳定性的研究
赵广河,陆玺文,胡梦琪,赵丰丽
(1.广西师范大学可持续发展创新研究院,广西 桂林 541004;2.广西师范大学生命科学学院,广西 桂林 541004;3.广西师范大学生物医学科学中心,广西 桂林 541004)
桃金娘(Rhodomyrtus tomentosa)别名山稔、岗稔、当梨、稔子、豆稔、桃娘,是桃金娘科桃金娘属常绿多花小灌木,广泛分布于我国东南部、南部、西南部以及亚洲热带和亚热带地区[1]。桃金娘多以野生存在,其果实资源丰富。据《生草药性各要》记载,桃金娘果实具有健大肠、治蛇伤的功效。另据《全国中草药汇编》记载,桃金娘果实具有补血、滋养、安胎的功效,可用于贫血、病后体虚、神经衰弱、耳鸣、遗精等病症的治疗。近年来,关于桃金娘果实的研究多集中在果酒[2-3]、果粉[4-5]及生物活性[6-11]的研究上,涉及果实多糖的研究较少且主要集中于提取纯化工艺、单糖组成及活性评价上[12-19]。研究表明,桃金娘果实多糖具有较强的抗氧化活性[17-18]。然而,桃金娘多糖的抗氧化稳定性未见报道。因此,本文模拟不同食品加工条件,对桃金娘果实多糖的抗氧化稳定性进行评价,为桃金娘果实多糖的进一步开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
桃金娘果实:市售;木瓜蛋白酶(10万U/g):广西庞博生物工程有限公司;乙醇、硫酸亚铁、水杨酸、磷酸氢二钠、氯化钠、氯化钾、氯化钙、氯化铜、氯化亚铁、柠檬酸、蔗糖、葡萄糖、苯甲酸钠等(均为分析纯):国药集团化学试剂有限公司;叠氮化钠(生化试剂):南京生兴生物技术有限公司。
1.2 仪器与设备
DHG-9140A电热恒温鼓风干燥箱:上海齐欣科学仪器有限公司;JP-250A-8高速多功能粉碎机:永康市久品工贸有限公司;YXQ-50SⅡ立式压力蒸汽灭菌器:上海博迅实业有限公司医疗设备厂;SP-2500紫外可见分光光度计:上海光谱仪器有限公司;FDU-1200冷冻干燥机:东京理化器械株式会社。
1.3 试验方法
1.3.1 桃金娘果实多糖的制备
购买新鲜桃金娘果实于3 h内快速运回实验室,剔出破损果、虫蚀果。桃金娘多糖的制备采用本实验室前期的方法[14],将完整且无虫蚀的桃金娘果实于80℃烘干、粉碎、过筛,用石油醚回流提取充分脱脂,在通风橱中摊晾6 h以上以脱除残余溶剂。将脱脂后的桃金娘果实用80%乙醇溶液回流脱单糖及低聚糖,40℃烘干后均匀分散于20倍蒸馏水中,再加入0.80%木瓜蛋白酶于55℃水浴中进行酶解,最后加入4倍体积无水乙醇进行醇沉,用无水乙醇洗涤两次,冷冻干燥后即得桃金娘果实多糖。
1.3.2 羟基自由基清除试验
参考文献[20]方法,在试管中依次加入1.0 mL硫酸亚铁(浓度为1.0 mmol/L)及1.0 mL水杨酸-乙醇溶液(浓度为1.0 mmol/L),1.0 mL桃金娘果实多糖样品溶液,1.0 mL H2O2(浓度为1.0 mmol/L),最后加入2.0 mL蒸馏水,摇匀,避光静置30 min后于510 nm处测吸光度。然后用等体积蒸馏水代替样品溶液,其它试剂不变,作为空白对照试验。通过测定的吸光度,计算桃金娘果实多糖对羟基自由基的清除率。每组试验平行测定3次,取平均值为最终结果。羟基自由基清除率计算按公式(1)。
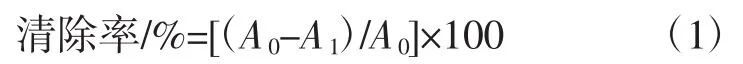
式中:A0为用等体积蒸馏水代替桃金娘果实多糖溶液时所测的空白对照吸光度;A1为不同样品溶液的吸光度。
1.3.3 多糖溶液浓度的选择
将桃金娘果实多糖分别配制成0.1%、0.2%、0.3%、0.4%、0.5%浓度的溶液,按照1.3.2进行试验,分别测吸光度,并按公式(1)计算出不同浓度的多糖溶液对羟基自由基的清除率,根据测定结果,取适宜浓度的多糖溶液进行后续的多糖抗氧化稳定性试验。
1.3.4 多糖抗氧化稳定性试验
1.3.4.1 光照对多糖抗氧化稳定性的影响
在3个烧杯中分别加入50 mL适宜浓度的桃金娘果实多糖溶液,并用保鲜膜封住杯口(溶液中添加0.05%叠氮化钠以抑制微生物的生长)。将3个烧杯分别于室温25℃下放置于自然光、日光灯(烧杯与其间距为2.0 m)、避光条件下,每隔2 d测定一次多糖溶液对羟基自由基的清除率,试验共进行12 d。
1.3.4.2 温度对多糖抗氧化稳定性的影响
在4个锥形瓶中分别加入50 mL适宜浓度的桃金娘果实多糖溶液,并用保鲜膜封住瓶口。将4个锥形瓶分别置于40、60、80、100℃的条件下进行水浴加热,每隔0.5 h测定一次多糖溶液对羟基自由基的清除率,直至加热时间达到3.5 h。
1.3.4.3 酸碱度对多糖抗氧化稳定性的影响
分别用 pH 值为 3、4、5、6、7、8 的磷酸氢二钠-柠檬酸缓冲液配制适宜浓度的桃金娘果实多糖溶液,常温25℃下放置2 h后,测定多糖溶液对羟基自由基的清除率。
1.3.4.4 金属离子对多糖抗氧化稳定性的影响
分别用浓度为 2、4、6、8、10、12 mmol/L 的氯化钠、氯化钾、氯化钙、氯化铜及氯化亚铁溶液配制适宜浓度的桃金娘果实多糖溶液,常温25℃下放置2 h后,测定多糖溶液对羟基自由基的清除率。
1.3.4.5 常用食品配料对多糖抗氧化稳定性的影响
分别用浓度为 0%、0.1%、0.2%、0.3%、0.4%、0.5%的柠檬酸溶液配制适宜浓度的桃金娘果实多糖溶液,常温25℃下放置2 h后,测定多糖溶液对羟基自由基的清除率。
分别用浓度为0%、1%、2%、3%、4%、5%的蔗糖溶液配制适宜浓度的桃金娘果实多糖溶液,常温25℃下放置2 h后,测定多糖溶液对羟基自由基的清除率。
分别用浓度为0%、1%、2%、3%、4%、5%的葡萄糖溶液配制适宜浓度的桃金娘果实多糖溶液,常温25℃下放置2 h后,测定多糖溶液对羟基自由基的清除率。
分别用浓度为 0%、0.005%、0.010%、0.015%、0.020%、0.025%的苯甲酸钠溶液配制适宜浓度的桃金娘果实多糖溶液,常温25℃下放置2 h后,测定多糖溶液对羟基自由基的清除率。
1.3.4.6 杀菌方式对多糖抗氧化稳定性的影响
将适宜浓度的桃金娘果实多糖溶液分别在100℃条件下煮沸灭菌10 min、巴氏灭菌(70℃条件下加热30 min)、2 450 MHz条件下微波灭菌5 min及高压灭菌15 min,然后测定多糖溶液对羟基自由基的清除率。
1.3.5 数据处理
所有试验均为3次重复,结果表示为平均值±标准偏差。采用IBM SPSS Statistic Version 20.0统计软件,利用ANOVA进行方差分析,使用Dunnett′s tests进行显著性检验。p<0.05,视为差异显著。
2 结果与分析
2.1 多糖溶液浓度的选择
多糖溶液浓度的选择试验结果见图1。
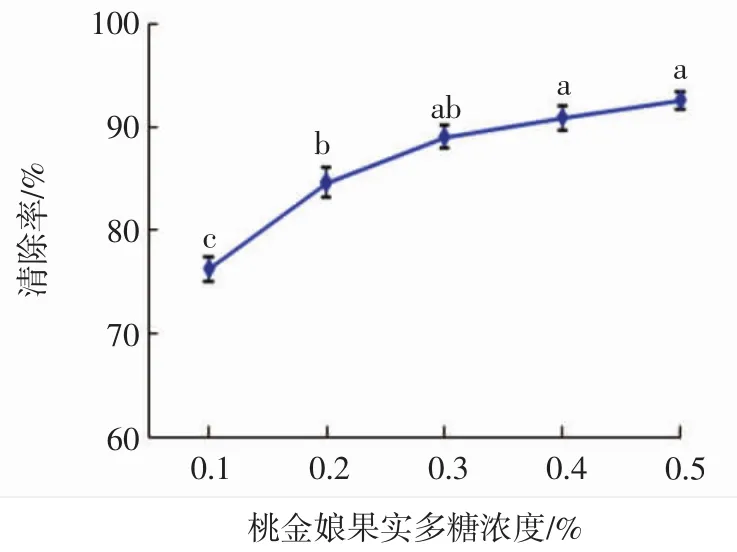
图1 不同浓度的多糖溶液对羟基自由基的清除率Fig.1 Hydroxylradical clearance rate of polysaccharide solutions with different concentrations
如图1可知,在0.1%~0.5%浓度范围内,随着浓度的增加,桃金娘果实多糖对羟基自由基的清除率也随之增大,但在稀释度0.3%之后,曲线变化逐渐平缓,清除率增加并不显著。因此选择0.3%浓度作为后续多糖溶液抗氧化稳定性试验的适宜浓度。
2.2 多糖抗氧化稳定性试验结果
2.2.1 光照对多糖抗氧化稳定性的影响
光照对桃金娘果实多糖的抗氧化能力的影响见图2。

图2 光照对桃金娘果实多糖抗氧化能力的影响Fig.2 Effect of light on antioxidant capacity of the Rhodomyrtus tomentosa berry polysaccharide
从图2可以看出,光照对多糖的抗氧化稳定性有一定的影响。随着光照时间的增加,多糖对羟基自由基的清除率逐渐下降。在0~6 d时,清除率呈较缓慢的下降趋势,6 d以后,清除率下降速度逐渐变快。整体来看,避光、自然光和日光灯3种光照方式对桃金娘果实多糖羟基自由基清除能力的影响并无显著差异。考虑到食品生产实际,通常单批次食品加工不会超过6 h,因此,可以认为,光照对桃金娘果实多糖的抗氧化稳定性无显著的影响。太行菊多糖也表现出同样的性质[21],但败酱草多糖的抗氧化活性受光照的影响较大[22]。
2.2.2 温度对多糖抗氧化稳定性的影响
温度对桃金娘果实多糖的抗氧化能力的影响见图3。
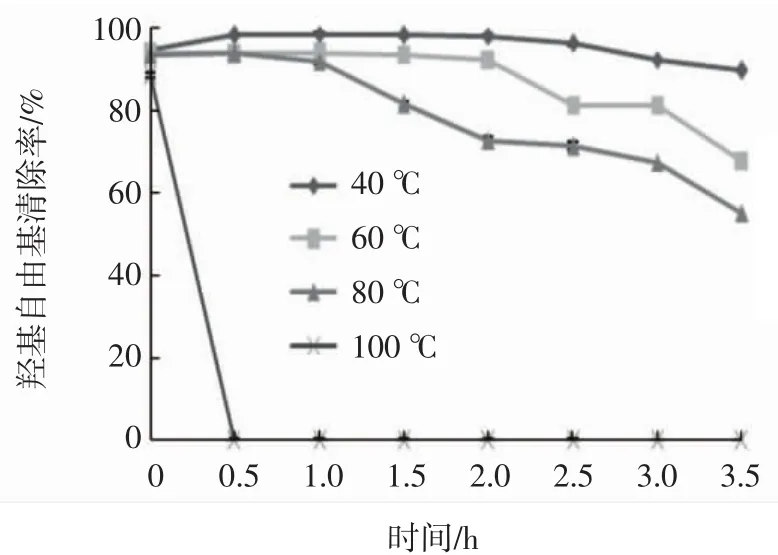
图3 温度对桃金娘果实多糖抗氧化能力的影响Fig.3 Effect of processing temperature on antioxidant capacity of the Rhodomyrtus tomentosa berry polysaccharide
由图3可知,随着受热时间的延长,桃金娘果实多糖的抗氧化能力呈下降的趋势。在100℃条件下加热时,桃金娘果实多糖的抗氧化能力快速下降,0.5 h后就基本失去抗氧化能力。在低于100℃条件下加热时,加热温度越低,桃金娘果实多糖的抗氧化能力下降速度越缓慢。由此可见,温度对桃金娘果实多糖的抗氧化稳定性影响显著。温度的变化可诱发桃金娘果实多糖结构的改变[15],从而导致其抗氧化活性的改变。太行菊多糖和败酱草多糖也表现出类似的性质[21-22]。
2.2.3 酸碱度对多糖抗氧化稳定性的影响
酸碱度对桃金娘果实多糖的抗氧化能力的影响见图4。
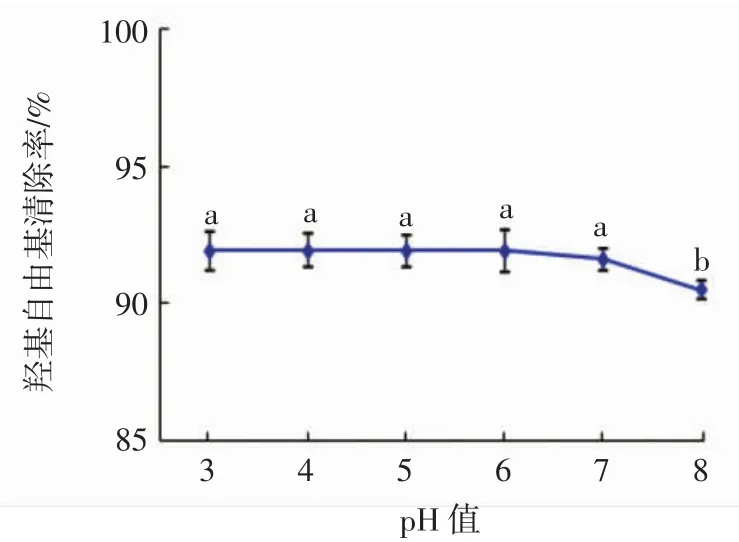
图4 酸碱度对桃金娘果实多糖抗氧化能力的影响Fig.4 Effect of pH on antioxidant capacity of the Rhodomyrtus tomentosa berry polysaccharide
由图4可知,当pH值在3~6范围时,桃金娘果实多糖的抗氧化能力比较稳定,对羟基自由基的清除率维持在91.9%左右。当pH值在6~7范围内,桃金娘果实多糖的抗氧化能力出现缓慢下降。pH值>7时,桃金娘果实多糖的抗氧化能力快速下降。由此看出,桃金娘果实多糖溶液在酸性及弱酸性条件下,其抗氧化能力比较稳定,而在碱性条件下,其抗氧化稳定性较差,这与太行菊多糖和败酱草多糖的性质相近[21-22]。
2.2.4 金属离子对多糖抗氧化稳定性的影响
金属离子对桃金娘果实多糖的抗氧化能力的影响见图5。
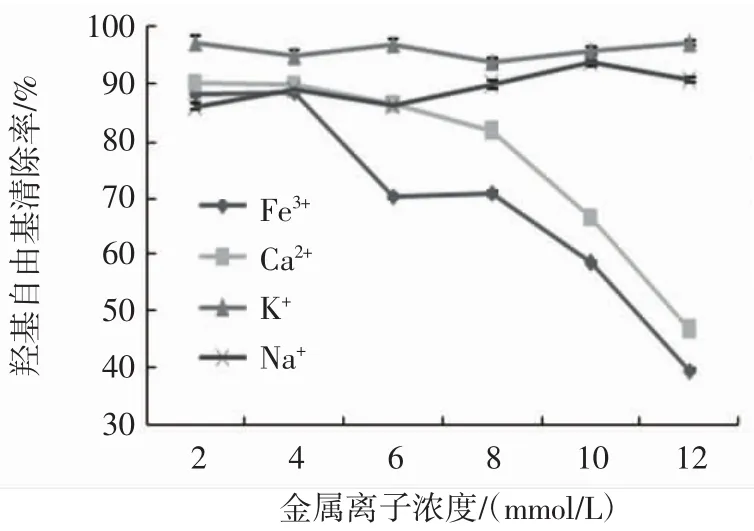
图5 不同金属离子对桃金娘果实多糖抗氧化能力的影响Fig.5 Effect of metal ions on antioxidant capacity of the Rhodomyrtus tomentosa berry polysaccharide
由图5可知,在不同浓度的K+、Na+的处理下,桃金娘果实多糖的抗氧化能力基本稳定;在Ca2+、Fe3+处理下,随着浓度的增大,桃金娘果实多糖的抗氧化能力显著下降,Fe3+处理下的降幅略大于Ca2+处理。可能因为多糖与不同离子发生不同程度的络合作用所致。与桃金娘果实多糖相同,太行菊多糖的抗氧化活性受铁离子的影响较大[21],败酱草多糖的抗氧化活性受钠、钾离子的影响较小[22]。与桃金娘果实多糖不同,败酱草多糖的抗氧化活性受钙离子的影响较小[22]。
2.2.5 常用食品配料对多糖抗氧化稳定性的影响
常用食品配料对桃金娘果实多糖的抗氧化能力的影响见图6。
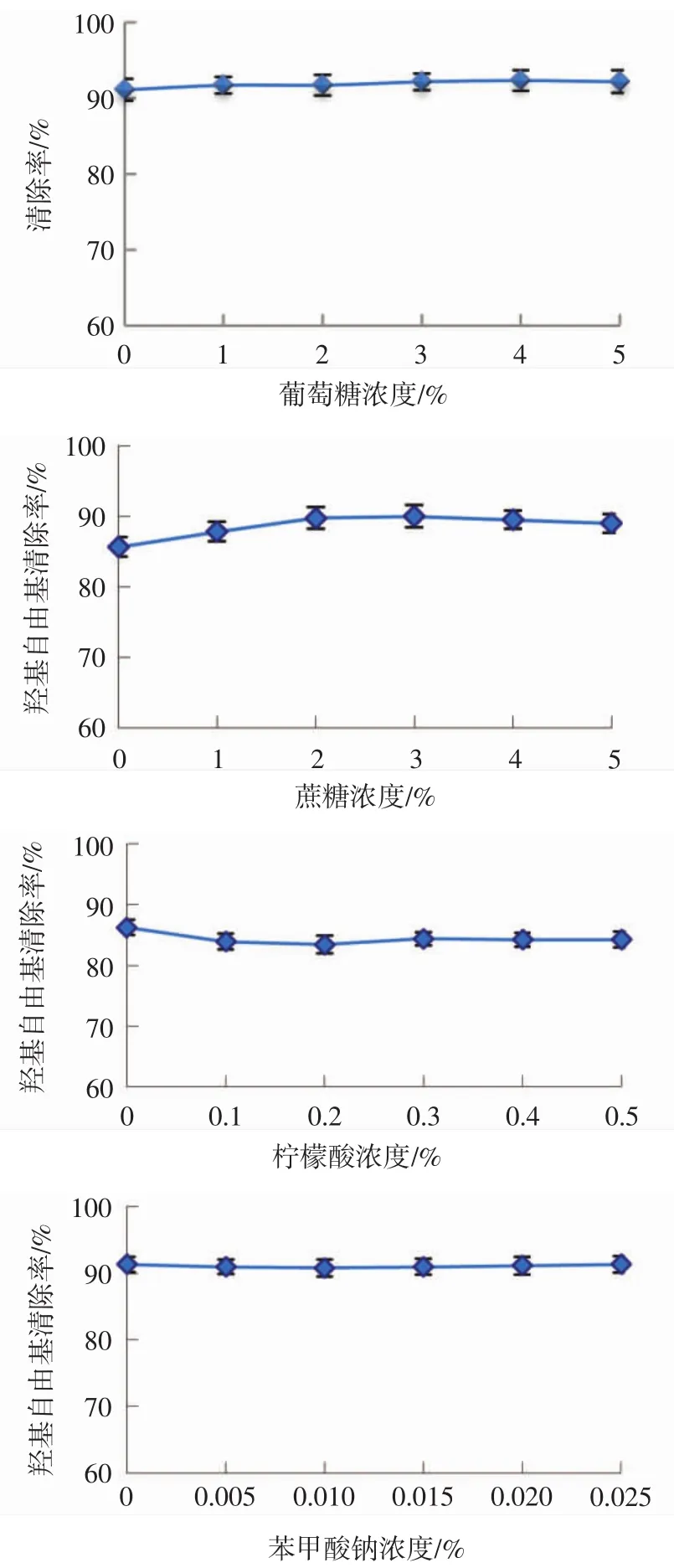
图6 常用食品配料对桃金娘果实多糖抗氧化能力的影响Fig.6 Effect of common food ingredients on antioxidant capacity of the Rhodomyrtus tomentosa berry polysaccharide
由图6可知,在试验考察的浓度范围内,常见食品配料葡萄糖、蔗糖、柠檬酸及苯甲酸钠等对桃金娘果实多糖的抗氧化能力的影响并不明显。与桃金娘果实多糖不同,太行菊多糖抗氧化活性受葡萄糖、柠檬酸及苯甲酸钠影响较大[21]。造成这一差异的原因,可能是两种多糖组成的不同,或者是抗氧化活性评价方法的不同。
2.2.6 杀菌方式对多糖抗氧化稳定性的影响
杀菌方式对多糖抗氧化能力的影响见图7。
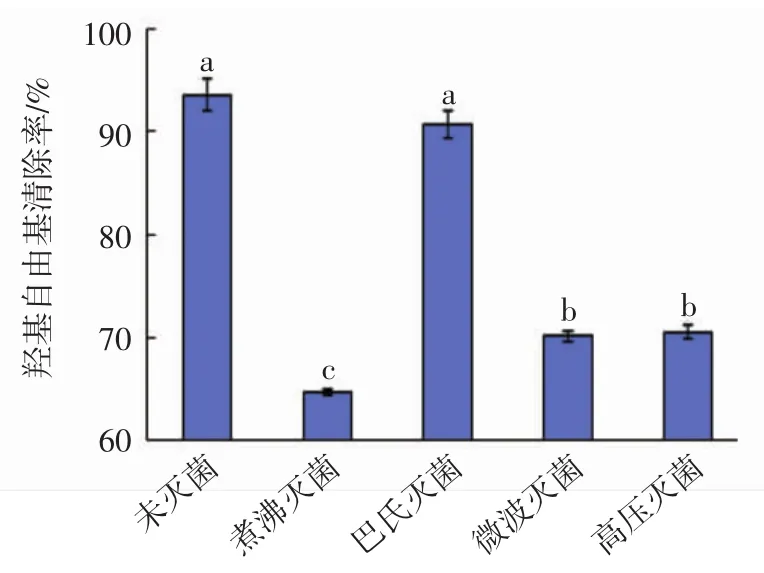
图7 杀菌方式对桃金娘果实多糖抗氧化能力的影响Fig.7 Effect of different bactericidal methods on antioxidant capacity of the Rhodomyrtus tomentosa berry polysaccharide
由图7可知,煮沸灭菌、高压灭菌及微波灭菌等剧烈的杀菌方式对桃金娘果实多糖抗氧化能力的影响较大,而巴氏杀菌这种温和的杀菌方式对多糖抗氧化能力的影响较小。
这说明,在温和的杀菌方式下,多糖结构变化较小,其抗氧化活性可以得到较多的保留。因此,对含有桃金娘果实多糖的产品进行杀菌时应优先选择巴氏杀菌。
3 结论与讨论
桃金娘果实多糖具有较好的抗氧化活性,但受到食品加工条件不同程度的影响。光照、常用食品配料及Na+和K+对桃金娘果实多糖抗氧化稳定性影响较小,而温度、酸碱度、杀菌方式及Ca2+和Fe3+等对桃金娘果实抗氧化稳定性影响较大。抗氧化活性具有多重复杂性,体外评价方法[包括羟基自由基(·OH)清除率]与体内评价方法可能并不一致,甚至可能存在较大的差异。因此,还需对桃金娘多糖的抗氧化活性及其稳定性作进一步的深入研究,以为桃金娘果实多糖产品的开发提供依据。

