EB病毒抗体和SCCA联合检测在鼻咽癌早期诊断和预后判断的价值研究
王才友,张晟春,谢政军,安立,赵春平,王才会
(遵义医科大学第五附属(珠海)医院 检验科,广东 珠海 519100)
0 引言
鼻咽的解剖位置较为隐蔽,大部分鼻咽癌的早期症状不显著,早期诊断率较低,甚至出现早期诊断延误现象,加上部分患者可能早期伴有颈部淋巴结转移,直接给疾病的治疗以及预后带来极大影响,由此看出,早期选择科学合理的诊断方式至关重要[1]。以往临床多选择影像学进行疾病诊断,但难以在短时间之内持续多次诊断,因此无法实时掌握患者病情的改变[2]。另经影像学检查虽然能够观看到患者病灶的具体大小以及形态特征,但无法体现患者的分子水平差异,从而限制其在疾病诊断中的应用。随后临床发现EB 病毒抗体、SCCA(鳞状细胞癌抗原)可成为疾病诊断以及判断恶性程度的指标,其中SCCA 与鳞状上皮细胞来源的恶性肿瘤存在密切关联,而EB 病毒作为疱疹病毒,属于线形双链DNA 病毒,EB 病毒感染与鼻咽癌的发生存在一定关联[3-4]。但两者联合诊断疾病的相关报道较少,对此本文展开实验,结果如下。
1 资料与方法
1.1 一般资料
选择2019 年5 月至2020 年12 月在遵义医科大学第五附属(珠海)医院耳鼻咽喉科、肿瘤科门诊和住院经病理确诊未经放化疗治疗的鼻咽癌患者80例作为A 组,收集经放化疗治疗后的鼻咽癌患者42例作为B 组,收集同期在遵医五院耳鼻咽喉科诊门诊就诊的慢性鼻炎、咽炎以及扁桃体炎患者60 例作为C 组,最后收集同期在遵医五院体检中心体检正常的对照者70 例作为D 组。A 组男52 例,年龄20~83 岁,平均(48.56±2.03)岁,女28 例,年龄23~93 岁,平均(48.11±2.14)岁;B 组男28 例,年龄35~80 岁,平均(49.01±2.10)岁,女14 例,年龄32~85 岁,平均(49.20±2.05)岁;C 组男39 例,年龄20~80 岁,平均(48.96±2.14)岁,女21 例,年龄19~83 岁,平均(49.13±2.17)岁;D 组男42 例,年龄18~75 岁,平均(48.40±2.13)岁,女28 例,年龄19~78 岁,平均(49.07±2.08)岁。各组基本资料相比无差异(P>0.05)。
纳入标准[5]:①符合疾病诊断标准,且未合并其他肿瘤;②D 组身心健康,无心、肝、肺及肾脏等肿瘤疾病及自身免疫性疾病;③观察对象与家属签订知情书,并经过本院伦理委员会批准通过。
剔除标准:①慢性肾脏病、血液透析、银屑病和湿疹者;②未经确诊的疑似鼻咽癌患者;③合并感染、心肺肝肾等重要器官功能严重异常、血液系统疾病、免疫缺陷疾病。
1.2 方法
依据标准规范选择黄色分离胶管收集患者空腹血(5mL),待标本凝固收缩后,按3000 转离心10min,分离血清各两份,放在-70℃冰箱保存待检。
EB 病毒抗体:校准酶标仪与洗板机,保证仪器设备可正常使用,依据说明书要求加样(1:10 稀释)、温育、洗板、加酶、温育、洗板、显色、加终止液,选择酶标仪读数,获得检测结果。同时利用临界值(Cut off 值)对结果进行判定,若Cut off 值=0.10+阴性对照平均(NC)A 值(若阴性平均A 值不足0.05 时以0.05 计算;而阴性平均A 值≥0.05 时以实际值计算),质控要求空白孔的吸光度值不超过0.08,阳性对照(PC)A 值>0.30,阴性对照平均A值<0.08,判断结果时将标本吸光度小于临界值为阴性,反之标本吸光度≥临界值即为阳性。针对1:10阳性的标本,仍以1:20,1:40,1:80 比例稀释,再次检测。
SCCA 检测:将标本置于室温平衡20min,校正仪器设备,保证检测项目室内质量控制在控,依照仪器和项目SOP 标准化操作对标本进行测定,并记录原始数据。
1.3 观察指标
统计各组患者的SCCA、EB-VCR-IgA(EBV 衣壳抗原IgA 抗体)、EB-NA-IgA(EBA 核抗原IgG 抗体)、EA-IgA(EBV 早期抗原IgA 抗体)指标水平,并记录各指标的阳性检出率,最后计算联合与单一诊断的准确性、灵敏度、特异性、阳性以及阴性预测值。
设定真阴性a,假阴性b,真阳性c,假阳性d,阴性预测值=a/(a+b),阳性预测值=c/(c+d),灵敏度=c/(c+b),特异度=a/(a+d),准确度=(c+a)/总例数*100.00%[6]。
1.4 统计学处理
2 结果
2.1 四组EB 病毒抗体、SCCA 指标水平的对比
四组的SCCA、EB-VCR-IgA、EB-NA-IgA、EA-IgA指标相比差异显著(P<0.05),见表1。
表1 四组EB 病毒抗体、SCCA 指标水平的对比()
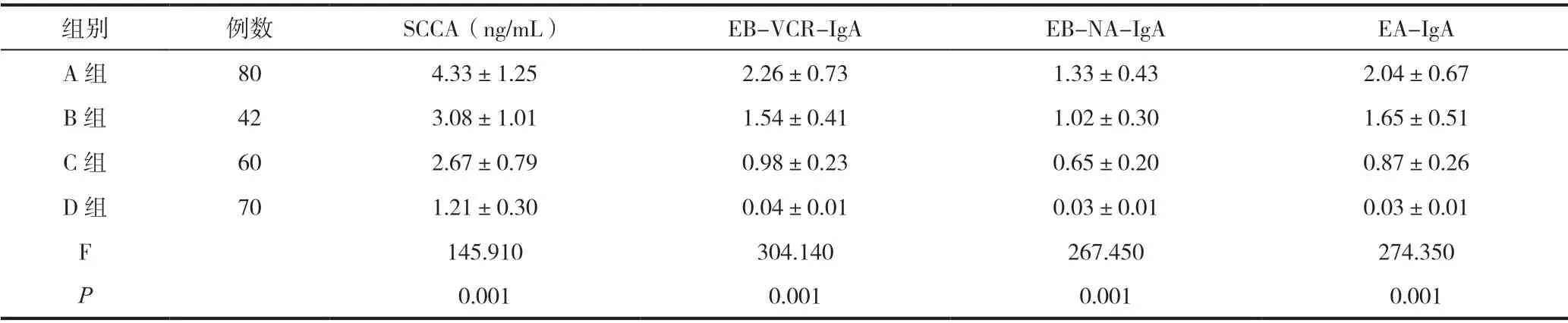
表1 四组EB 病毒抗体、SCCA 指标水平的对比()
2.2 EB 病毒抗体、SCCA 检测结果的分析
联合诊断的准确性、灵敏度、特异性、阳性以及阴性预测值均高出单一SCCA、EB-VCR-IgA、EBNA-IgA、EA-IgA(P<0.05),见表2、表3。

表2 四组EB 病毒抗体、SCCA 指标的检测结果
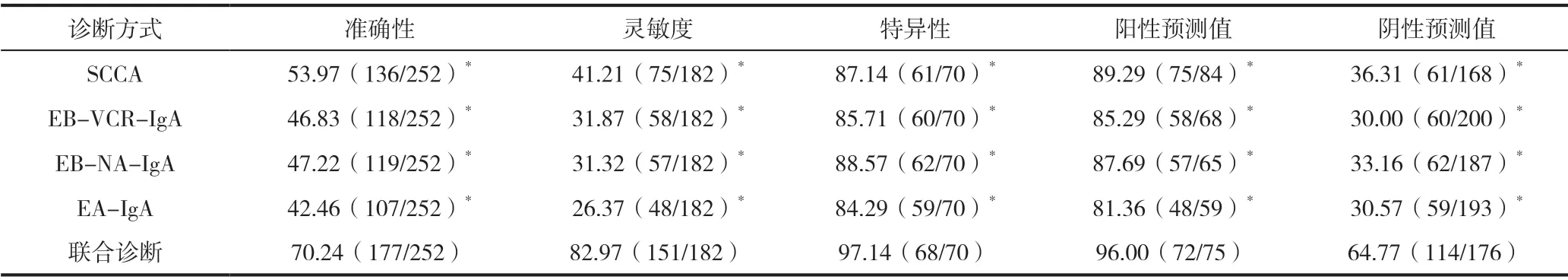
表3 不同诊断方式的结果分析
3 讨论
鼻咽癌通常发生在患者鼻咽腔顶部以及侧壁,早期症状不典型,极易被忽视,随着疾病持续加重,可明显提升放射性损伤、龋齿以及中耳炎发生的风险性[7-8]。目前临床多选择放疗进行干预,可有效杀灭机体中鼻咽癌细胞,并延长生存时长,但不同病理特征患者的预后差异较大,若可通过动态评估方式对疗效及预后进行判断,可达到指导后续治疗的价值[9-10]。
研究表示[11],核酸类标志物中EBV DNA、EBV 编码的miRNA,实时荧光定量PCR 的血浆EBV DNA 检测作为临床较为多见的鼻咽癌标志物,其血浆或血清中EBV DNA 阳性对疾病诊断的敏感性以及特异性达到90%左右,其中血浆组敏感性、特异性较血清组更高。随后临床展开多次试验,均显示患者治疗前后血浆EBV DNA 水平与鼻咽癌的预后存在关系。但实际工作中仍发现PCR 检测ENV DNA 存在较多局限性,例如EBV DNA 检测缺少统一标准,从而导致结果出现偏差,甚至增加误诊漏诊的发生率[12]。EBV 血清抗体标志物包含EB-VCR-IgA、EB-NA-IgA、EA-IgA 等,其中VCR-IgM 被广泛应用在急性感染的诊断中,但其抗体在机体中消失速度较快,单一诊断可造成漏诊,进而延误病情,因此临床在诊断过程中应与其他指标进行联合检测,进而提升检验结果的准确性。随后研究深入探究,发现在此基础上加用SCCA 检测的价值更高,但相关报道较少[13]。本文对此进行实验,结果显示:四组的SCCA、EBVCR-IgA、EB-NA-IgA、EA-IgA 水平相比差异显著(P<0.05);联合诊断的准确性、灵敏度、特异性、阳性以及阴性预测值均高出单一指标(P<0.05),提示联合诊断的价值更高,不仅能够检出疾病,同时可对患者预后进行评价。一旦EB 病毒进入机体,在鼻咽部上皮细胞上增殖,并长时间位于该位置的淋巴细胞,若机体免疫系统发生紊乱,潜伏的EB病毒被激活,进而引发感染,与此同时机体中出现VCR-IgA、NA-IgA、EA-IgA 等抗体,最终导致肿瘤出现,由此看出EB 病毒抗体在疾病诊断中的意义。随后医疗水平不断进步发展,临床对鳞癌抗原检测进行深入研究,发现SCCA 是鳞状细胞癌特异性较高的肿瘤标志物,其水平与临床分期具有一定相关性,同时能够对治疗效果及预后进行评估,但在疾病早期诊断上的价值不高。其中SCCA 作为肿瘤相关抗原,通常处于正常鳞状上皮或者鳞癌细胞中,健康者机体中含量较低,若鳞癌患者血清中该指标表达升高,则表明其血中存在该抗原[14]。另有研究经试验发现[15],SCCA 指标呈现高表达后,患者出现远处转移的风险随之增大,因此随着疾病严重程度的升高,SCCA 表达水平随之增加。此结论与本文结果较为相近,证实SCCA 能够对患者预后进行判断。与EB病毒抗体联合后,进一步提升诊断结果的准确性,不仅能够鉴别疾病,同时还可对治疗效果以及预后进行评估,值得推广。
综上所述,EB 病毒抗体+SCCA 联合诊断的价值更高,为疾病诊断以及预后判断提供一定指导意义。

