基于网络药理学和指纹图谱的黄柏质量标志物预测分析
何巧玉,刘 静,李春霞,王誉程,王晓丽,邢 红,刘 虹,刘二伟,陈晓鹏
基于网络药理学和指纹图谱的黄柏质量标志物预测分析
何巧玉,刘 静,李春霞,王誉程,王晓丽,邢 红,刘 虹,刘二伟,陈晓鹏*
组分中药国家重点实验室,天津中医药大学,天津 301617
为确定质量标志物(quality marker,Q-Marker)体现药材共性的重要度提供数学评价方法,结合网络药理学和指纹图谱方法,并基于Q-Marker“五原则”,对中药黄柏从化学成分有效性以及可测性等角度进行Q-Marker预测分析。利用现有文献对黄柏药材Q-Marker的来源进行整合,运用网络药理学方法构建“成分-靶点-通路”网络并预测黄柏药材中的核心成分。结合指纹图谱对10批黄柏药材进行定性和定量研究,进一步确定黄柏药材中潜在的Q-Marker,并利用多元统计分析对结果进行验证。通过文献查阅确定生物碱、黄酮类以及酚酸类为黄柏Q-Marker主要来源。网络药理学结果表明生物碱类和黄酮类具有高连接度,是其主要活性成分。同时建立了10批黄柏药材指纹图谱,并指认其中8个共有成分,分别为新绿原酸、黄柏碱、木兰花碱、4--阿魏酰奎宁酸、盐酸药根碱、绿原酸、盐酸巴马汀、盐酸小檗碱。结合网络药理学活性和成分可测性以及Q-Marker理念,初步预测黄柏碱、4--阿魏酰奎宁酸、盐酸小檗碱可作为黄柏药材潜在的Q-Marker,最后利用数理统计方法进一步验证了Q-Marker体现药材共性的重要度。利用网络药理学进行初步预测,同时建立指纹图谱结合数理统计的黄柏药材质量控制方法,为黄柏药材的Q-Marker的研究提供参考。
黄柏;质量标志物;网络药理学;指纹图谱;多元统计分析;新绿原酸;黄柏碱;木兰花碱;4--阿魏酰奎宁酸;盐酸药根碱;绿原酸;盐酸巴马汀;盐酸小檗碱
黄柏为芸香科植物黄皮树Schneid的干燥树皮,习称“川黄柏”。其味苦,性寒,归肾、膀胱、大肠经[1],具有清热燥湿、泻火除蒸、解毒疗疮等功效。主要用于治疗湿热泻痢、骨蒸劳热、黄疸尿赤及盗汗、遗精等症[2]。黄柏主要分布于我国云南、湖北、四川、内蒙古等地[3]。其化学成分多样,包括生物碱类、黄酮类、酚酸类以及挥发油等其他类成分,其中生物碱类是黄柏的主要成分,含量约占3%。现代研究表明,黄柏药材具有抗炎、抗真菌、抗氧化、降血压、免疫调节等多种药理作用[4-6],因此在临床上应用广泛。主要用于治疗糖尿病、高血压、急性肾炎以及月经不调等疾病[7-8]。
在质量标志物(quality marker,Q-Marker)确定过程中,发现能体现药材或者方剂共性特征的成分尤为重要。Q-Marker是基于溯源与传递性、特有性、可测性、有效性以及处方配伍这5项核心原则的基础上产生的,与中药的功能属性密切相关且能够反映中药安全性和有效性,为中药质量控制提供科学依据[9-10]。指纹图谱是目前较为成熟的发现不同批次产品共有成分的方法。但在确定的几十甚至上百种共有成分中,每种成分体现共性的重要度尚无报道。数理统计方法如多元统计分析可以通过计算每种成分的变量重要性投影值(variable importance in the projection,VIP)来评价成分对于共性的体现度。
网络药理学是基于系统生物学的理论,从整体观角度构建药物靶点之间相互关系的生物网络,从而有效预测相关靶点和通路的一种分析手段,其强调对信号通路的多途径调节,同时指导和协助药物重新定位,符合中药的多成分、多途径的作用特点[11-12]。本实验基于生物信息、化学和数理统计相结合的方法预测黄柏潜在的Q-Marker,从而建立黄柏药材的质量控制研究方法,以期为黄柏药材的质量控制以及作用机制研究提供参考。
1 仪器与试药
1.1 仪器
Agilent 1260型高效液相色谱仪(安捷伦科技有限公司,包括G1311C四元梯度泵,G1329B自动进样器,G1315D-DAD检测器,G1316A柱温箱,AgilentChemistation数据处理系统)、电子天平(Mettler Toledo,瑞士)、ZZ-3200DTS型超声波清洗机(天津知著科技有限公司,功率330 W)、电热套(北京市永光明医疗仪器有限公司)、涡旋振荡器(Thermo Fisher Scientific)。
1.2 试药
对照品新绿原酸(批号wkq19021413)、4--阿魏酰奎宁酸(批号wkq20061906)均购自四川维克奇生物科技有限公司;对照品盐酸药根碱(批号Z05D10X104878)购自上海源叶生物科技有限公司;对照品黄柏碱(批号DST200217-031)、木兰花碱(批号DST200519-004)、绿原酸(批号DST181201- 021)、盐酸巴马汀(批号DST190802-031)、盐酸小檗碱(批号DST200509-028)均购自成都德思特生物技术有限公司,所有对照品的质量分数均大于98%。乙腈(色谱纯,美国Fisher公司)、屈臣氏饮用水(广州屈臣氏食品饮料有限公司)、磷酸(色谱纯,美国Fisher公司)、甲醇(色谱纯,美国Fisher公司)。实验用四川产黄柏药材来源信息见表1,经天津中医药大学陈晓鹏副研究员鉴定为芸香科植物黄皮树Schneid的干燥树皮,样本留存于天津中医药大学中医药研究院样品室。
2 方法与结果
2.1 黄柏药材Q-Marker来源的文献分析
为了提升中药材及其各类中药产品的质量标准,刘昌孝院士[9]于2016年提出中药Q-Marker的新概念,Q-Marker的核心内容是基于物质有效性、特有性、传递与溯源性、可测性和处方配伍的“五原则”。本质上与中药的功能属性密切相关,且能够作为反映中药有效性和安全性的标示性物质从而进行中药的质量控制研究。本研究通过文献整合,确定黄柏Q-Marker的来源,为建立黄柏药材准确的质量评价标准和科学全面的质量控制方法提供依据。
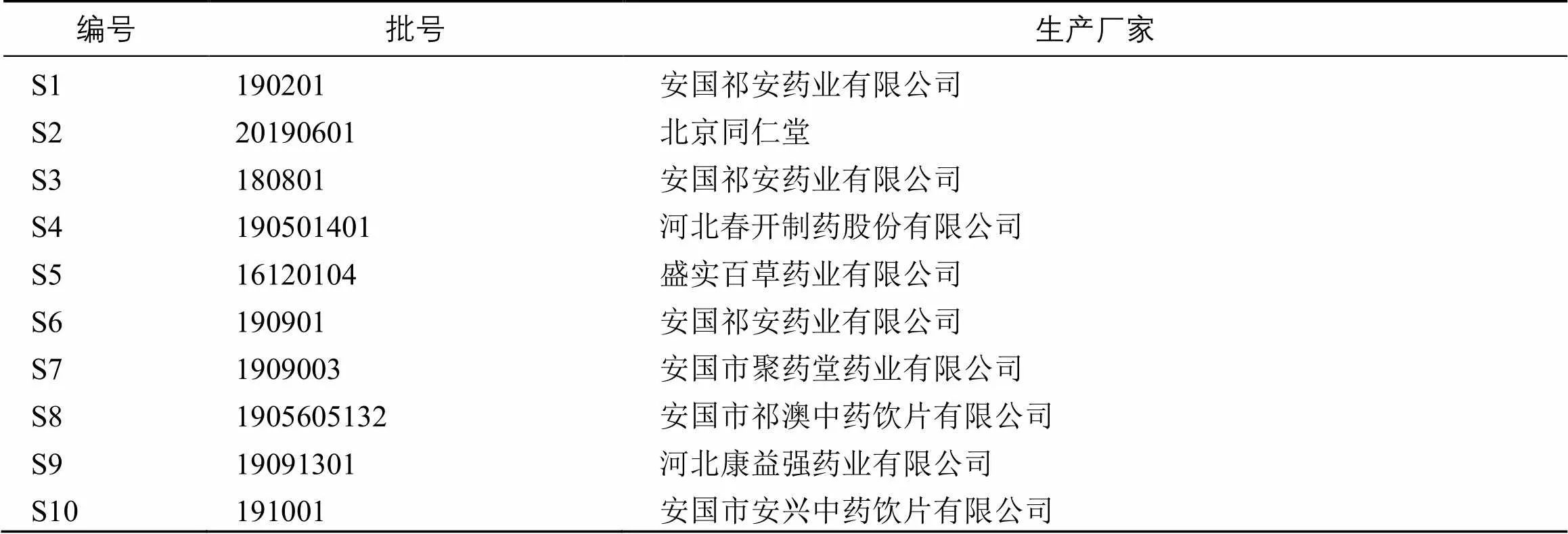
表1 黄柏药材来源信息
2.1.1 基于植物亲缘学及化学成分特有性探讨黄柏Q-Marker 黄柏来源于芸香科(Rutaceae)黄檗属Rupr. 植物黄皮树的干燥树皮,黄檗属植物全世界有4种,主要分布于亚洲东部,我国黄檗属植物有2种及1变种,在东北至西南均有分布[13]。黄柏中的化学成分种类丰富,其中生物碱类、黄酮类和酚酸类成分是黄柏的主要有效成分之一,同时也是发挥药理作用的物质基础[4,14]。生物碱是植物进化过程中与外界环境相互作用形成的一类次生代谢产物,文献报道[15],小檗碱以酪氨酸(-tyrosine)作为起始,经历几步后分别合成多巴胺(dopamine)和4-羟基苯乙醛(4-hydroxyphenyl- acetaldehyde),之后经()-去甲乌药碱合成酶(NCS)、去甲乌药碱-6--甲基转移酶(6-OMT)、()-乌药碱--甲基转移酶(CNMT)、-甲基乌药碱- 3′-羟化酶(CYP80B3)和3′-羟基--甲基乌药碱- 4′--甲基转移酶(4′-OMT)的甲基化作用形成()-网状番荔枝碱,由小檗碱桥酶(BBE)将其催化形成()-金黄紫堇碱[()-scoulerine],最后经金黄紫堇碱-9--甲基转移酶(SMT)、氢化小檗碱合酶(CYP719A1)、四氢小檗碱氧化酶(THBO)催化形成小檗碱。黄柏碱是伪原小檗碱型生物碱,也是一种异喹啉生物碱,以2种酪氨酸衍生物的缩合为起始,经过一系列反应生成反式心果碱和多巴胺,反式心果碱作为前体物质,再经过酶催化之后而形成黄柏碱[16]。黄酮类化合物通过苯丙烷途径将苯丙氨酸转化成香豆酰-CoA,之后进入黄酮合成途径进一步与3分子丙二酰CoA经过分子内环化反应生成二氢黄酮类,在经过不同合成途径生成其他黄酮类化合物[17]。综上,通过比较不同来源黄柏中主要成分的变化,可考虑将生物碱类成分和黄酮类成分作为黄柏Q-Marker的重要参考依据。
2.1.2 基于质量传递与溯源性的黄柏Q-Marker预测分析 《中国药典》2020年版中收载的黄柏炮制品包括盐黄柏和黄柏炭。有学者通过比较黄柏生品与炮制品中生物碱类成分的含量,发现不同炮制方法和温度是影响黄柏中生物碱类成分变化的主要因素[18],预示着生物碱类成分在生品和炮制品之间具有传递性。有研究基于RPLC/Q-TOF-MS技术分析黄柏炭制前后化学成分的变化情况,结果发现生黄柏和黄柏炭的化学成分含量差异显著,某些成分炮制后消失,另外也有新的物质生成,与生品相比,炭制后小檗碱含量减少,黄柏碱在加热过程中产生异构化而生成了同分异构体,有些奎尼酸衍生物在生品中含量较高,炭制后由于在高温下羧基端发生甲酯化反应生成奎尼酸酯衍生物而导致其含量降低[19]。高慧等[20]通过对黄柏炮制过程中的生物碱类成分的含量变化进行研究,结果发现酒炙和盐炙由于在加热条件下导致原有的生物碱成分小檗碱和黄柏碱发生转化,使其含量降低。另还有学者对黄柏生品及其炮制品中8种成分进行含量测定研究,发现酚酸类成分绿原酸在炮制前后含量发生改变[21]。综上所述,生物碱和酚酸类成分在炮制过程中具有传递性,可作为黄柏Q-Marker筛选潜在成分。
2.2 网络药理学对黄柏药材的Q-Marker预测分析
2.2.1 黄柏活性成分的筛选 利用中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/ tcmsp.php)和ETCM数据库(http://www.tcmip. cn/TCMIP/index.php/Home/)[22]检索黄柏的化学成分,在TCMSP数据库中获得102种有效成分,在ETCM数据库中以“黄柏”为关键词检索其主要活性成分,共获得12种有效成分,合并后共获得105种有效成分。收集活性成分相关靶点,再利用Uniprot数据库(https://www.uniprot.org/)以物种“Homo spanies”为筛选条件查询靶点对应的基因名称,得到每种化学成分对应的相关靶点共1457种,删除重复项后,得到319种相关靶点基因。
2.2.2 蛋白互作网络(PPI)的构建 将上述筛选得到的319个靶点导入到STRING 11.0数据库(http://string-db.org/cgi/input.pl)中,物种设为“Homo sapiens”,选取打分值高于0.9的蛋白建立蛋白相互作用网络,筛除PPI网络中离散的节点,保存为tsv文件,其中蛋白互作关系较强的是ABCB1-TP53、ABCC2-ABCG2、ADH1A-ALDH2、ADH1A-ADH1C、ADH1A-ADH1B等。再将上述文件导入到Cytoscape 3.6.1中,利用“Network Analyzer”功能对上述PPI网络中的靶点进行拓扑属性分析,按照度值(degree)由大到小进行排序,见图1。图中包含249个相互作用的节点,1230条相互作用的边,其中,度(degree)值排名前3的AKT1、JUN、MAPK1分别与44、41、41个蛋白发生相互作用。
2.2.3 基因本体(gene ontology,GO)功能富集分析与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路分析
(1)GO功能富集分析:利用DAVID 6.8数据库(https://David-d.ncifcrf.gov/home.jsp)以<0.05、FDR<0.05作为筛选条件对上述319个作用靶点进行GO功能富集分析。结果得到GO条目503个,其中生物过程(biological process,BP)条目有373个,主要涉及的生物过程有RNA聚合酶II启动子转录的正调控、信号传导、对药物的反应、细胞增殖的正调控等。细胞组成(cellular component,CC)条目有38个,主要富集在质膜、胞质溶胶、核质等区域。分子功能(molecular function,MF)条目92个,主要富集在蛋白质结合、蛋白质异二聚体活性、转录因子活性以及序列特异性DNA结合等功能。分别选取BP、CC、MF根据值排名前10的条目,见图2。
(2)KEGG通路富集分析:利用DAVID 6.8数据库(https://David-d.ncifcrf.gov/home.jsp)以<0.05、FDR<0.05为筛选条件对上述319个作用靶点进行KEGG通路富集分析。结果共得到127个条目,主要涉及的通路有:神经活性配体-受体相互作用(neuroactive ligand-receptor interaction)、癌症通路(pathways in cancer)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、乙型肝炎(hepatitis B)、cAMP信号通路(cAMP signaling pathway)等,并选取排名前20的通路进行KEGG通路富集分析气泡图的绘制,见图3。以上结果表明中药黄柏具有多成分、多靶点的作用特点,能够通过调控多条通路达到治疗疾病的作用。

图1 蛋白-蛋白相互作用(PPI)网络
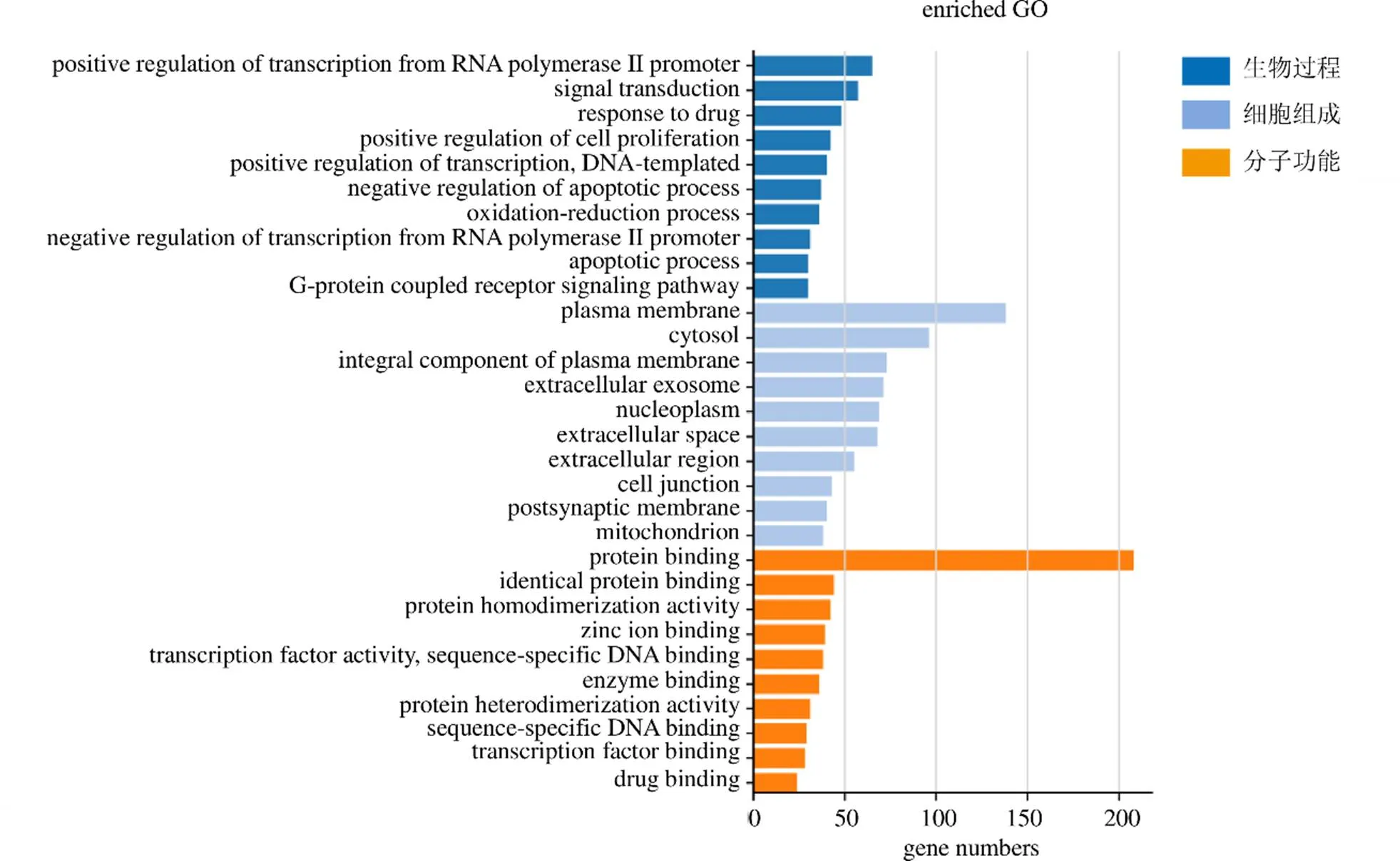
图2 GO功能富集分析柱状图

圆点越大,富集基因的数目越多;P值越小,圆点颜色越红,P值越大,圆点颜色越绿
2.2.4 “活性成分-靶点-通路网络”的构建 将KEGG通路富集分析得到的前10条通路和这些通路涉及的148个靶点,以及靶点所对应的84种成分导入到Cytoscape 3.6.1中构建黄柏“活性成分-靶点-通路”网络,进行可视化分析见图4。根据图中节点的连接度(degree)可知,连接degree值较高的化合物有槲皮素(degree=74)、β-谷甾醇(degree=52)、黄柏碱(degree=32)、木兰花碱(degree=32)、7-去氢豆甾醇(degree=30)、菜油甾醇(degree=28)、四氢非洲防己碱(degree=24)、四氢小檗碱(degree=24)、STOCK1N-14407(degree=23)、丹皮酚(degree=22)、蝙蝠葛任碱(degree=20)、卡维丁(degree=19)、-甲基芸香碱(degree=18)、丁香酚(degree=18)、4-[()-3-hydroxyprop-1-enyl]-2,6-dimethoxyphenol(degree=18)、原阿片碱(degree=17)、去氢丹参酮IIA(degree=15)、植物甾醇(degree=15)、蝙蝠葛波酚碱(degree=13)、4-氧代异佛尔酮(degree=13)、丁香苷(degree=13)、巴马汀(degree=13)、油酸(degree=12)、松柏醇(degree=12)、小檗碱(degree=11),表明这些活性成分可能是黄柏发挥药效的潜在Q-Marker,以2倍中位数的degree值(degree值中位数为16)进行初步筛选,得到1个新的网络,再利用1倍中位数的degree值、介数中心性(betweenness centrality)、接近中心性(closeness centrality)值进行二次筛选,得到最终的20个关键靶蛋白,分别为AKT1(degree=44)、MAPK1(degree=41)、JUN(degree=41)、TP53(degree=37)、RELA(degree=35)、TNF(degree=35)、CXCL8(degree=33)、HSP90AA1(degree=31)MAPK14(degree=28)、IL6(degree=26)、ESR1(degree=25)、SP1(degree=25)、EGFR(degree=25)、EDN1(degree=24)、PPARA(degree=24)、RXRA(degree=23)、VEGFA(degree=22)、EGF(degree=20)、RB1(degree=20)、PRKCA(degree=20),预示这些靶点可能作用于癌症通路、PI3K-Akt信号通路、cAMP信号通路以及其他信号通路对某些疾病的治疗发挥关键性作用。
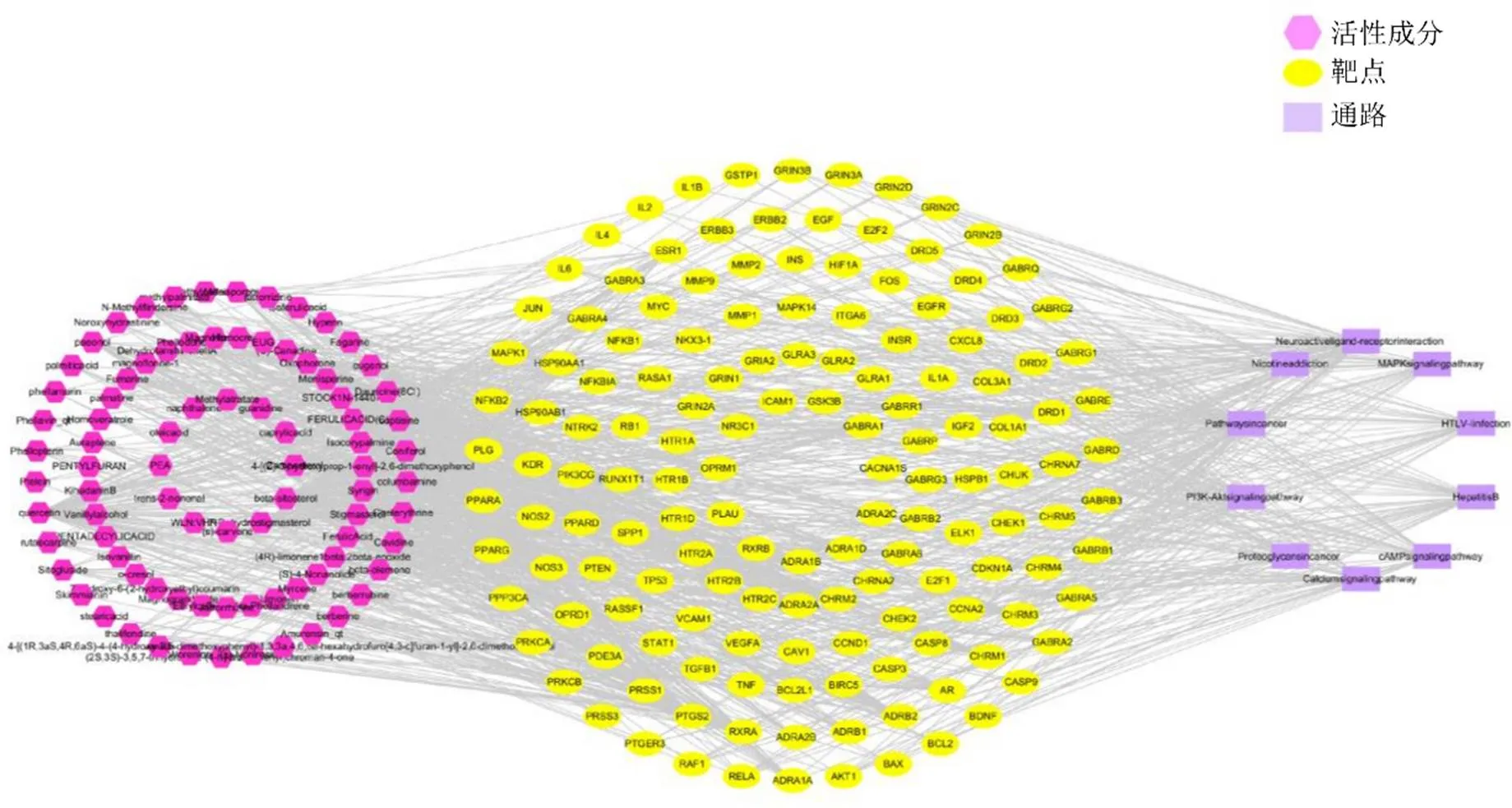
图4 “黄柏活性成分-靶点-通路”网络
2.3 黄柏指纹图谱定性分析
2.3.1 色谱条件 采用安捷伦Eclipse Plus C18柱(250 mm×4.6 mm,5 µm);流动相为乙腈(A)-0.2%磷酸水溶液(B),梯度洗脱:0~8 min,5%~15% A;8~12 min,15%~20% A;12~18 min,20%~25% A;18~27 min,25%~29% A;27~28 min,29%~32% A;28~31 min,32%~35% A;31~35 min,35%~95% A。体积流量1.0 mL/min,检测波长280 nm,柱温30 ℃,进样量10 µL。
2.3.2 对照品溶液的制备 精密称取新绿原酸、黄柏碱、木兰花碱、4--阿魏酰奎宁酸、盐酸药根碱、绿原酸、盐酸巴马汀、盐酸小檗碱对照品适量,加甲醇溶解并稀释,得到质量浓度分别为35、100、40、150、15、30、15、350 µg/mL的混合对照品溶液,于−20 ℃保存备用。
2.3.3 供试品溶液的制备 均匀称取黄柏粗粉3 g,加入480 mL的水,于500 mL电热套中煎煮至约240 mL,冷却至室温,经纱布滤过,滤液用水补足240 mL,即得黄柏提取液。进样前用0.22 µm的微孔滤膜滤过,滤液即为供试品溶液。
2.3.4 方法学考察
(1)参照峰的选择:小檗碱作为中药黄柏中的主要成分,依据《中国药典》2020年版,将小檗碱作为评价黄柏质量的指标性成分之一,其峰面积较大,峰形较好,色谱峰较稳定,故选择小檗碱作为参照峰,计算各共有峰的相对保留时间以及相对峰高。
(2)日内精密度:精密称取黄柏样品(S1),按“2.3.3”项下的方法进行供试品溶液的制备,并利用“2.3.1”项的色谱条件连续进样6次,以小檗碱作为参照峰,计算各个共有峰的相对保留时间和相对峰高,结果各峰的相对保留时间RSD<0.07%,相对峰高RSD<0.67%,相似度为1.000,表明该仪器的精密度良好。
(3)日间精密度:精密称取黄柏样品(S1),按“2.3.3”项下的方法进行供试品溶液的制备,并利用“2.3.1”项色谱条件选择3 d分别连续进样6次,以小檗碱作为参照峰,计算各共有峰的相对保留时间和相对峰高,结果各峰相对保留时间RSD<0.61%,相对峰高RSD<2.05%,相似度≥0.999,表明该仪器的精密度良好。
(4)重复性试验:精密称取黄柏样品(S1)各6份,按“2.3.3”项下的方法平行制备6份供试品溶液,并利用“2.3.1”项色谱条件进样测定,以小檗碱作为参照峰,计算各共有峰的相对保留时间和相对峰高,结果各峰相对保留时间RSD<0.11%,相对峰高RSD<2.87%,相似度为1.000,表明该方法的重复性良好。
(5)稳定性试验:精密称取黄柏样品(S1),按“2.3.3”项下的方法进行供试品溶液的制备,分别利用“2.3.1”项色谱条件在0、2、4、8、12、24 h进行测定,以小檗碱作为参照峰,计算各共有峰的相对保留时间和相对峰高,结果各峰相对保留时间RSD<0.15%,相对峰高RSD<2.44%,相似度为1.000,表明黄柏供试品溶液在24 h内的稳定性良好。
2.3.5 指纹图谱的建立与相关性分析 取10批黄柏药材粉末,按“2.3.3”项下的方法制备供试品溶液,并利用“2.3.1”项下的色谱条件进行测定,记录色谱图。再将上述10批黄柏药材的HPLC色谱图导入到中药指纹图谱相似度评价系统中(2012年版),采用中位数法,时间窗设为0.1,并以测定的10批黄柏样品中的S1样品的图谱作为参照图谱并同时生成对照图谱(R),然后对其相似度进行评价。结果共标定出16个共有峰,将黄柏药材指纹图谱进行叠加,结果见图5。相似度结果表明,黄柏药材指纹图谱的相似度在0.994~1.000,S1~S10相似度依次为0.999、1.000、1.000、1.000、1.000、1.000、1.000、0.994、1.000、0.999,表明同一产地黄柏药材的质量稳定均一。10批黄柏指纹图谱共检测到16个共有峰,经过与混合对照品溶液图谱的比对,指认了其中的8个色谱峰,分别为1号峰新绿原酸、4号峰绿原酸、6号峰黄柏碱、7号峰木兰花碱、9号峰4--阿魏酰奎宁酸、14号峰盐酸药根碱、15号峰盐酸巴马汀、16号峰盐酸小檗碱,见图6。
2.4 正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)
为了进一步验证黄柏药材潜在Q-Marker对药材共性的体现程度,将10批药材随机分为2组,每组5批药材,并采用有监督模式的OPLS-DA进行组间分析。模型拟合参数2=0.609,2=0.896,模型预测参数2=0.543,均大于0.5,表明所建立的模型稳定且预测能力较强,10批黄柏样品的OPLS- DA得分矩阵图见图7。

图5 10批黄柏样品指纹图谱叠加图

1-新绿原酸 4-绿原酸 6-黄柏碱 7-木兰花碱 9-4-O-阿魏酰奎宁酸 14-盐酸药根碱 15-盐酸巴马汀 16-盐酸小檗碱

图7 10批黄柏样品的OPLS-DA得分图
为了反映成分对黄柏药材的共性表征的重要度,各成分的VIP值见图8。来自四川的10批黄柏药材按VIP值由小到大筛选出组间具有共性的标志性成分,VIP值越小,成分体现药材共性的重要性越大,即图中靠右侧的成分(6号峰为黄柏碱)体现黄柏药材的共性的重要性最大。由于4号峰(绿原酸)和1号峰(新绿原酸)在多种中药中普遍存在,因此不适合作为辨别药材质量的标志性成分。2、8、3、5、13、11、10、12号峰尚未归属到具体成分。15号峰(巴马汀)、14号峰(药根碱)和7号峰(木兰花碱)在目前黄柏水提物中含量较低,不宜作为检测指标成分。16号峰(小檗碱)及9号峰(4--阿魏酰奎宁酸)VIP值均较小,能较好体现黄柏药材共性,适宜作为黄柏药材的Q-Marker。
2.5 黄柏药材Q-Marker的含量测定
综合考虑网络药理学筛选成分的度值、可测性和共有成分重要性贡献度,选取黄柏碱、4--阿魏酰奎宁酸、盐酸小檗碱进行含量测定。

图8 黄柏药材成分的VIP
2.5.1 色谱条件 同“2.3.1”项下的色谱条件。
2.5.2 对照品溶液的制备 精密称定黄柏碱、4--阿魏酰奎宁酸以及盐酸小檗碱的对照品适量,加甲醇制成含黄柏碱18.75 µg/mL、4--阿魏酰奎宁酸200.00 µg/mL、盐酸小檗碱20.00 µg/mL的混合对照品溶液。
2.5.3 供试品溶液的制备 按“2.3.3”项下的供试品溶液的制备方法进行制备。
2.5.4 方法学考察
(1)专属性试验:利用上述的色谱条件,分别将空白水溶液、供试品溶液及对照品溶液进样测定,结果其空白水溶液基线无干扰,供试品溶液无杂质峰干扰,说明此分析方法具有良好的专属性,结果见图9。
(2)检测限与定量限:以3倍的信噪比为检测限,10倍的信噪比为定量限,实验测得黄柏碱的检测限为0.06 μg/mL,定量限为0.27 μg/mL,4--阿魏酰奎宁酸的检测限为0.56 μg/mL,定量限为1.36 μg/mL,盐酸小檗碱的检测限为0.25 μg/mL,定量限为0.51 μg/mL。
(3)线性关系考察:精密称取“2.5.2”项下的混合对照品溶液,分别逐级稀释一定倍数后,按“2.3.1”项下的色谱条件进样测定,分别测定黄柏碱、4--阿魏酰奎宁酸、盐酸小檗碱的峰高,以质量浓度为横坐标(),对照品的峰高为纵坐标(),绘制标准曲线,计算回归方程,结果见表2。
(4)精密度试验:精密称取黄柏样品(S1),按“2.3.3”项下的方法进行供试品溶液的制备,并利用“2.3.1”项下的色谱条件连续进样6次,计算供试品溶液中黄柏碱、4--阿魏酰奎宁酸、盐酸小檗碱的峰高RSD分别为0.67%、0.57%、0.25%,表明仪器的精密度良好。
(5)重复性试验:精密称取黄柏样品(S1)各6份,按“2.3.3”项下的方法进行供试品溶液的制备,并按“2.3.1”项下的色谱条件进行测定,计算供试品溶液中黄柏碱、4--阿魏酰奎宁酸、盐酸小檗碱的质量分数RSD分别为2.01%、2.16%、1.42%,表明该方法的重复性良好。
(6)稳定性试验:精密称取黄柏样品(S1),按“2.3.3”项下的方法进行供试品溶液的制备,分别按“2.3.1”项下的色谱条件在0、2、4、8、12、24 h进行测定,计算供试品溶液中黄柏碱、4--阿魏酰奎宁酸、盐酸小檗碱的峰高RSD分别为2.44%、1.73%、1.57%,表明黄柏供试品溶液在24 h内稳定性良好。
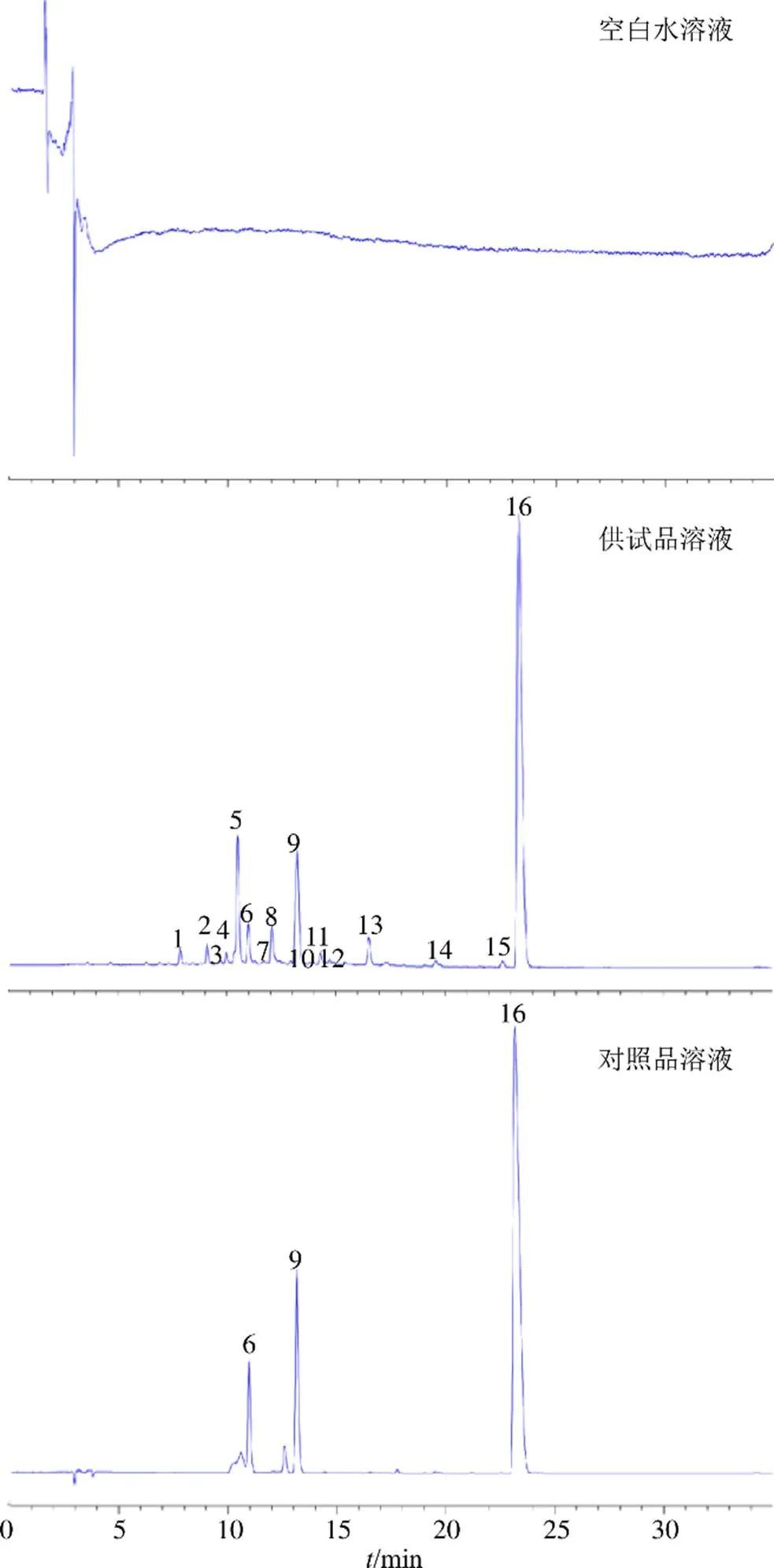
6-黄柏碱 9-4-O-阿魏酰奎宁酸 16-盐酸小檗碱
(7)加样回收率试验:精密称定已测定的黄柏粉末(S1)9份,将其分成3组,每组3份,每组按1∶0.8、1∶1和1∶1.2的比例分别加入黄柏碱、4--阿魏酰奎宁酸、盐酸小檗碱对照品,按“2.3.3”项下的方法进行供试品溶液的制备,并利用“2.3.1”项下的色谱条件进样测定,记录色谱峰的峰高以及计算各成分的含量。加样回收率结果显示黄柏碱、4--阿魏酰奎宁酸、盐酸小檗碱的平均加样回收率分别为101.50%、99.50%、99.80%,RSD分别为1.28%、0.61%、1.40%,表明所建立的含量测定方法准确度良好。
2.5.5 黄柏样品测定 分别精密称取10批黄柏样品,按照“2.3.3”项下的方法进行供试品溶液的制备,并按“2.3.1”项下的色谱条件进行测定,计算黄柏碱、4--阿魏酰奎宁酸、盐酸小檗碱的含量,结果见表3。
3 讨论
指纹图谱方法是目前测定不同批次产品共有峰,即共有成分较为成熟的方法。本研究在指纹图谱确定共有成分的基础上,利用数理统计方法进一步分析了每个共有成分体现药材共性的重要度,赋予了共有成分新的内涵,也为筛选Q-Marker提供了新的思路和方法。根据成分体现药材共性的VIP值进行由小到大排序,基于成分含量和含量的波动情况筛选出标志性成分,能够更加有代表性的分析和评价药材质量。
网络药理学分析得知AKT1(degree=44)、MAPK1(degree=41)、JUN(degree=41)、TP53(degree=37)等靶点可能作用于癌症通路、PI3K-Akt信号通路以及cAMP信号通路发挥关键性作用。研究表明,黄柏中的生物碱成分在治疗肿瘤性疾病和发挥抗炎等药理作用上有一定疗效[23-24]。有学者通过体外实验证实黄柏中的生物碱类成分小檗碱可通过调控PI3K/Akt通路抑制喉癌Hep2细胞的增殖、侵袭和迁移,从而发挥一定的治疗作用[25],与本实验研究结果一致。

表2 3个指标性成分的线性回归方程
在筛选核心成分的过程中,degree值排名靠前的有槲皮素、β-谷甾醇、黄柏碱、木兰花碱、7-去氢豆甾醇、菜油甾醇、四氢非洲防己碱、四氢小檗碱、STOCK1N-14407、丹皮酚、蝙蝠葛任碱、卡维丁、-甲基芸香碱、丁香酚、4-[()-3-hydroxyprop-1- enyl]-2,6-dimethoxyphenol、原阿片碱、去氢丹参酮IIA、植物甾醇、蝙蝠葛波酚碱、4-氧代异佛尔酮、丁香苷、巴马汀、油酸、松柏醇、小檗碱。由于槲皮素、β-谷甾醇以及植物甾醇在自然界中普遍存在,同时这几种成分也广泛存在于多种中药材中,具有多种生物活性[26-28],因此不能作为辨别药材质量的标志性成分。网络药理学筛选得到的7-去氢豆甾醇、菜油甾醇、四氢非洲防己碱、四氢小檗碱、卡维丁、原阿片碱、STOCK1N-14407、丹皮酚、-甲基芸香碱、丁香酚、4-[()-3-hydroxyprop-1-enyl]-2,6- dimethoxyphenol、原阿片碱、去氢丹参酮IIA、蝙蝠葛波酚碱、4-氧代异佛尔酮、丁香苷、油酸、松柏醇、木兰花碱、蝙蝠葛任碱、巴马汀在黄柏提取物中含量较低,基于成分可测性角度,不适合作为评价黄柏药材质量的标志性成分。刘洋等[29]建立HPLC法对川黄柏中的盐酸小檗碱进行含量测定及抑菌活性评价,证明盐酸小檗碱的抑菌作用与黄柏在抗感染方面的药理作用相一致,可考虑作为黄柏的Q-Marker。黄柏碱可通过通过调控TLR4/NLRP3信号通路来降低机体内的炎症因子水平,进而改善肾损伤[30]。另外,黄柏碱还可显著抑制免疫效应,发挥免疫调节作用[31],其药理活性与黄柏的传统药效具有一定的相关性,适合作为黄柏的Q-Marker成分。

表3 10批黄柏样品含量测定结果
阿魏酰奎宁酸类化合物主要发挥抗氧化、抗肿瘤以及清除体内自由基等多种疗效[32-33]。有研究报道黄柏的树皮提取物可以保护皮肤屏障免受空气污染物的损害,且活性成分4--阿魏酰奎宁酸是应对诱导损伤作用的主要决定因素[34]。目前,关于化合物4--阿魏酰奎宁酸在黄柏药材中的研究尚不广泛,有学者在2019年利用HPLC-DAD-ESI-MS/MS技术对黄柏中的4--阿魏酰奎宁酸进行定性定量分析[35]。
本实验根据网络药理学结果可知,黄柏碱、小檗碱度值排名靠前,基于化学成分有效性角度可将这2种成分作为黄柏的质量标志物成分Q-Marker,根据指纹图谱、数理统计及含量测定结果分析,4--阿魏酰奎宁酸含量较高,可测性好,且能较有代表性的体现不同批次药材的共性,也适合作为黄柏的Q-Marker成分。因此本实验选择以黄柏碱、4--阿魏酰奎宁酸、小檗碱进行定量分析,确定其Q-Marker成分。
中药化学成分复杂,其质量标准和质量控制研究是制约中医药产业发展的瓶颈问题,自Q-Marker概念提出后,中药质量控制研究成为行业关注的热点。本实验为确定Q-Marker体现药材共性的重要度提供了新的数学方法,采用传统水提取进行黄柏指纹图谱定性及定量研究,同时结合网络药理学方法并基于Q-Marker“五原则”,从化学和生物信息学的角度预测黄柏药材潜在的Q-Marker,为后期深入研究中药黄柏的作用机制提供参考依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 国家中医药管理局《中华本草》编委会. 中华本草 [M]. 上海: 上海科学技术出版社, 1998: 1039-1050.
[2] 中国药典[S]. 一部. 2020: 318.
[3] 甘晓冬, 戴克敏. 中药黄柏种及变种的鉴定 [J]. 上海医科大学学报, 1990, 17(1): 57-60.
[4] 李先宽, 冯杉, 郑艳超, 等. 黄柏与关黄柏的化学成分及生物活性研究进展 [J]. 药物评价研究, 2019, 42(5): 1033-1037.
[5] Ryuk J A, Zheng M S, Lee M Y,. Discrimination ofandbased on DNA analysis and the simultaneous analysis of alkaloids [J]., 2012, 35(6): 1045-1054.
[6] 王荣. 川黄柏的化学成分及药理活性研究进展 [J]. 临床合理用药杂志, 2020, 13(1): 173-174.
[7] 赵灿, 杨金伟, 吴勇军, 等. 基于网络药理学知母-黄柏药对治疗糖尿病作用机制 [J]. 世界中医药, 2020, 15(22): 3369-3374.
[8] Chatuphonprasert W, Nemoto N, Sakuma T,. Modulations of cytochrome P450 expression in diabetic mice by berberine [J]., 2012, 196(1/2): 23-29.
[9] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[10] 张铁军, 白钢, 陈常青, 等. 基于“五原则”的复方中药质量标志物 (Q-marker) 研究路径 [J]. 中草药, 2018, 49(1): 1-13.
[11] Ye H, Wei J, Tang K,Drug repositioning through network pharmacology [J]., 2016, 16(30): 3646-3656.
[12] 王俊尧, 陈建新, 赵慧辉. 基于网络药理学研究肝经中药与治疗疾病的关系[J]. 世界中医药, 2019, 14(3): 581-584.
[13] 中国科学院中国植物志编辑委员会. 中国植物志 [M]. 北京: 科学出版社, 1997: 99-103.
[14] Xian X, Sun B, Ye X,. Identification and analysis of alkaloids inby high-performance liquid chromatography with electrospray ionization mass spectrometry coupled with photodiode array detection [J]., 2014, 37(13): 1533-1545.
[15] 张艳, 张剑, 葛海霞. 黄连中苄基异喹啉类生物碱的生源途径及其合成生物学的应用进展 [J]. 药物生物技术, 2019, 26(2): 165-171.
[16] 程巧, 曾建国, 乐捷. 异喹啉类生物碱生物合成、运输、储藏相关细胞生物学研究进展 [J]. 植物学报, 2014, 49(6): 720-728.
[17] 邹丽秋, 王彩霞, 匡雪君, 等. 黄酮类化合物合成途径及合成生物学研究进展 [J]. 中国中药杂志, 2016, 41(22): 4124-4128.
[18] 史黎萍, 纪峰, 年华. 黄柏不同炮制品生物碱类成分含量测定[J]. 国际中医中药杂志, 2019(9): 981-985.
[19] 李利新, 乔斌, 李遇伯, 等. 基于RPLC/Q-TOF-MS技术的黄柏炭制前后化学成分变化研究 [J]. 中草药, 2012, 43(7): 1314-1319.
[20] 张凡, 高慧, 徐钢, 等. 黄柏炮制过程中生物碱成分含量变化的研究 [J]. 中国医药科学, 2013, 3(1): 43-45.
[21] 徐珊, 张凡, 刘蓬蓬, 等. 黄柏及其不同炮制品的HPLC指纹图谱分析 [J]. 中国实验方剂学杂志, 2015, 21(3): 10-13.
[22] Xu H Y, Zhang Y Q, Liu Z M,. ETCM: An encyclopaedia of traditional Chinese medicine [J]., 2019, 47(D1): D976-D982.
[23] Sun Y, Lenon G B, Yang A W H.: A phytochemical, pharmacological, and pharmacokinetic review [J]., 2019, 2019: 7621929.
[24] Xian Y F, Mao Q Q, Ip S P,. Comparison on the anti-inflammatory effect ofandin 12-- tetradecanoyl-phorbol-13-acetate-induced ear edema in mice [J]., 2011, 137(3): 1425-1430.
[25] 谢天飞, 王凌云, 刘丽, 等. 小檗碱通过调控PI3K/Akt通路抑制喉癌细胞生长和转移 [J]. 中国新药与临床杂志, 2020, 39(1): 43-48.
[26] Tang S M, Deng X T, Zhou J,. Pharmacological basis and new insights of quercetin action in respect to its anti-cancer effects [J]., 2020, 121: 109604.
[27] Babu S, Jayaraman S. An update on β-sitosterol: A potential herbal nutraceutical for diabetic management [J]., 2020, 131: 110702.
[28] 赵军宁, 田兴军, 彭成, 等. 川产道地药材资源保障与高质量发展策略[J]. 世界中医药, 2020, 15(2): 181-190.
[29] 刘洋, 冉聪, 游桂香, 等. 川黄柏中盐酸小檗碱HPLC测定优化及其抑菌活性评价 [J]. 中国农业科技导报, 2020, 22(2): 179-186.
[30] 姜盈盈, 林岳. 黄柏碱改善脓毒症大鼠急性肾损伤的作用及机制研究 [J]. 中国中西医结合外科杂志, 2019, 25(6): 882-887.
[31] 熊敏. 黄柏化学成分分析及药理作用研究 [J]. 亚太传统医药, 2014, 10(14): 34-35.
[32] 王萌. 常用中药川黄柏和黄连化学成分及生物活性比较研究 [D]. 北京: 清华大学医学部, 2009.
[33] Yasir M, Sultana B, Nigam P S,. Antioxidant and genoprotective activity of selected Cucurbitaceae seed extracts and LC-ESIMS/MS identification of phenolic components [J]., 2016, 199: 307-313.
[34] Choi J, Moon M Y, Han G Y,.extract protects human keratinocytes from PM2.5-induced inflammation via PAR-2 signaling [J]., 2020, 11(1): E23.
[35] Chen Y, Zhang Z, Zhang Y,. A new method for simultaneous determination of phenolic acids, alkaloids and limonoids in[J]., 2019, 24(4): 709.
Predictive analysis ofquality markers based on network pharmacology and fingerprint
HE Qiao-yu, LIU Jing, LI Chun-xia, WANG Yu-cheng , WANG Xiao-li, XING Hong, LIU Hong, LIU Er-wei, CHEN Xiao-peng
State Key Laboratory of Component-based Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617,China
To predict and analyze the potential quality markers (Q-Markers) of Huangbo ()based on the “five principles” of Q-Markers combined with fingerprint and network pharmacology methods from the perspectives of chemical composition validity and measurability and so on, so as to provide a mathematical evaluation method for determining the importance of Q-Marker to reflect the commonness of medicinal materials.The sources ofQ-Marker were integrated by existing literature, and a “component-target-pathway” network was constructed by using network pharmacology and the core components ofwere predicted, and the qualitative and quantitative research of 10 batches ofwas carried out to further determine the potential Q-Marker, and the results were verified by using multivariate statistical analysis.Literature studies had determined that alkaloids, flavonoids and phenolic acids were the main source ofQ-Marker. The results of network pharmacology showed that alkaloids and flavonoids were its main active ingredients with high connectivity. At the same time, 10 batches offingerprints were established, and eight common components, neochlorogenic acid, phellodendrine, magnoflorine, 4--feruloylquinic acid, jatrorrhizine hydrochloride, chlorogenic acid, palmatine chloride, berberine hydrochloride, were identified. Combining network pharmacological activity and component measurability as well as Q-Marker concept, it is preliminary predicted that phellodendrine, 4--feruloylquinic acid, and berberine hydrochloride could be the potential Q-Markers of. Finally, mathematical statistics methods were used to further verify the importance of Q-Marker reflecting the commonness of medicinal materials.Using network pharmacology to make preliminary predictions, and establish a method for quality control ofwith fingerprint and mathematical statistics, which provides a reference for the research on the quality control and mechanism of.
; Q-Marker; network pharmacology; fingerprint; multivariate statistical analysis; neochlorogenicacid; phellodendrine, magnoflorine; 4--feruloylquinic acid; jatrorrhizine hydrochloride; chlorogenic acid; palmatine chloride; berberine hydrochloride
R284
A
0253 - 2670(2021)16 - 4931 -11
10.7501/j.issn.0253-2670.2021.16.018
2021-04-12
重大新药创制专项(2018ZY09735-002);重大新药创制专项(2019ZX09201005-002-007);国家自然科学基金青年项目(81903915)
何巧玉(1998—),女,汉族,辽宁营口人,硕士研究生,研究方向为中药物质基础和质量控制。E-mail: 15524743165@163.com
陈晓鹏(1983—),女,汉族,天津人,博士,副研究员,硕士生导师,主要从事中药物质基础和质量控制。Tel: (022)59596163 E-mail: xpchen@tjutcm.edu.cn
[责任编辑 王文倩]

