能谱CT血管成像评价颈动脉粥样硬化斑块成分的临床分析*
王正通 王小强 陈月芹 陈夫涛 秦文恒 孙占国
(济宁医学院附属医院,济宁,272029)
缺血性脑卒中发病率呈逐年上升趋势[1]。研究显示,颈动脉粥样硬化斑块的组成成分及其易损性与缺血性脑卒中事件密切相关[2]。目前,临床上主要采用超声、常规CTA或MR血管壁成像检测颈动脉斑块,其中超声是首选筛查手段,临床应用广泛,但其对斑块脂质坏死与斑块内出血的鉴别困难,加之超声评估斑块内部结构具有主观性,导致斑块成分及易损性分析存在不足[3];常规CTA仅通过测量斑块CT值来评价斑块的组织成分,参数单一,对斑块易损性的界定亦存在较大局限性[4]; MR血管壁增强成像被认为是评估颈动脉斑块易损性的最佳影像检查方法,但MRI检查亦存在一定的局限性,如设备依赖性强、检查时间长、对患者配合度要求高等,尤其禁用于心脏起搏器植入或幽闭恐惧患者[5]。
能谱CTA通过瞬时双电压切换实现单源同向双能成像,将传统的混合能量分解为101个单能量,最佳单能量图像可提高图像的对比噪声比,有利于识别颈动脉的小斑块[6-7],并可通过能谱曲线及有效原子序数判断斑块成分,是评估斑块稳定性的有效补充检查[8]。目前能谱CTA与组织病理学结果进行对比的相关研究仍不充分,有必要进一步验证分析。本文回顾性分析颈动脉粥样硬化患者的颈动脉斑块多参数能谱CTA数据,同时与组织病理学结果对照,以探讨能谱CTA对颈动脉斑块成分的评估价值。
1 资料与方法
1.1 临床资料
收集2019年1月至2020年12月,于济宁医学院附属医院就诊并经超声筛查拟行颈动脉内膜剥脱术的颈动脉粥样硬化症患者44例,其中男性34例,女性10例,年龄46~87岁,平均年龄(67.44±12.03)岁。纳入标准:1)超声筛查提示单侧或双侧颈动脉分叉区2cm范围内至少1处以非钙化成分为主的斑块,斑块长径≥3cm,致管腔狭窄率>70%;2)无碘对比剂使用禁忌。排除标准:1)CT发现颈动脉斑块钙化较重;2)患有其它心源性或精神性疾病对研究产生影响的患者;3)患者或其亲属拒绝签署知情同意书;4)单方面拒绝进一步诊治的患者。44例患者行颈动脉能谱CTA共检出49处斑块,其中5例患者的一侧颈动脉存在两处较大斑块(与超声检查结果一致)。所有患者均签署知情同意书。
1.2 能谱CTA检查及图像后处理
采用能谱CT(美国GE公司256排Revolution CT)扫描仪行GE-GSI扫描模式下颈部CTA检查。患者仰卧位于扫描床,双手置于身体两侧,扫描范围自主动脉弓至大脑动脉环上缘水平。采用双筒高压注射器经肘正中静脉注射碘普罗胺注射液(370mgI/mL),对比剂用量及注射流速根据患者体重指数个性化选择,最后注入20mL生理盐水冲管。扫描监测位置为主动脉弓下缘水平的胸主动脉,阈值为120Hu,于造影剂团注10s开始监测,达到阈值后6s启动扫描。扫描参数:管电压为80/140kV,管电流225mA;层厚0.625mm,螺距0.984∶1,球管转速0.6s/rot,矩阵512×512。
将重建后的影像数据传至AW Server图像后处理工作站进行容积再现(VR)、多平面重建(MPR)、曲面重建(CPR)等;使用能谱分析平台(GSI Viewer)获取斑块的能谱曲线及有效原子序数图,即于颈动脉管腔最狭窄层面选择斑块的感兴趣区(region of interest,ROI),ROI避开斑块的钙化部分,另将同样大小的ROI置于相应层面皮下脂肪、肌肉,获得相对应的参考能谱曲线及有效原子序数图,斑块内出血的能谱曲线以标准血曲线为参考。观察斑块的能谱曲线与皮下脂肪、肌肉和标准血曲线的相似性,同时记录斑块有效原子序数值。
斑块能谱曲线斜率:在斑块上选取测量的ROI,ROI均为3mm2。根据所得3种斑块成分的能谱曲线,分别计算出3种斑块成分能谱曲线的斜率(K),取40keV与110keV作为参考点,计算公式为K=(HU40-HU110)/70。
斑块有效原子序数:在斑块相同位置上测量ROI的有效原子序数,每个ROI重复测量3次取平均值。
1.3 手术及病理学检测
44例患者均于影像学检查后1~2周内行颈动脉内膜剥脱术,手术由我院具有15年以上工作经验的高年资神经血管外科医生完成,手术过程中尽可能保证斑块的完整性。斑块切片均行HE染色,由我院2位资深病理科医生分别镜下观察分析斑块成分,结果分析不一致时,通过协商达成一致。
1.4 统计学方法
2 结果
2.1 能谱CTA GSI综合分析
49处斑块中,24处表现为纤维斑块能谱曲线(图1),18处表现为脂质斑块能谱曲线(图2),7处表现为斑块内出血能谱曲线(图3)。其中,脂质斑块的能谱曲线近似于皮下脂肪呈弓背向上形态,CT值随着keV的升高而增大;纤维斑块、斑块内出血的能谱曲线近似于肌肉和标准血均呈弓背向下形态,CT值随着keV的升高而减小。3种斑块组织成分的曲线斜率及有效原子序数的差异具有统计学意义(P<0.001),两两比较均有统计学差异(P<0.001),且大小排序为纤维基质>斑块内出血>脂质成分(表1)。
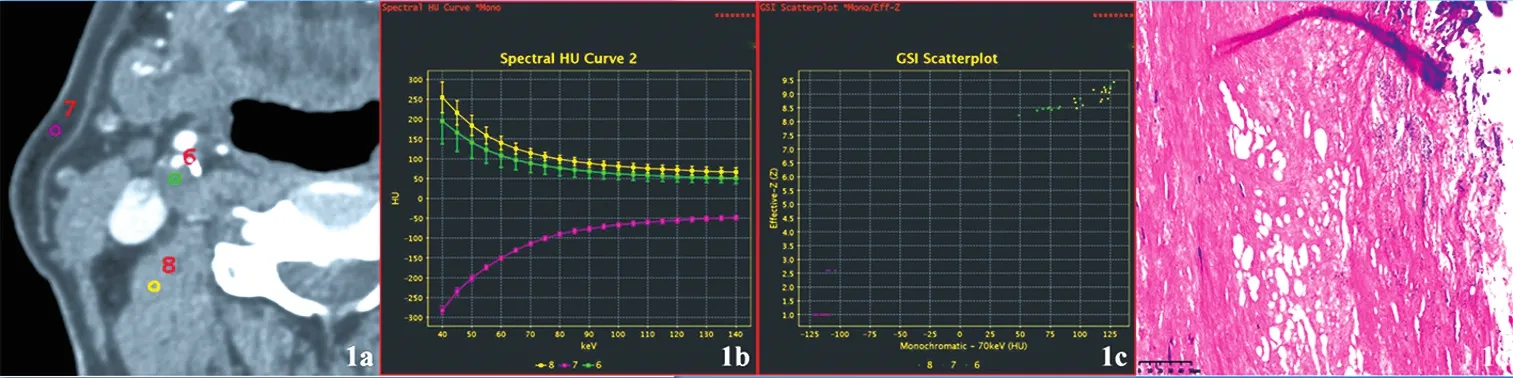
注:a.ROI图:ROI-6为斑块,7为皮下脂肪,8为肌肉;b.能谱曲线图;c.有效原子序数散点图:斑块的能谱曲线及斜率以及有效原子序数与肌肉相似,故判断为纤维斑块;d.病理图(HE染色,×100):右侧颈内动脉纤维斑块,大量纤维组织增生、胶原化,局部黏液变、钙化。
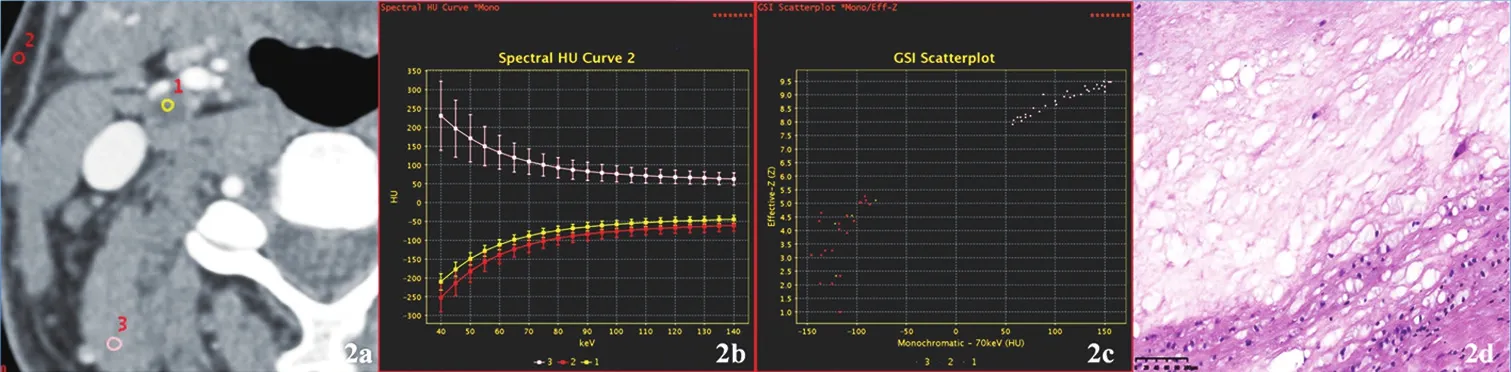
注:a.ROI图:ROI-1为斑块,2为皮下脂肪,3为肌肉;b.能谱曲线图;c.有效原子序数散点图:斑块的能谱曲线及斜率以及有效原子序数与皮下脂肪相似,故判断为脂质斑块;d.病理图(HE染色,×100):右侧颈内动脉脂质斑块,大量脂类坏死组织,伴少许纤维细胞及泡沫细胞增生。
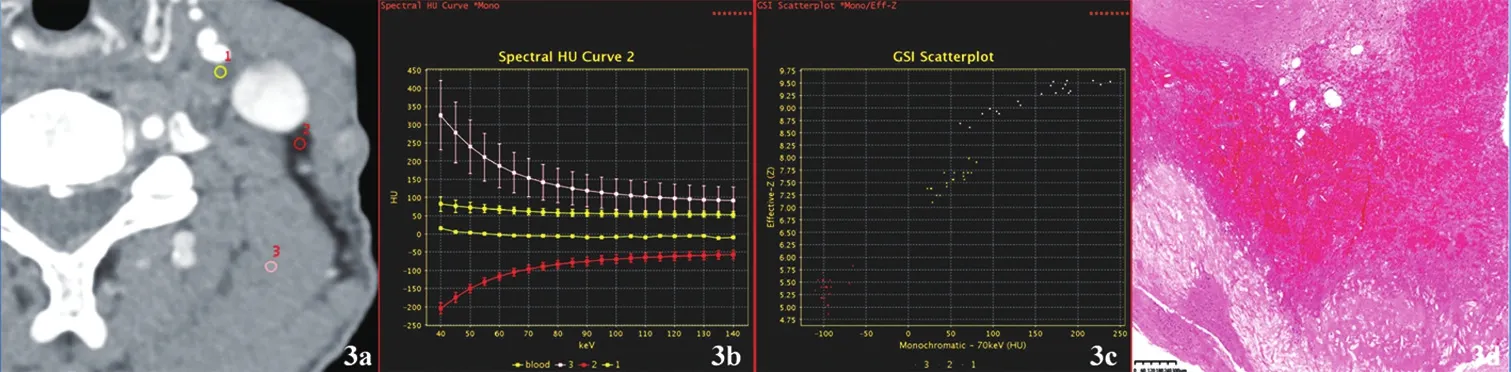
注:a.ROI图:ROI-1为斑块,2为皮下脂肪,3为肌肉;b.能谱曲线图,引入标准血曲线(blood);c.有效原子序数散点图:斑块的能谱曲线及斜率与标准血相似,其有效原子序数值介于脂质板块与纤维斑块有效原子序数值之间,故判断为斑块内出血;d.病理图(HE染色,×100):左侧颈内动脉斑块内出血,管壁纤维化并玻璃样变性、黏液变性、炎细胞浸润,内膜下出血并血栓形成。

表1 斑块组织成分能谱曲线斜率及有效原子序数比较
2.2 能谱CTA结果与病理诊断结果一致性比较
能谱CTA评估结果与病理诊断结果Kappa值分别为0.796、0.824、0.764,2种检查技术对不同斑块成分诊断结果的一致性Kappa值均大于0.75(表2)。49处斑块中,6处斑块的能谱CTA诊断结果与病理结果不相符,包括2处病理结果为纤维斑块,而其能谱曲线表现为脂质斑块;2处病理结果为脂质斑块,而其能谱曲线分别表现为纤维斑块和斑块内出血;2处病理结果为斑块内出血,而其能谱曲线表现为纤维斑块。
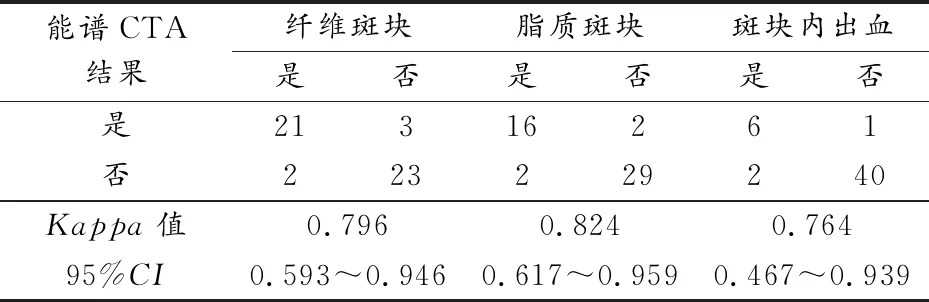
表2 能谱CTA与病理诊断结果一致性比较(n=49)
3 讨论
常规CTA评估颈动脉粥样斑块位置及所致管腔狭窄程度具有重要价值,但其对斑块性质的评估能力有限[9-10]。能谱CTA通过综合分析能谱曲线及其斜率、有效原子序数等多种参数,能够对动脉斑块成分进行准确的术前评估。能谱CTA的能谱曲线代表着斑块的ROI在不同keV下CT值变化的规律,其形态及斜率有助于判断斑块的组成成分;有效原子序数能直接反映ROI内部无机物的有效原子序数,进而通过量化参数反映斑块的组织构成。
本研究通过对比颈动脉斑块与颈部肌肉、脂肪及标准血等物质的能谱曲线及有效原子序数,共检出纤维斑块24处,脂质斑块18处,斑块内出血7处。斑块脂质成分的能谱曲线形态呈弓背向上,其斜率为负值;纤维基质、斑块内出血的能谱曲线形态均呈弓背向下,其斜率为正值,且斑块内出血的能谱曲线比纤维基质能谱曲线明显低平。分析表明3种斑块组织成分的曲线斜率、有效原子序数均存在显著差异,提示根据能谱曲线及斜率、有效原子序数可有效区分斑块中的纤维基质、脂质及斑块内出血等成分。
本研究分析能谱CTA结果与病理结果一致性评估,得出2种检查技术对斑块成分诊断结果的一致性Kappa值均大于0.75,即能谱CTA对颈动脉斑块成分的诊断结果与病理诊断结果具有较高的一致性。然而,49处斑块中仍存在6处斑块的能谱CTA诊断结果与病理结果不相符。2处病理结果为纤维斑块,而其能谱曲线表现为脂质斑块的原因可能为器械外力导致斑块内部分脂质成分发生外溢;2处病理结果为脂质斑块,而其能谱曲线分别表现为纤维斑块和斑块内出血,可能与脂质斑块内局部发生坏死、其边缘炎性细胞浸润或斑块内微量出血有关;2处病理结果为斑块内出血,而其能谱曲线表现为纤维斑块,其原因可能为器械外力导致斑块内新发出血。
在与病理结果对比时,我们还发现能谱CTA分析脂质斑块时,有少数斑块的能谱曲线呈弓背向上,但其有效原子序数表现为纤维斑块,其原因可能是部分脂质斑块发生坏死、边缘炎性细胞浸润或新生滋养血管破裂引起斑块内微量出血,进而导致斑块有效原子序数指标值偏高。
综上所述,能谱CTA能够客观判断颈动脉斑块斑块的主要成分,进而反映出斑块的易损性,对颈动脉斑块的诊断和治疗具有一定的参考价值。此外,本研究存在一定的局限:首先,本研究的样本量相对较少,结果可能存在偏倚;其次,本研究ROI的放置位置与病理切片所对应的位置可能存在一定偏差,影响数据的准确性;最后,由于本研究未评估斑块中各成分所占的比例,仅分析了斑块的主要成分。
利益冲突:所有作者均申明不存在利益冲突。

