基于诱导突变牡蛎共生真菌的代谢产物*
梁梦迪 尹楠楠 李藤藤 王 月 张 震 王焕南
(济宁医学院药学院,日照 276826)
海洋微生物作为生物活性代谢物最丰富的来源之一,是先导化合物的重要源泉[1-3]。海洋真菌产生的次级代谢产物分子质量相对较小,但活性优良,多数化合物具有抗肿瘤、抗病毒、抗AD、免疫抑制和酶抑制等作用[4-6]。微生物变异是生物进化的基础推动力[7],然而在人工培养的单一稳定环境下,微生物大部分基因簇通常处于沉默状态[8],很多基因未能完全表达,而自然选育耗时长,工作量大且效率低。人工诱变育种可采用加入诱变剂、紫外照射、微波等加速微生物突变,从而在相对较短的时间内获得有实用价值的突变体,改善菌株特性[9-11]。本研究基于前期从牡蛎中分离得到的真菌Alternariaalternata,通过化学、物理以及复合诱导调控等方法,以期激活真菌的沉默基因簇,充分发掘微生物次级代谢的潜力,为获得大量新型结构活性天然产物提供信息支持。
1 材料和试剂
1.1 主要试剂和仪器
葡萄糖、麦芽糖、乙酸乙酯(国药集团化学试剂有限公司);UN1Q-10柱式真菌基因组DNA抽提试剂盒(上海生工公司);琼脂粉(青岛海博生物公司);乙酰胆碱酯酶(苍蝇头部)、碘代硫代乙酰胆碱、DTNB、胰蛋白胨、DPPH、磷酸二氢钠、硫酸二乙酯(DES)、抗坏血酸等购自上海源叶生物科技有限公司。
恒温振荡培养箱(天津市莱玻特瑞公司);恒温恒湿培养箱(上海精宏公司);电泳仪(北京六一公司);离心机(赛默飞公司);超净工作台(苏州安泰公司);立式蒸汽灭菌器(上海博讯公司);EYELA旋转蒸发仪(上海爱朗公司);高效液相色谱仪(岛津公司);PCR扩增仪(美国伯乐公司);全功能酶标仪(美国伯腾公司)。
1.2 方法
1.2.1菌种来源 本实验室前期从日照海域野生牡蛎中分离得到的真菌,经菌种鉴定为链格孢菌Alternariaalternata,命名为YS-4。金黄色葡萄球菌(S.aureus)和大肠杆菌(E.coli)-80℃保存于药学实验中心。
1.2.2菌株诱变 1)DES诱变。适量YS-4菌体接种至PDB培养基中,恒温振荡培养箱中培养3~7d,得到菌悬液。取适量菌悬液至5mL离心管中,充分研磨,测定其吸光度,用PDB培养基稀释,进行菌液浓度的预筛选。取700μL菌悬液置1.5mL离心管中,分别加入0、1、2、4、6、8、10μL DES,DMSO补至1000μL,混匀,放置4℃,按表1进行诱变剂浓度的预筛选,12h和24h后分别于取菌悬液涂布、培养,连续观察15d,及时分离出新的菌株[12]。

表1 化学诱变剂(DES)浓度
2)紫外诱变。菌悬液制备过程同1),取菌悬液置PDA培养基,涂布,28℃培养箱培养24h,取出用20W紫外灯照射,照射距离20cm,照射时间分别为0、3、5、10、15、20、40、60、120、180、360s,密封放置在恒温培养箱中培养,连续观察15d,及时分离出新的菌株[13]。
3)微波诱变。菌悬液制备过程同1),取1mL菌悬液加入1.5mL EP管中,将EP管放置在冷却后烧杯中,用微波分别处理0、10、20、30、40、50、60s,密封、4℃冷藏12h涂布培养,连续观察15d,及时分离出新的菌株[14-15]。
4)复合诱变。0.4% DES处理24h后,取200μL菌悬液置PDA培养基涂布培养12h,紫外照射60s,重新放至恒温培养箱中培养,连续观察15d,及时分离出新的菌株。
1.2.3稳定性考察 挑取诱变菌株的菌丝(母代)适量,在新PDA培养基上划线,培养箱中培养7~15d,同种方法连续10代接种培养,观察突变株的生长形态,以确定突变菌株的遗传稳定性。
1.2.4菌种鉴定 将诱变菌株接种至PDB培养基上,摇床中培养3~7d,吸取菌体至1.5mL EP管中,离心,弃上清,将菌体于冰浴中充分研磨,根据UNIQ-10柱式真菌基因组DNA抽提试剂盒提取DNA,基于18S基因序列将提取得到的DNA,采用真菌通用引物ITS4 (5'-TCCTCCGCTTATTGATATGC-3')和ITS5 (5'-GGAAGTAAAAGTC GTAACAAGG-3')进行PCR扩增,PCR反应体系(1μL上、下游引物+10μL Mix+3μL DNA+6μL dd H2O),PCR产物经1%琼脂糖凝胶电泳纯化回收后,送至苏州金唯智公司测序。基因序列经Genbank数据库Blast对比,采用MEGA7.0软件的邻接法构建系统发育树[16]。
1.2.5诱变菌株代谢产物的提取 挑取适量诱变菌株的菌丝转移至500mL PDB培养基中,培养10~15d。将发酵液经离心、萃取得乙酸乙酯层,浓缩得粗浸膏,备用。
1.2.6色谱条件 采用Wondasil C18 Superb(250mm×4.6mm,5μm)色谱柱,以水(A)-甲醇(B)为流动相进行梯度洗脱(0~40min,5%B~100%B;40~50min,100%B;50~60min,100%B~5%B),流速为0.8mL/min,检测波长为254nm,柱温35℃,进样量为10μL。
1.2.7生物活性测定 1)ACh E抑制活性测定。参照表2,配制总体积为700μL的反应体系,37℃水浴260s,取200μL转移至96孔板中,平行3个复孔。412nm处测定其OD值,按公式计算其抑制率,盐酸多奈哌齐(Donepezil)为阳性对照。抑制率%=[(AⅡ-AⅠ)-(AⅣ-AⅢ)]/(AⅡ-AⅠ)×100%。

表2 Ellman法各组加样量(μL)
2)体外抗氧化活性测定。参照表3加样反应,517nm处测定其OD值,按下列公式计算其清除率,VC为阳性对照。清除率(%)=[A阴性-(A样品-A本底)]/A阴性。
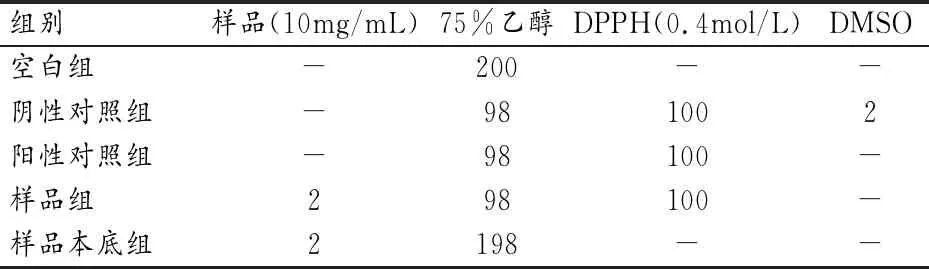
表3 DPPH法各组加样量(μL)
3)抗菌活性测定。将100μL指示菌的菌悬液均匀涂布在LB培养基上,培养12~16h,将培养皿分为四区并放置滤纸片,每个区域分别加入诱变菌株浸膏溶液和YS-4菌株的浸膏溶液(10mg/mL),DMSO为阴性对照,利福平和氯霉素为阳性对照,恒温培养箱中倒置培养,分别在12、24、36、48、72h测量其抑菌圈大小。
1.2.8数据的处理与分析 采用GraphPad Prism 8.0软件进行统计分析;采用MAGE 7.0中邻接法构建系统发育树。
2 结果
2.1 YS-4真菌及其突变菌株形态图
野生菌株YS-4经过DES、紫外、微波以及复合诱变等方法分离得到48种菌株,经过稳定性考察后得到6种具有稳定遗传特性的突变菌株,其形态图见图1。
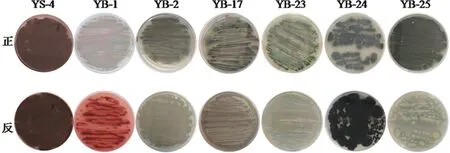
图1 YS-4及其诱变菌株的形态图
2.2 突变菌株的菌种鉴定及系统发育树的构建
基于18S基因序列,采用邻接法构建系统发育树,见图2。野生菌株经诱变得到稳定遗传的菌株分别为聚多曲霉(Aspergillussydowii)、烟曲霉(Aspergillusfumigatus)、皮落青霉(Penicilliumcrustosum)、指状拟青霉(paecilomycesdactylethromorphus)、糙刺篮状菌(Talaromycessp)和青霉菌(Penicilliumsp)。
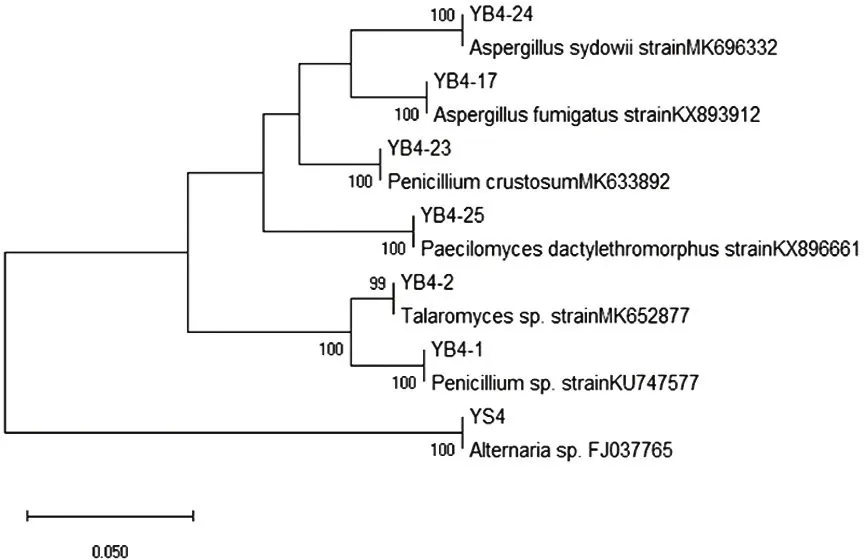
图2 诱变菌株系统发育树
2.3 突变菌株代谢产物的HPLC分析
与野生菌株YS-4粗提物的HPLC图谱相比,在波长254nm下,突变菌株YB-1和YB-17不同保留时间出现明显新峰,说明其突变菌株出现了新的次级代谢产物。见图3。

图3 诱变菌株代谢产物的HPLC分析
2.4 突变菌株代谢产物的生物活性
2.4.1乙酰胆碱酯酶的抑制活性 采用Ellman法研究菌株代谢产物对ACh E的抑制活性。样品终浓度为200μg/μL时,野生真菌YS-4的粗提物对ACh E活性抑制率为45.22%,而突变菌株YB-1、YB-17 和YB-23对ACh E抑制活性增强,其抑制率分别为55.86%、60.31%和49.67%, Donepezil为阳性对照,抑制率为75.50%(50μg/μL)。见图4。
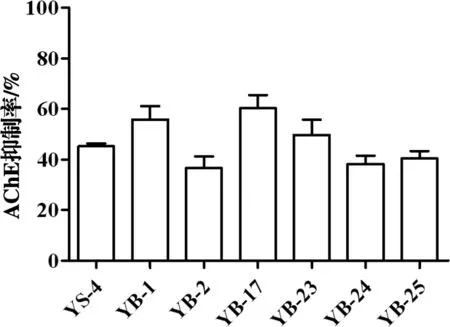
图4 YS-4及诱变菌株代谢产物对AChE活性抑制作用
2.4.2抗氧化活性 采用DPPH自由基清除法研究菌株代谢产物的体外抗氧化活性。与YS-4相比(清除率为15.62%),浓度为100μg/μL时,突变菌株YB-1、YB-17、YB-25对DPPH自由基的清除能力均有明显提高,清除率分别为41.72%、36.85%和23.59%。见图5。

图5 YS-4及诱变菌株的代谢产物对DPPH自由基清除作用
2.4.3抗菌活性 与YS-4相比(抑菌圈直径为12mm),YB-17、YB-23和YB-24对金黄色葡萄球菌的抑制作用增强,其粗提物(10mg/mL)抑菌圈直径分别为20、16和19mm,所有菌株对大肠杆菌E.coli无抑制作用。见表4。
表4 不同真菌对受试菌种的抑菌圈直径
3 结论
通过对野生牡蛎内生真菌YS-4诱变育种,得到6株具有稳定遗传特性的突变菌株,分别为聚多曲霉(Aspergillussydowii),烟曲霉(Aspergillusfumigatus),皮落青霉(Penicilliumcrustosum),指状拟青霉(Paecilomycesdactylethromorphus),糙刺篮状菌(Talaromycessp)和青霉菌(Penicilliumsp)。HPLC图谱分析可知,突变菌株YB-1和YB-17的代谢产物更为丰富;生物活性结果表明,突变菌株YB-1、YB-17和YB-23对AchE具有良好的抑制作用,抑制率分别为55.86%、60.31%和49.67%;YB-1、YB-17和YB-25对DPPH自由基的清除能力较强,清除率分别达41.72%、36.85%和23.59%;YB-17、YB-23和YB-24对金黄色葡萄球菌具有一定的抑制作用。本研究通过诱变方法激活牡蛎内生真菌的沉默基因簇,得到次级代谢产物具有良好生物活性的目标菌株,为进一步活性化合物的分离奠定基础。
利益冲突:所有作者均申明不存在利益冲突。

