基于Janus激酶2/信号转导和转录激活因子3信号通路探讨参苓白术散对溃疡性结肠炎模型大鼠炎症抑制作用研究
仝建松
(辽宁中医药大学附属第四医院脾胃科,辽宁 沈阳 110000)
溃疡性结肠炎(Ulcerative colitis,UC)是一种原因尚未明确的以腹痛、腹泻、肛门坠痛、黏液脓血便等为主要症状的慢性非特异性直肠、结肠炎症性疾病[1]。溃疡性结肠炎在中青年人群中呈现多发状态,我国虽处于发病率较低的亚洲地区,但发病率也达到了11.6/10000左右,并且有显著增高的趋势[2-3]。溃疡性结肠炎具有反复发作、迁延难愈的特点,不仅可能引起肠穿孔、大出血等,还可能发生癌变,故被称为危害人类健康的顽疾之一[4],受到医学界的广泛关注。目前,现代医学主要采用水杨酸类、糖皮质激素等药物治疗该病,很容易出现停药后复发、药物性肝肾损伤、单一药物疗效差等问题,治疗效果不甚理想。而中医药在溃疡性结肠炎的治疗中有其独特优势,有学者[5-6]研究显示,参苓白术散治疗溃疡性结肠炎的疗效和安全性均较西药为好,但其作用机制仍未完全明确。本次研究即主要基于Janus激酶2(Janus kinase 2,JAK2)/信号转导和转录激活因子3(Signal transduction and transcription activator 3,STAT3)信号通路,探讨参苓白术散对溃疡性结肠炎的影响。
1 材料与方法
1.1 材 料
1.1.1 研究对象:SD健康大鼠65只,均为SPF级雄性,体重210~240 g,平均(227.44±9.37)g,购自中山大学实验动物中心,许可证号:SCXK(粤)2016-0029。分笼饲养1周,室内温度(22±2)℃,湿度(50±5)%,光照12 h,安静、通风,饲料为标准颗粒饲料,饮水为无菌过滤水,大鼠在笼内活动不受限制。
1.1.2 主要药品与试剂:弗氏完全佐剂,规格:每瓶10 ml,购自上海研卉生物科技有限公司,使用时与等量纯种家兔结肠黏膜蛋白混合配制成抗原乳化液;5% 2,4,6-三硝基苯磺酸(TNBS),规格:每瓶10 ml,购自合肥博美生物科技有限责任公司,用蒸馏水溶解并配制成浓度为3.5%的DSS溶液,现用现配。参苓白术散药物组成:人参、炒白术、白茯苓、山药各15 g,甘草、薏苡仁、莲子各9 g,白扁豆12 g,砂仁、桔梗、陈皮各6 g,购自黑龙江中医药大学附属医院药房,用适量蒸馏水对药物进行浸泡,时间为30 min,然后煎药机煎煮2次,收集药液制为含生药1.2、2.4 g/ml的参苓白术散药液,4 ℃保存备用。美沙拉嗪缓释颗粒,规格:每袋0.5 g,批号:20180706,上海爱的发制药有限公司生产,采用蒸馏水溶解并配成浓度为3 mg/ml的美沙拉嗪溶液,现用现配。10%水合氯醛,购自广州沛瑜生物制品有限公司;大鼠白细胞介素-6(Interleukin-6,IL-6)、白细胞介素-10(Interleukin-10,IL-10)酶免测定(Enzyme linked immunosorbent assay,ELISA)试剂盒、苏木素-伊红(Haematoxylin-eosin,HE)染色试剂盒,购自合肥博美生物科技有限责任公司;JAK2、STAT3免疫组化试剂盒,购自上海雅吉生物科技有限公司;兔抗大鼠JAK2、STAT3、肌动蛋白(β-actin)抗体,购自武汉益普生物科技有限公司;辣根过氧化物酶(Horseradish peroxidase,HRP)标记的山羊抗兔免疫球蛋白G(Immunoglobulin G,IgG),购自北京康润诚业生物科技有限公司;二喹啉甲酸(Bicinchoninic acid,BCA)蛋白质检测试剂盒、PBS缓冲液、TBST缓冲液、十二烷基硫酸钠-聚丙烯酰胺凝胶(Sodium dodecyl sulphate polyacrylamide gel electrophoresis,SDS-PAGE)配制试剂盒、超敏ECL化学发光检测试剂盒,购自北京百奥莱博科技有限公司。
1.1.3 主要仪器设备:ROTOFIX32A型离心机,德国Hettich公司产品;E200型光学显微镜,日本NIKON公司产品;Freedom EVOlyzer型全自动酶免工作站,瑞士TECAN公司产品;Compact L型电泳仪,德国Biometra公司产品;Trans-Blot SD型半干转印槽,美国BIO-RAD公司产品;C150型凝胶成像系统,美国Azure Biosystems产品。
1.2 方 法
1.2.1 造模及实验方法:采用抓阄法将大鼠分为对照组12只和造模组53只。参照文献[7],造模组大鼠于第1天及第15天避光给予抗原乳化液(含抗原8 mg)背部、腹股沟皮下注射,对照组于相同时间给予等量无菌0.9%氯化钠溶液背部、腹股沟皮下注射;第16 天,所有大鼠禁食不禁水24 h,腹腔注射10%水合氯醛300 mg/kg麻醉大鼠,肛门涂抹甘油后缓慢插入硅胶管(直径2 mm、长15 cm),深度为8 cm左右,造模组向直肠内注入5%TNBS 100 mg/kg及50%乙醇0.25 ml,对照组注入等体积无菌0.9%氯化钠溶液,然后分别注入空气0.3 ml,夹闭肛门,倒立位悬挂大鼠10 min以使药液在肠道内分布充分,待大鼠自然清醒后放回笼内继续饲养;15 d后,造模组大鼠出现稀便、肛周污秽及便血症状,随机抽选造模组5只大鼠,采集结肠组织标本进行病理学检查,以确认溃疡性结肠炎模型建立成功。
造模成功后,将剩余造模组大鼠随机分为模型组、阳性对照组和参苓白术散低、高浓度组,各12只。模型组及对照组分别灌胃给予蒸馏水10 ml/kg,1次/d;阳性对照组灌胃给予3 mg/ml美沙拉嗪溶液10 ml/kg,1次/d;参苓白术散低、高浓度组分别灌胃给予1.2、2.4 g/ml参苓白术散药液10 ml/kg,1次/d。各组连续干预3周。
1.2.2 标本采集与处理:末次干预完成,禁食不禁水12 h,腹腔注射10%水合氯醛300 mg/kg,麻醉完全后,经腹主动脉采血5 ml,不抗凝,静置待其凝固,3000 r/min离心15 min,收集血清-80 ℃冻存;完整截取结肠,采用预冷0.9%氯化钠溶液冲洗干净后,进行肉眼观察,评估结肠黏膜损伤指数(CMDI)评分;之后取长度为1 cm的结肠组织,固定于4%多聚甲醛溶液内24 h,经梯度浓度酒精脱水、二甲苯透明、石蜡包埋,制成4 μm切片;其他结肠组织采用液氮速冻处理,-80 ℃保存。
1.2.3 CMDI评分标准[8]:结肠形态:无黏连,记0分;轻度黏连,记1分;重度黏连,记2分。结肠黏膜:无溃疡形成及炎症病灶,记0分;结肠黏膜局部充血,但未形成溃疡,记1分;有1处溃疡形成,但无充血、无肠壁增厚,记2分;有1处溃疡形成且伴有炎症,记3分;有2处以上溃疡和/或炎症形成,1 cm<病灶≤2 cm,记5分;2 cm<溃疡和/或炎症病灶≤3 cm,记6分;3 cm<溃疡和/或炎症病灶≤4 cm,记7分;4 cm<溃疡和/或炎症病灶≤5 cm,记8分。
1.2.4 HE染色法观察大鼠结肠组织病理变化:取石蜡切片,60 ℃烤片2 h,常规脱蜡、水化,置于苏木素染液内,5 min后置于1%盐酸乙醇内5 s进行分化,然后置于超纯水内15 min,再采用伊红染液处理2 min复染,经蒸馏水冲洗充分除去染液之后,常规进行脱水、透明、封片。
采用显微镜观察染色结果,每张切片选非重叠视野5个,采集图像,然后进行结肠组织学损伤指数(TDI)评分,并计算平均值。TDI评分标准[9]:病变深度:无病变,记0分;至黏膜层,记1分;至黏膜下层,记2分;穿透黏膜全层,记3分。炎症程度:无炎症,记0分;轻度炎症,记1分;中度炎症,记2分;重度炎症,记3分。病变范围:无病变,记0分;1%~25%,记1分;26%~50%,记2分;51%~75%,记3分;>75%,记4分。隐窝损伤:无损伤,记0分;损伤1/3,记1分;损伤2/3,记2分;全部损伤,但黏膜上皮表面完整,记3分;全部损伤,且黏膜上皮表面有缺损,记4分。
1.2.5 ELISA法测定血清炎症因子水平:取血清,恢复至室温,采用Freedom EVOlyzer型全自动酶免工作站测定血清IL-6、IL-10水平,实验操作按照ELISA试剂盒说明书进行。
1.2.6 免疫组化法测定大鼠结肠组织JAK2、STAT3表达水平:取石蜡切片,烤片、脱蜡、水化步骤同前,之后置于3%过氧化氢溶液内15 min以灭活内源性酶,采用0.01 mol/L枸橼酸钠溶液煮沸对切片进行抗原修复15 min,PBS冲洗5 min×3次,按照免疫组化试剂盒说明书中的步骤,将切片采用封闭液封闭20 min;室温下,分别采用JAK2、STAT3一抗工作液(1∶500稀释)孵育切片3 h,PBS冲洗3 min×3次;室温下采用二抗工作液(1∶1000稀释)孵育切片30 min,PBS冲洗3 min×3次;之后采用二氨基联苯胺使切片显色10 min,蒸馏水冲洗终止显色,苏木素溶液复染,最后常规进行脱水、透明、封片。
采用显微镜观察染色结果,胞内存在棕黄色颗粒的属于阳性细胞;每张切片选非重叠视野5个,采集图像,然后用图像分析软件 Image-Pro Plus 6.0分析JAK2、STAT3表达的光密度值(IOD)。
1.2.7 免疫蛋白印迹(Western blot)法测定大鼠结肠组织JAK2、STAT3蛋白表达水平:取冻存组织剪碎,滴加组织蛋白裂解液(含蛋白酶抑制剂)200 μl,置冰上充分匀浆、裂解;然后4 ℃、12000 g离心20 min,上清液即为蛋白样本;用BCA蛋白质检测试剂盒测定蛋白样本总蛋白含量,-20 ℃保存;将制好的SDS-PAGE凝胶(5%浓缩胶+10%分离胶)固定在电泳仪上,用微量上样器上样后开始进行电泳,电泳条件为浓缩胶80 V、分离胶100 V,至蛋白条带刚跑出时停止;将蛋白条带采用半干转印槽转至硝酸纤维素(NC)膜;NC膜置于5%封闭液内,室温封闭1 h,取出用TBST洗涤5 min×3次;之后置于JAK2、STAT3、β-actin一抗(1∶500稀释)中,4 ℃过夜;然后用TBST洗涤5 min×3次;NC膜置于1∶1000稀释的山羊抗兔二抗内,室温反应1 h,取出用TBST洗5 min×3次;最后用ECL试剂盒使蛋白条带显影、定影。
采用C150型凝胶成像系统扫描蛋白条带、采集图像,分析JAK2、STAT3、β-actin蛋白条带的灰度值,分别对JAK2、STAT3灰度值与β-actin灰度值的比值进行计算。
1.3 统计学方法 采用SPSS 22.0统计学软件进行分析。符合正态分布的计量资料以均数±标准差表示,多组间比较用单因素方差分析;组间多重比较用LSD-t检验,P<0.05表示差异具有统计学意义。
2 结 果
2.1 各组大鼠CMDI评分比较 见表1。与对照组比较,模型组大鼠CMDI评分明显升高(P<0.05)。各给药组大鼠CMDI评分均低于模型组,且参苓白术散低浓度组>阳性对照组>参苓白术散高浓度组,差异具有统计学意义(P<0.05)。

表1 各组大鼠CMDI评分比较(分)
2.2 各组大鼠结肠组织病理学观察结果 HE染色结果显示,对照组结肠黏膜正常,结构完整,未见溃疡或炎症细胞浸润,腺体无异常;模型组大鼠结肠黏膜有溃疡形成,局部脱落、坏死,黏膜下层存在大量炎性细胞浸润;参苓白术散低浓度组结肠黏膜溃疡情况较模型组有所减轻,炎性细胞浸润现象好转;参苓白术散高浓度组结肠黏膜基本完整,仅有少量炎性细胞浸润;阳性对照组结肠黏膜大部分修复,炎性细胞浸润情况明显减轻(图1)。
模型组大鼠结肠组织TDI评分高于对照组(P<0.05)。与模型组比较,各给药组大鼠结肠组织TDI评分较低,且参苓白术散低浓度组>阳性对照组>参苓白术散高浓度组(P<0.05)。见表2。

表2 各组大鼠结肠组织TDI评分比较(分)
2.3 各组大鼠血清IL-6、IL-10水平比较 见表3。模型组大鼠血清IL-6水平高于对照组,IL-10水平低于对照组(均P<0.05)。参苓白术散低、高浓度组和阳性对照组大鼠血清IL-6水平均低于模型组,且参苓白术散低浓度组>阳性对照组>参苓白术散高浓度组(P<0.05)。参苓白术散低、高浓度组和阳性对照组大鼠血清IL-10水平均高于模型组,且参苓白术散低浓度组<阳性对照组<参苓白术散高浓度组(P<0.05)。

表3 各组大鼠血清IL-6、IL-10水平比较(pg/ml)
2.4 各组大鼠结肠组织JAK2、STAT3表达水平比较 见表4(图2、3)。各组大鼠结肠组织JAK2、STAT3表达水平高于对照组(均P<0.05)。参苓白术散低、中、高浓度组和阳性对照组大鼠结肠组织JAK2、STAT3表达水平均低于模型组,其中参苓白术散低浓度组>阳性对照组>参苓白术散高浓度组(P<0.05)。
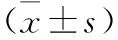
表4 各组大鼠结肠组织JAK2、STAT3表达水平比较
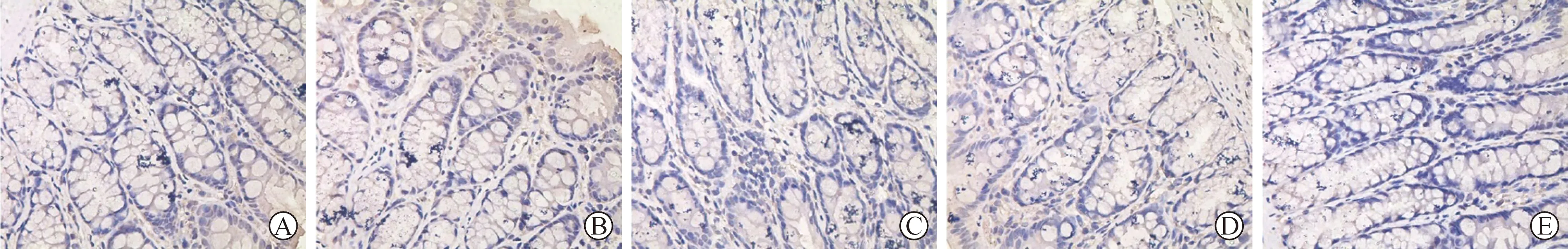
A:对照组;B:模型组;C:参苓白术散低浓度组;D:参苓白术散高浓度组;E:阳性对照组

A:对照组;B:模型组;C:参苓白术散低浓度组;D:参苓白术散高浓度组;E:阳性对照组
2.5 各组大鼠结肠组织JAK2、STAT3蛋白表达水平比较 见表5(图4)。各组大鼠结肠组织JAK2、STAT3蛋白表达水平高于对照组(均P<0.05)。参苓白术散低、中、高浓度组和阳性对照组大鼠结肠组织JAK2、STAT3蛋白表达水平均低于模型组,其中参苓白术散低浓度组>参苓白术散高浓度组>阳性对照组(P<0.05)。

表5 各组大鼠结肠组织JAK2、STAT3蛋白表达水平比较
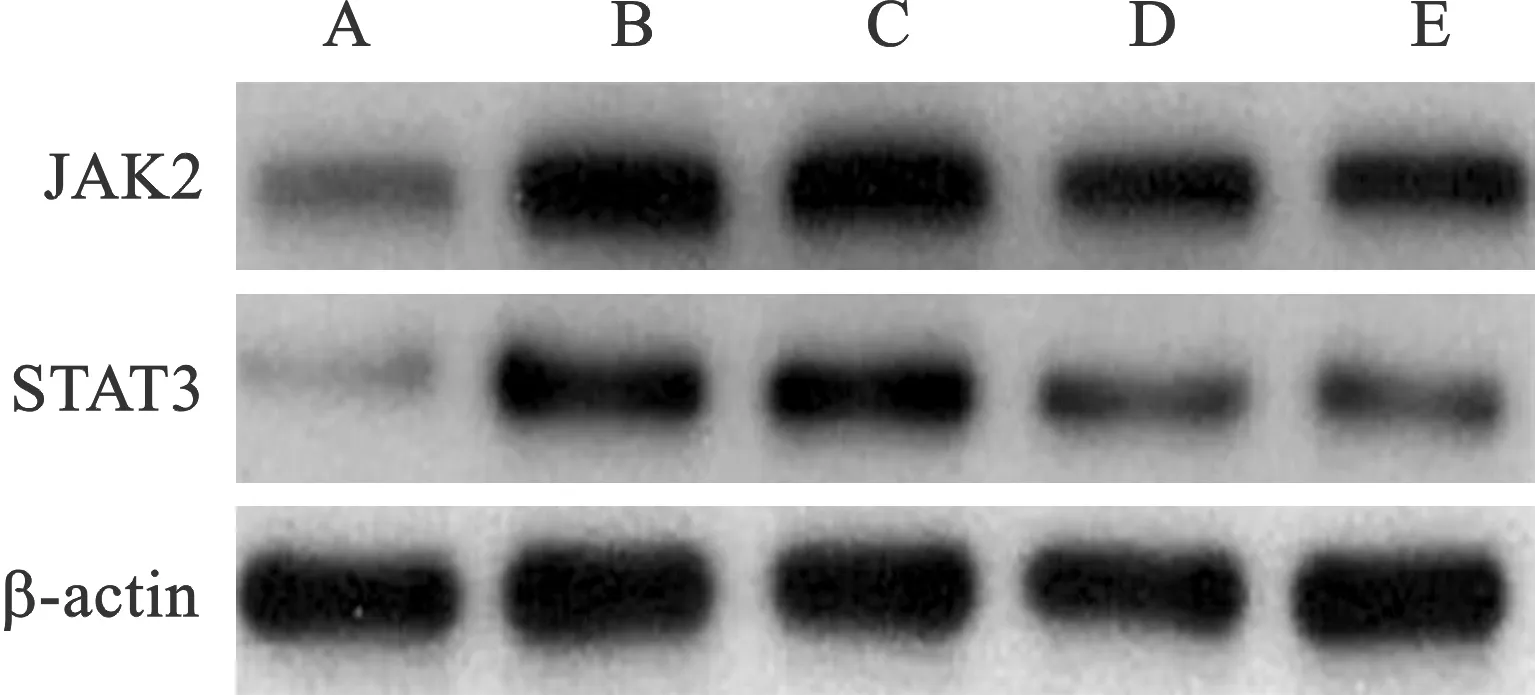
A:对照组;B:模型组;C:参苓白术散低浓度组;D:参苓白术散高浓度组;E:阳性对照组
3 讨 论
中医认为,溃疡性结肠炎(UC)属于“肠癖”“久泻”“肠风下血”等范畴,病位在大肠,与肝、脾、肾密切相关,病机主要为脾虚湿困、湿浊不化,饮食不节、先天禀赋不足、情志失调等可损伤脾气,脾虚无以运化水湿,湿浊困脾,水湿下注于肠,壅滞肠络,气血不行,久之血败肉腐,发为本病,治疗上应以健脾化湿为要。参苓白术散出自《太平惠民和剂局方》,为治疗脾虚湿盛证的经典方剂,方中人参性温平,味甘微苦,有补气固脱之效,白术性温,味苦甘,能健脾益气,燥湿利水,茯苓性平,味甘淡,可健脾渗湿宁心,三者长于益气健脾、渗湿利水,共为君药;山药可补脾益肾,莲子可补脾止泻,既能助君药健脾益气,又善止泻,白扁豆、薏苡仁均能助君药健脾化湿,利尿消肿,四者共为臣药;佐以砂仁化湿开胃、温脾止泻;再加上桔梗宣肺利气,通调水道,引药上行,陈皮理气健脾燥湿,甘草益气补脾,调和诸药,共为佐使;全方配伍得当,补攻兼施,共奏益气健脾,渗湿祛浊之效,使脾气充盛,湿邪尽化,诸症皆消。现代药理研究发现,人参中的活性成分人参皂苷,能够通过抗氧化、减少炎性介质释放等途径抑制炎症反应,还能加速肠黏膜溃疡修复[10];薏苡仁也能通过调节促炎因子和抑炎因子释放来治疗溃疡性结肠炎[11]。可见,参苓白术散在治疗溃疡性结肠炎方面有一定的药理基础。多项动物实验研究也显示,参苓白术散能够通过抑制细胞间黏附分子-1、血管细胞黏附分子-1表达、上调结肠平滑肌瞬时受体电位阳离子通道1表达等多种不同途径控制溃疡性结肠炎病情进展[12-13]。
在本次研究中,我们采用免疫复合物家兔结肠黏膜蛋白及TNBS乙醇溶液建立溃疡性结肠炎大鼠模型,首先诱发全身异常免疫应答,然后TNBS使肠黏膜屏障局部破坏,并结合结肠组织蛋白形成完全抗原,导致结肠局部免疫炎症损伤,该造模方式同时涉及到了免疫调节异常、结肠黏膜屏障功能减退这两个常见致病因素,而且维持时间长,是复制溃疡性结肠炎的理想方式[14-16]。本次造模后,模型组大鼠结肠黏膜有溃疡形成,局部脱落、坏死,黏膜下层存在大量炎性细胞浸润,组织病理变化与人类溃疡性结肠炎相似,表明造模成功。各组采用不同药物治疗后,结果发现,与模型组比较,各给药组大鼠结肠组织CMDI评分、TDI评分均较低,且参苓白术散低浓度组>阳性对照组>参苓白术散高浓度组,表明高浓度参苓白术散既可促进溃疡性结肠炎大鼠病理损伤修复及溃疡愈合,起到黏膜保护作用,组织HE染色病理观察结果进一步证实了这一点。
关于参苓白术散治疗溃疡性结肠炎的作用机制,此次我们从JAK/STAT3信号通路出发进行探讨。溃疡性结肠炎是一种炎症反应,在其发生发展过程中有众多的炎性细胞因子参与,IL-6和IL-10均为其中常见的类型。IL-6为促炎性细胞因子,能通过增加内皮细胞通透性、加速巨噬细胞及中性粒细胞增殖、浸润等来介导溃疡性结肠炎发生,IL-10则为抑炎因子,可以通过抑制中性粒细胞、T淋巴细胞等的功能,维持肠黏膜内环境稳定来抑制溃疡性结肠炎发生。研究认为,抑制IL-6类细胞因子、增加IL-10类细胞因子生成,对于溃疡性结肠炎的治疗有积极意义[17-18]。此外,IL-6还是JAK/STAT3信号通路的重要启动因子,IL-6与相应受体结合后,能够激活与结合体耦联的JAK激酶,进而招募STAT3蛋白并引起其蛋白酪氨酸残基、丝氨酸残基磷酸化,向细胞核内转移,调控靶基因表达,促进相关促炎性细胞因子合成、分泌,诱发并加重炎症反应。研究称JAK/STAT3信号通路的激活促进了炎症性肠病和结肠炎的进展[19-20]。研究认为[21-22],通过不同环节抑制或阻断JAK/STAT3信号通路能干预炎症性肠病。本次与模型组比较,各给药组大鼠血清IL-6水平较低,IL-10水平较高,免疫组化及Western blot检测均显示结肠组织JAK、STAT3表达水平较低,且参苓白术散高浓度组与模型组差异最为明显,提示高浓度的参苓白术散可以有效抑制促炎因子IL-6释放,促进抑炎因子IL-10分泌,下调JAK、STAT3蛋白活性,这可能是参苓白术散减轻溃疡性结肠炎炎症反应、控制病情进展的作用机制之一。

