弗氏盐法脱除制革废水中氯离子影响因素分析
姚庆达
(福建省皮革绿色设计与制造重点实验室兴业皮革科技股份有限公司,福建 晋江 362271)
0 引言
氯离子是一种典型的腐蚀性离子,与水中的溶解氧作用会对人体、环境、设备产生较大的影响[1]。通常情况下,淡水湖、河流、自来水等水体中氯离子含量不会超过200 ppm,咸水湖、海水中则约为2.0×104ppm,但是工业废水如医药、纺织、印染、造纸、皮革、电镀等综合废水中,氯离子含量最高可达到1.5×105ppm[2]。张跃等[3]对氯离子对混凝土的侵蚀情况进行了研究,结果表明,随着水灰比的增大,氯离子的扩散系数随之增大,从而加剧了氯离子的侵蚀作用。此外混凝土饱和度的增大也会提高氯离子的扩散速度,从而降低混凝土的使用寿命。李朝阳等[4]发现当氯离子含量超过1.0×104ppm时,活性污泥变得松散,镜检时微生物大量减少甚至死亡,同时曝气池溶解氧值突然暴涨,二沉池悬浮物呈云浪状上浮,甚至导致微生物系统瘫痪。Sun等[5]研究了氯离子在动植物、人体的积累问题,发现在生长和发育过程中摄取的高氯离子含量的食物、水均会导致氯离子的累计,超过一定的耐受度时,会导致中毒,从而影响健康。因此,高氯废水若不经处理直排环境,将会影响动植物生长,影响人体健康,破坏生态环境平衡。
目前国内外去除氯离子的方法有很多,其中离子交换法、电化学法、化学沉淀法研究最为广泛。离子交换技术是包括了离子交换树脂法、反渗透膜法、层状双金属氢氧化物法等。其中层状双金属氢氧化物是一种由二价、三价金属离子组成的层状结构,而阴离子位于层间的特殊结构黏土,具有优异的离子交换特性,层状双金属氢氧化物反应简便,受温度影响低,近年来得到了广泛研究[6]。电化学法则是电解法、电渗析法、电吸附法的统称,电化学法对电极材料要求极高,投入成本较大[7]。化学沉淀法是通过氯离子与金属离子反应生成难溶性氯化物的原理进行分离氯离子,化学沉淀法包括氯化银沉淀法、氯化亚铜沉淀法、锌-铜结合法、弗氏盐法等[8]。其中,超高石灰铝法又叫氯铝酸钙法,该法是在含氯废水中加入钙盐和铝酸盐从而生成难溶性的氯铝酸钙沉淀,氯铝酸钙沉淀也称为水铝钙石,从而达到除去水体中氯离子的目的[9]。目前,拟出台的新的环境保护政策更是加大了对废水中氯离子含量的管控。据悉,新标准中氯离子含量的限值有可能从6000 ppm下降至3000 ppm,部分地区甚至提出了制革废水中氯离子含量不得超过300 ppm。弗氏盐法原料简单易得,脱氯效果较为显著,且对环保设备的改造较小,综合比较多种方法,弗氏盐法极有可能是制革行业突破氯离子这一“紧箍咒”的法宝。为了进一步探究弗氏盐法脱除氯离子在制革工业应用的可行性,综合考虑处理效果、环境友好、经济实用等方面,选用CaO和NaAlO2作为投加药剂处理制革废水,并考察反应时间、反应温度、钙氯摩尔比、铝氯摩尔比等因素对脱氯效果的影响。
1 试验
1.1 试验材料与仪器
氧化钙(CaO)、偏铝酸钠(NaAl O2)、硝酸银(AgNO3):AR,西陇科学股份有限公司;铬酸钾(K2CrO4):AR,福晨(天津)化学试剂有限公司;废水:兴业皮革科技股份有限公司。精密电子天平:KD-2100TEC,福州科迪电子技术有限公司;六联数显加热磁力搅拌器:HJ-6A,福建药典实验科技有限公司;抽滤装置:天津市津腾实验设备有限公司。
1.2 试验方法
将装有100 mL废水的烧杯放置于加热磁力搅拌器上,在一定温度下加入氧化钙和偏铝酸钠,反应一段时间后得到含有综合污泥和脱氯废水的混合物,将混合物通过1μm的微孔滤膜过滤并收集滤液,测定滤液的氯离子含量并计算脱氯率。
1.3 分析方法
1.3.1 氯离子含量的测定
参照GB 11896-1989《水质氯化物的测定硝酸银滴定法》。
1.3.2 脱氯率的计算
脱氯率的计算参考式(1):

式中:c1——初始氯离子浓度,ppm;
c2——滤液氯离子浓度,ppm。
2 结果与讨论
2.1 反应时间对脱氯效果的影响
取兴业皮革科技股份有限公司某段废水,将悬浮物过滤后测试废液中氯离子浓度为10475 ppm。弗氏盐法除氯的原理主要是Cl-、Ca2+、Al3+之间的沉淀反应,体系中反应较为复杂,主要发生的化学反应如下[10,11]:

反应生成的Ca2AlCl(OH)6为难溶性沉淀,会与多余的CaO、Ca(OH)2、Al(OH)3形成综合污泥。除了以上的主反应外,弗氏盐法脱氯还有三个副反应:

三个副反应均会降低脱氯效率,其中生成的Ca2Al(OH)7当体系内Cl-含量较高时,可发生Cl-和OH-的取代反应;但是Ca3Al2(OH)12的脱氯性能极弱,且Ca3Al2(OH)12不易向Ca2Al(OH)7和Ca2AlCl(OH)6转变。弗氏盐Ca2AlCl(OH)6的沉淀平衡常数是10-27.10,Ca2Al(OH)7的平衡常数10-25.02,因此弗氏盐法脱除氯离子首先生成的是Ca2AlCl(OH)6,而后转化为Ca2Al(OH)7[12]。弗氏盐Ca2AlCl(OH)6的结构图如图1所示。Ca2AlCl(OH)6拥有类似于水滑石的结构,由Al3+、Ca2+和OH-形成的层状结构,其主体层的结构简式可用[Ca2Al(OH)6]+表示,层状结构中间为游离Cl-、OH-和H2O(氯离子可能为水合形态,Cl-·2H2O)[13]。

图1 Ca2AlCl(OH)6的结构Fig.1 The structure of Ca2AlCl(OH)6
固定反应温度为30℃,钙氯比为10∶1(摩尔比,下同),铝氯比为4∶1(摩尔比,下同),考察不同反应时间对脱氯效果的影响,其中评价指标为废液氯离子浓度和脱氯率,结果如图2所示。

图2 反应时间对脱氯效果的影响Fig.2 Effect of reaction time on dechlorination effect
随着反应时间的增加,脱氯率先增加后降低,在3 h时脱氯率达到最大,为97.84%,此时的氯离子浓度为226 ppm。在反应初期,由于氧化钙在水中的溶解度较低,因此此时主要发生的是氧化钙、偏铝酸钠与氯离子生成Ca2AlCl(OH)6的反应。随着时间的延长,残余的OH-与Cl-竞争,逐渐置换出Cl-,而OH-离子含量的降低又会促进氧化钙的溶解,继续产生大量的OH-;此外过量的OH-还降低了体系中Al(OH)3的含量,抑制了AlO2-的水解,而AlO2-、过量的OH-还会与生成的Ca2AlCl(OH)6反应,使一部分Cl-继续进入溶液,发生的反应如下[10,11,14]:
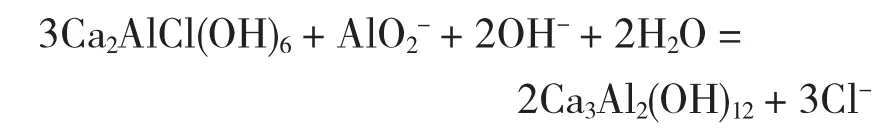
因此,随着反应时间的延长,由于氧化钙溶解产生的OH-会降低脱氯率。综合考虑脱氯率和废液中的氯离子含量,选择3 h为最佳的反应时间。
2.2 反应温度对脱氯效果的影响
生成弗氏盐Ca2AlCl(OH)6的反应较为复杂,包括了氧化钙的溶解反应、偏铝酸钠的水解反应、弗氏盐的沉淀反应等,这些反应大多数为可逆反应,而反应温度的改变对反应的影响不尽相同,因此需考虑反应温度对脱氯效果的影响。选择钙氯比为10∶1,铝氯比为4∶1,当反应时间为3 h时,探究不同反应温度对废液中氯离子浓度和脱氯率的影响,结果如图3所示。

图3 反应温度对脱氯效果的影响Fig.3 Effect of reaction temperature on dechlorination effect
从图3中可以发现,随着反应温度的提升,脱氯率呈现先上升后下降的趋势。随着温度的提升,偏铝酸钠的水解反应加剧,偏铝酸钠的水解反应的进行有利于生成弗氏盐,因此当温度从25℃提升至30℃时,脱氯率有所提升,废液中氯离子含量有一定降低。而与偏铝酸钠在水中水解的情况不同的是,氧化钙溶解在水中的反应是一个放热反应,从反应进程的角度上看,温度的提升不利于氢氧化钙在水中的溶解与电离,氢氧化钙在30℃的水中溶解度为0.153g,当温度提升至50℃时,溶解度仅剩余0.138 g,从氧化钙溶解的情况上看,温度的提升不利于弗氏盐的生成。此外,温度越高,弗氏盐Ca2AlCl(OH)6溶解度越高,脱氯率缓慢下降,溶液中氯离子含量逐渐上升。当温度提升至40℃以上时,Ca2AlCl(OH)6稳定性下降,Ca2AlCl(OH)6不断分解为Ca3Al2(OH)12[15]。因此随着温度的提升,首先起主导作用是偏铝酸钠的水解反应加剧,脱氯率提升;而后氧化钙溶解度下降,弗氏盐溶解度提升起主导作用,脱氯率出现了一定的下降;随着温度的不断提升,超过40℃时,此时体系内主要发生的是弗氏盐的分解反应。因此,在实际生产中,反应温度在25℃至40℃均可,不必特地调节反应温度。在本实验中,反应温度选择为30℃,此时Ca2AlCl(OH)6的层状结构最为稳定。
2.3 钙氯比对脱氯效果的影响
氧化钙的用量也影响着弗氏盐的形成从而影响脱氯效果。当反应温度为30℃,反应时间为3 h,铝氯比为4∶1时,研究钙氯比对脱氯效果的影响,结果如图4所示。

图4 钙氯比对脱氯效果的影响Fig.4 Effect of calcium-chlorine ratio on dechlorination effect
从图4中可以发现,钙氯比对脱氯效果的影响较大,钙氯比在4∶1至10∶1范围内,随着氧化钙用量的增大,脱氯率快速增加,溶液中氯离子含量迅速降低。随着氧化钙的过量,脱率效率出现了一定下降,且下降幅度较小。当钙氯比低于10∶1时,Ca2AlCl(OH)6的层状结构尚未成型,Cl-并不能完全地进入Ca2AlCl(OH)6的层间。随着氧化钙用量的逐渐增大,Ca2AlCl(OH)6的层状结构逐渐成型,脱氯率达到最大,为97.84%,此时溶液中残余的氯离子浓度为226 ppm。随着氧化钙的过量,层间的Cl-与Ca(OH)2溶解电离产生的OH-相互竞争,层间的Cl-不断溶出,加之过量的Ca(OH)2还可与NaAlO2、Ca2AlCl(OH)6反应生成Ca3Al2(OH)12,也会造成Cl-的进一步溶出[16]。弗氏盐层间离子强度如下,离子强度越强,越倾向于替代离子强度弱的阴离子[17]:

因此,钙氯比不宜过高或过低,10∶1为最佳。
2.4 铝氯比对脱氯效果的影响
与氧化钙用量相同的是,偏铝酸钠的用量也会影响弗氏盐的形成,从而影响脱氯效率。当反应温度为30℃,反应时间为3 h,钙氯比为10∶1时,测试不同铝氯比下的脱氯率和溶液氯离子浓度,结果如图5所示。

图5 铝氯比对脱氯效果的影响Fig.5 Effect of aluminium-chlorine ratio on dechlorination effect
与钙氯比类似的是,随着偏铝酸钠用量的增大,脱氯率也呈现快速增加、缓慢增加后缓慢降低、快速降低的趋势,同样的溶液中残留的氯离子含量呈相反趋势。这种相似的变化趋势也证明了当铝氯比低于4∶1时,Ca2AlCl(OH)6尚未完全形成的结论。与钙氯比不同的是,偏铝酸钠的过量会导致脱氯效果的降低。从物质的溶解情况上看,由于氢氧化钙的溶解度较低,因此为了保证充足的Ca2+、OH-离子含量,氧化钙是略微过量的(即10∶1的钙氯比便已经是过量的氧化钙),此外为了保证综合污泥压滤时的成型性,也需要过量的氧化钙。因此在分析钙氯比时发现,在规定时间内,氧化钙用量的大幅度提升并不会对氯离子的脱除效果产生太大影响。但是偏铝酸钠在水中的溶解度极高,30℃下在水中的溶解度约为87.3 g,因此当体系总引入过量的偏铝酸钠时,此时体系内的AlO2-含量会急剧增加,促进了Ca2AlCl(OH)6向Ca3Al2(OH)12的转换[18]。因此,过量的偏铝酸钠会造成脱氯效率的急剧降低。此外,过量的偏铝酸钠也会将未有Cl-进入层板间的Ca2Al(OH)7直接反应生成无Cl-脱除能力的Ca3Al2(OH)12:

总的来说,偏铝酸钠的用量应适量,铝氯比为4∶1时最佳,此时脱氯率最高,溶液中残留的氯离子浓度最低。
综上所述,氯离子浓度为10475 ppm的制革废水在30℃下处理3 h,投料钙氯比为10∶1,铝氯比为4∶1时,脱氯效果最好,脱氯率最高,可达97.84%,废液中氯离子残留为226 ppm。
3 总结
在制革工业中,处理综合废水时往往先絮凝除去水中的悬浮物,而后加入CaO和FeSO4进行初沉、二沉重金属离子等限制物,弗氏盐法沉淀Cl-使用的材料为CaO和NaAlO2,常规CaO/FeSO4法和弗氏盐法所得废水均为具有一定碱性,从理论上说弗氏盐法脱除氯离子可在二沉时进行,或增设三沉,产出的低氯废水按常规工艺进行后续操作。若要在二沉时进行,则需优化初沉、二沉的工艺,降低FeSO4对弗氏盐形成的影响。
(1)研究了反应温度、反应时间、钙氯比、铝氯比对制革高氯废水脱氯效果的影响,最佳的脱氯条件为:反应温度30℃,反应时间3 h,钙氯比10∶1,铝氯比4∶1,脱氯后,废水中残余的氯离子含量为226 ppm,脱氯率可达97.84%。
(2)弗氏法脱除废水中的氯离子时,应严格控制各反应条件,以确保层状Ca2AlCl(OH)6的形成,同时尽量避免形成Ca3Al2(OH)12导致Cl-的溶出,造成脱氯效率的降低。
致谢:对课题研究和论文予以悉心指导、修改的周华龙教授,致以诚挚的感谢。

