高浓度蔗糖乙醇分批发酵过程
刘明,伍时华,龙秀锋,易弋,赵雪梅
1.广西科技大学生物与化学工程学院(柳州 545006);2.广西科技大学广西糖资源绿色加工重点实验室(柳州 545006)
广西盛产甘蔗,甘蔗主要用来生产白砂糖,副产物甘蔗糖蜜主要用于发酵生产酒精,可加工成食用酒精、医用酒精和燃料乙醇[1]等产品。医用酒精是新冠肺炎疫情防控的重要物资,用量剧增。蔗糖酒精发酵用的酿酒酵母能分泌蔗糖水解酶,在细胞外水解蔗糖生成果糖和葡萄糖[2],酵母细胞在胞内利用葡萄糖和果糖经糖酵解途径生成丙酮酸,在无氧条件下丙酮酸经氧化脱羧和加氢还原转化为乙醇。葡萄糖与果糖共用一套膜运输和酶催化体系,但由于膜运输和酶亲和力的差异,酵母葡萄糖利用率大于果糖利用率[3-4]。
甘蔗汁和甘蔗糖蜜乙醇发酵的文献有很多,模拟甘蔗汁发酵下果糖和葡萄糖利用的差异性研究[5-7],不同浓度甘蔗原汁发酵和调整甘蔗汁总糖浓度进行高浓度乙醇发酵研究[8-11],不同菌株对甘蔗糖蜜乙醇发酵比较和可行性研究[12-14],甘蔗糖蜜在不同工艺下高产酒精[15-17]等方面,但是鲜有从过程中探究蔗糖乙醇发酵过程规律的文献,因此研究高浓度蔗糖乙醇发酵过程中酵母、乙醇、糖类过程中的变化就显得比较有意义。试验研究高质量浓度(260 g/L)蔗糖乙醇分批发酵过程中酵母生长、乙醇生成、总糖消耗的规律,为实现甘蔗糖蜜和甘蔗汁高浓度乙醇发酵生产提供试验研究依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
酿酒酵母GJ2008(Saccharomycescerevisiae,广西科技大学发酵工程研究所保藏,适用于蔗糖高浓度乙醇发酵)。
1.1.2 培养基
一(二)级种子培养基:葡萄糖20(40)g/L,蛋白胨20 g/L,酵母粉10 g/L,pH自然。
蔗糖发酵培养基:蔗糖260 g/L,蛋白胨20 g/L,酵母粉10 g/L,pH自然。
以上培养基均使用高压蒸汽115 ℃灭菌20 min。
1.1.3 试剂与原料
葡萄糖、果糖(AR级,天津市科密欧化学试剂有限公司);蔗糖、硫酸(西陇科学股份有限公司);乙腈、乙醇(安徽时联特种溶剂有限公司);酵母粉、蛋白胨(BR级,广东环凯微生物科技公司);蔗糖(市售)。
1.1.4 仪器与设备
HITACHI高效液相色谱分析仪、HIMAC大容量冷冻离心机(日本株式会社日立制作所);BIOTECH-5BG×5-9400五联5 L发酵罐(上海保兴生物设备公司);LDZH-100KBS立式压力灭菌器(上海申安医疗器械厂);BX43生物显微镜(奥林巴斯有限公司);ZWYR-C2402触控二叠加摇床(上海智诚分析仪器制造有限公司)。
1.2 试验方法
1.2.1 种子培养方法
将实验室保存的酿酒酵母GJ2008菌种斜面接一环至一级种子培养基(50 mL三角瓶装液量30 mL)中,按150 r/min摇床32 ℃培养12 h,取菌液离心去上清,用无菌水稀释成10倍浓缩菌悬液。将一级种子浓缩菌悬液接至二级种子培养基(500 mL三角瓶装液量300 mL)中,按150 r/min摇床32 ℃培养8 h后离心去上清,用无菌水稀释菌泥成10倍浓缩菌悬液。
1.2.2 发酵方法
将二级种子浓缩菌悬液接至5 L发酵罐(3 L装液量)发酵培养基,转速150 r/min,发酵温度32 ℃,微通氧80 mL/min。
1.3 检测分析方法
酵母细胞数的测定采用血球计数板法。
液相色谱检测糖条件:流动相为V乙腈∶V超纯水=75∶25(色谱纯),流速1 mL/min,进样量20 μL,柱温30 ℃,示差折光检测器温度35 ℃。
液相色谱检测乙醇条件:流动相采用5 mmol/L硫酸溶液,流速0.6 mL/min,进样量20 μL,柱温35 ℃;示差折光检测器温度40 ℃。所有上机样品均经超纯水稀释至合适倍数经0.45 μm滤膜过滤至进样瓶中。
1.4 计算公式

式中:葡萄糖或果糖减少量=前次取样葡萄糖或果糖实测值+取样间隔时间内蔗糖水解增加的葡萄糖或果糖的量-当时取样葡萄糖或果糖实测值

2 结果与分析
2.1 高浓度蔗糖乙醇分批发酵过程曲线
从0 h开始每隔3 h从5 L发酵罐中取发酵液样品测定蔗糖、果糖、葡萄糖、乙醇浓度以及酵母细胞数,绘制260 g/L蔗糖乙醇分批发酵过程曲线见图1。
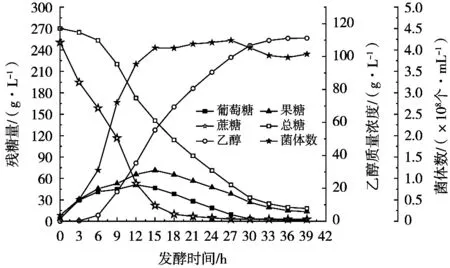
图1 260 g/L蔗糖乙醇分批发酵过程曲线
蔗糖乙醇发酵过程,蔗糖快速水解产生葡萄糖和果糖,酵母细胞利用葡萄糖和果糖进行生长繁殖和无氧代谢生成乙醇,总糖消耗的实质是葡萄糖和果糖消耗。图1中残葡萄糖和残果糖先升高后降低,是由葡萄糖和果糖的蔗糖水解生成量与同期消耗量的多少决定。葡萄糖和果糖生成量大于消耗量则表现为残糖量升高,反之降低。发酵0~15 h酵母快速生长,同期蔗糖快速水解;发酵6~30 h总糖大量消耗,同期乙醇大量生成;发酵至30 h,残葡萄糖量已很低,但残果糖量相对较高。要更深入探究蔗糖水解、葡萄糖和果糖消耗、酵母生长、乙醇生成的规律及总糖消耗、酵母生长和乙醇生成的相互关系,需要进一步分析和讨论。
2.2 高浓度蔗糖乙醇分批发酵酵母生长规律
依据图1作图数据计算发酵过程不同时间段的酵母生长速率,结合酵母生长曲线,得到图2。
结合图2的生长速率,260 g/L蔗糖乙醇分批发酵过程的酵母生长曲线可分为快速生长期(0~15 h)和稳定期(15~39 h,27 h后酵母细胞数略有下降)。从0 h的细胞浓度(1.4×107个/mL)和0~3 h的酵母生长速率(1.23×107CFU/(mL·h))可知,0~3 h细胞生长较快,这主要与所接种的二级种子处于快速生长后期,酵母细胞繁殖能力强有关。细胞在6~9 h达到最大生长速率5.27×107CFU/(mL·h),发酵过程细胞浓度最大值为4.23×108CFU/mL,明显比常规酒精厌氧发酵细胞数(1.2×108~1.5×108CFU/mL)高,这主要与试验采用微通氧(通风量80 mL/min)发酵技术有关。高浓度乙醇发酵过程连续或间歇微通氧,可使酵母细胞产生更多的能量,细胞结构物质得以合成和更新,大幅提高酵母浓度,细胞活力得以维持,增强酵母生产乙醇的能力,明显缩短发酵时间。
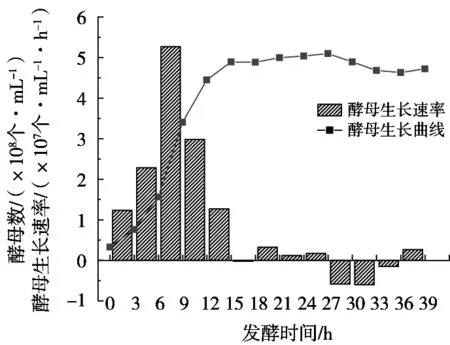
图2 260 g/L蔗糖乙醇分批发酵过程酵母生长曲线及其生长速率图
2.3 高浓度蔗糖乙醇分批发酵乙醇生成规律
依据图1作图数据计算发酵过程不同时间段的乙醇生成速率,结合乙醇生成曲线,得到图3。
由图3可知,260 g/L蔗糖乙醇分批发酵过程中6~30 h是乙醇生成主要阶段(对发酵终了生成的乙醇量占比92.69%),6~15 h乙醇加速生成(占比59.16%),15~30 h乙醇降速生成(占比37.28%),12~15 h乙醇生成速率最大达到6.7 g/(L·h)。此外,0~3 h和36~39 h的乙醇生成量很少(占比0.25%和0.1%),3~6 h和30~36 h共9 h的乙醇生成量较少(占比6.96%)。结合2.2的酵母生长规律分析,得知高浓度蔗糖乙醇分批发酵过程乙醇生成与酵母生长偶联,而且相当一部分的总糖需要在酵母生长稳定期转化为乙醇。
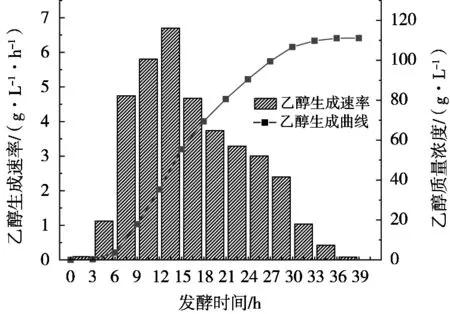
图3 260 g/L蔗糖乙醇分批发酵过程乙醇生成曲线及其速率图
2.4 高浓度蔗糖乙醇分批发酵蔗糖水解、果糖和葡萄糖消耗规律
依据图1残蔗糖、残果糖和残葡萄糖数据,计算并绘制发酵过程蔗糖水解、果糖和葡萄糖消耗曲线和不同时间段的蔗糖水解、果糖和葡萄糖消耗速率得到图4和图5。将发酵过程分为四个区间进行蔗糖水解、葡萄糖和果糖消耗对比,结果如表1。
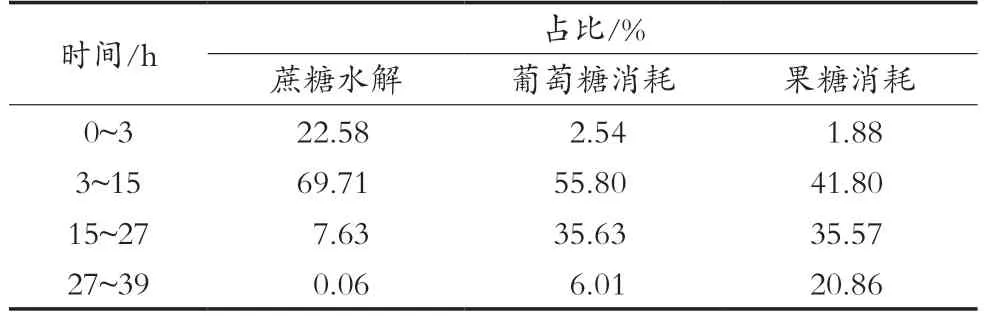
表1 糖类物质区间变化表
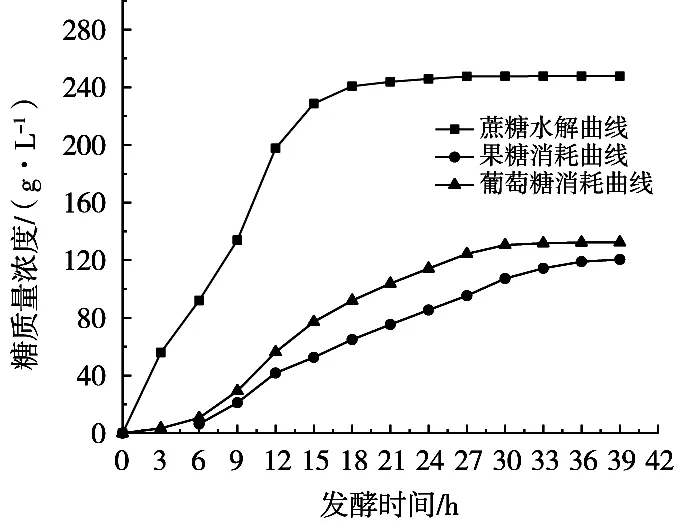
图4 蔗糖水解、果糖和葡萄糖消耗曲线图
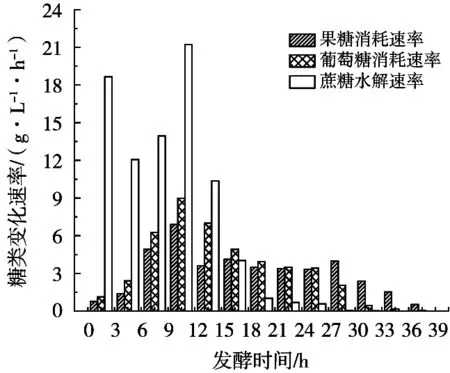
图5 蔗糖水解、果糖和葡萄糖消耗速率图
综合表1和图4、图5进行分析可知,蔗糖水解主要集中在发酵0~15 h(占比92.29%),说明酵母在快速生长期大量释放蔗糖水解酶。期间0~3 h蔗糖水解较多(占比22.58%),水解速率(18.65 g/(L·h))较高,这是由于接种的二级种子细胞不仅繁殖能力强,而且成熟的酵母细胞能够迅速释放蔗糖水解酶到胞外水解蔗糖生成葡萄糖和果糖。葡萄糖消耗主要集中在3~27 h(占比91.43%),同期果糖消耗占比为77.37%,果糖消耗同比低14.06%,并且葡萄糖平均消耗速率(4.61 g/(L·h))大于果糖平均消耗速率(3.53 g/(L·h))。发酵终了残葡萄糖只有1.46 g/L,而残果糖13.49 g/L。结果表明,高浓度蔗糖乙醇发酵过程,酵母细胞对葡萄糖的消耗大于对果糖的消耗。有关果糖利用不彻底的原因分析,与发酵条件中葡萄糖浓度[19]、乙醇[3]、温度[4]等的影响有关。更与酵母细胞己糖跨膜转运对葡萄糖和果糖的亲和力不同相关,这是造成发酵过程中葡萄糖消耗速率高于果糖消耗速率的重要原因[20]。发酵后期如何提高果糖消耗,降低残果糖量,值得进一步深入研究。
2.5 高浓度蔗糖乙醇分批发酵过程酵母生长、总糖消耗、乙醇生成的关系分析
依据图4果糖和葡萄糖消耗数据和图1中酵母生长、乙醇生成数据计算并绘制图6和图7。
糖醇转化率是生成的乙醇对所消耗的总糖(葡萄糖+果糖)的百分比,理论值为51.1%,实际糖醇转化率越高,说明消耗的总糖转化为乙醇越多。酵母细胞消耗的总糖用于菌体生长、维持菌体生命活动、代谢产生乙醇、CO2及高级醇等产物,因此,发酵全过程的实际糖醇转化率(48%)要低于理论值,但不同发酵时间段的糖醇转化率会有所不同。试验检测的是酵母细胞外发酵液中的残葡萄糖、残果糖浓度和乙醇浓度,细胞外的葡萄糖和果糖进入细胞经无氧代谢转化成乙醇和乙醇排出到细胞外需要一定时间。分析图6和图7,结合前面的酵母生长、乙醇生成和蔗糖水解、葡萄糖与果糖消耗规律分析可知,260 g/L蔗糖乙醇分批发酵0 h-6 h糖醇转化率尚低(21.8%),耗糖主要用于细胞快速生长,合成并释放蔗糖水解酶到细胞外快速水解蔗糖;发酵6~30 h是乙醇生成的主要阶段,糖醇转化率高(46.72%),12~15 h的糖醇转化率最高(63.36%),15~21 h的糖醇转化率超过50%;发酵30~39 h的糖醇转化率从37.0%较快降低到14.59%,这9 h的糖醇转化率偏低(30.53%)。全发酵过程酵母消耗总糖252.36 g/L,产生乙醇111.17 g/L,糖醇转化率为44%。发酵后期糖醇转化率偏低,是导致全发酵过程糖醇转化率偏低的重要原因。
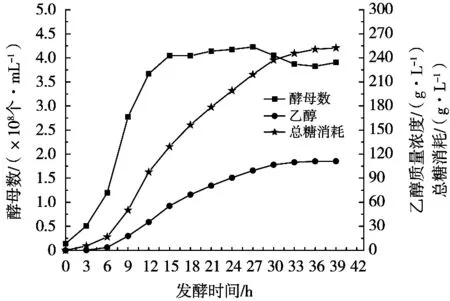
图6 260 g/L蔗糖乙醇分批发酵过程酵母生长、乙醇生成、总糖消耗折线图

图7 260 g/L蔗糖乙醇分批发酵过程酵母生长、乙醇生成、总糖消耗速率图
2.6 高浓度蔗糖乙醇分批发酵发酵效果分析
将图1数据按照1.4中公式处理并计算得到表2。
总糖发酵效率反映糖醇转化实际值对理论值的百分比,是评价乙醇发酵效果的重要指标,与发酵终了的乙醇浓度和残总糖浓度密切相关。总糖浓度一定时,发酵得到的乙醇浓度越高、残总糖越低,总糖发酵效率就越高,发酵效果就更好。由表2可知,蔗糖水解率(98.89%)和葡萄糖利用率(98.91%)很高,葡萄糖利用率比果糖利用率(89.92%)高出8.99%;总糖发酵效率(80.5%)偏低(未达到90%),这主要与耗糖发酵效率(86.19%)偏低(未达到92%~95%)、总糖利用率(93.39%)偏低(未达到98%)和乙醇质量浓度(111.1 g/L)偏低(未达到125 g/L)有关。残总糖(17.86 g/L)偏高(大于5 g/L),主要是残果糖(13.49 g/L)偏高(占残总糖的75.5%),其次是残蔗糖(2.89 g/L,相当总糖3.03g/L,占比17%),会导致总糖利用率偏低。我们正在研究高浓度蔗糖乙醇分批发酵过程酿酒酵母细胞活性(细胞数及存活率)和发酵活力(耗糖能力和乙醇生成能力)及其提高策略,努力提高发酵终了乙醇浓度和糖醇转化率。
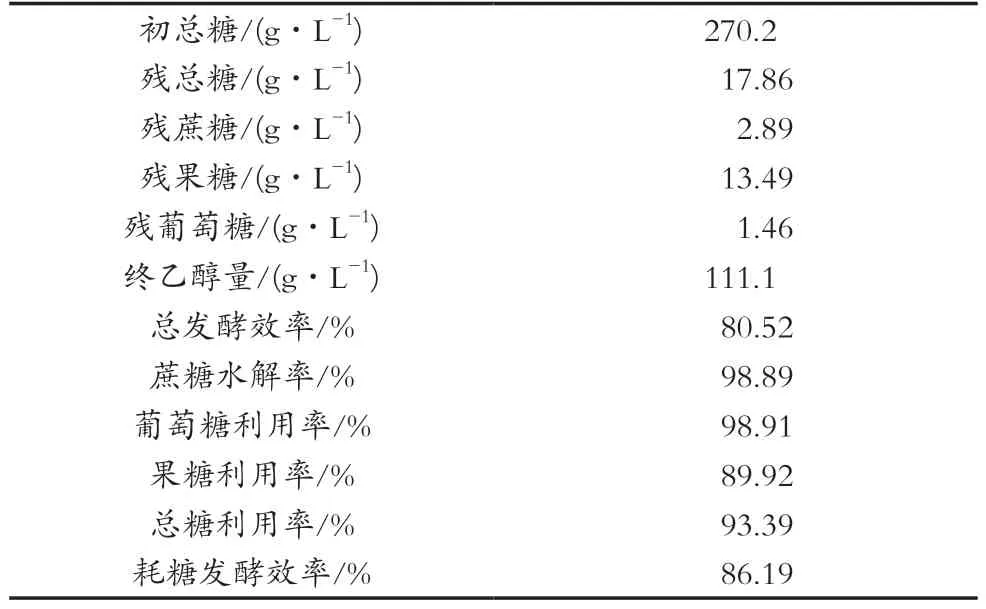
表2 260 g/L蔗糖乙醇分批发酵结果
3 结论
开展260 g/L蔗糖乙醇5 L罐分批发酵试验,结果表明,酵母生长分为快速生长期(0~15 h)和稳定期(15~39 h);蔗糖快速水解主要集中在0~15 h,从15 h缓慢水解到27 h停止水解;葡萄糖消耗主要集中在3~27 h,整个发酵过程葡萄糖利用率(98.91%)比果糖利用率(89.92%)高8.99%,发酵终了残葡萄糖(1.46 g/L)少而残果糖(13.49 g/L)较多;发酵6~30 h是乙醇生成(占比92.69%)主要阶段,糖醇转化率高(46.72%),而发酵后期(30~39 h)糖醇转化率(30.53%)偏低,是导致全发酵过程糖醇转化率(44%)偏低的重要原因。因此,高浓度蔗糖乙醇分批发酵要提高发酵效率,一要设法提高果糖利用率,降低残果糖浓度,二要设法提高发酵后期糖醇转化率。

